Содержание
- 2. Трудоемкость и длительность поиска лекарственных средств в XX веке заставляла ученых задумываться над разработкой теоретических основ
- 3. Так возникали подходы не только к выявлению взаимосвязи биологических свойств веществ с их структурой, но и
- 4. Зарождение QSAR Подобные исследования привели к рождению целого научного направления, называемого в современной химии лекарств QSAR
- 5. Определение QSAR – это математический аппарат, позволяющий проводить корреляции, т.е. статистическую взаимосвязь двух или более случайных
- 6. Важная задача QSAR Заключается в идентификации и количественном выражении структурных параметров или физико-химических свойств молекул с
- 7. Методология QSAR сформировалась к середине 1960-х гг. Ее основателем считается американский ученый Корвин Ганч, хотя в
- 8. Открытия Т.Фрезер А. Крум - Браун
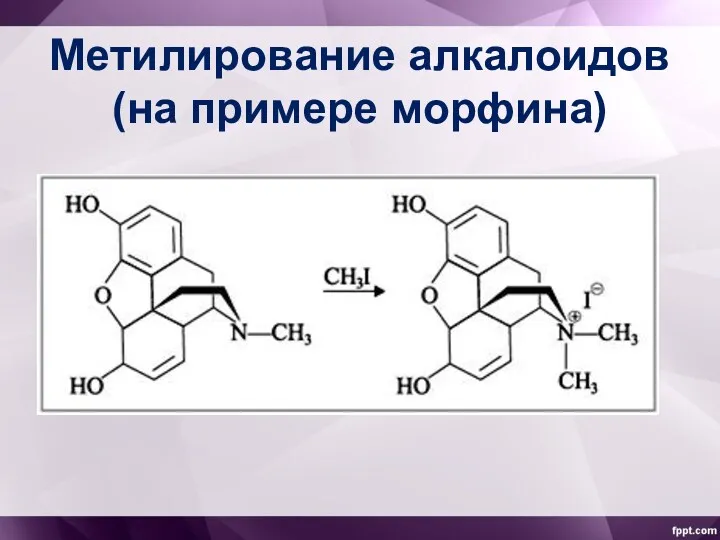
- 9. Открытия В 1869 г. А.Крум-Браун и Т.Фрезер, исследуя токсическое действие различных алкалоидов и продуктов их метилирования,
- 10. Метилирование алкалоидов (на примере морфина)
- 11. Уравнение Крум-Брауна и Фрезера Физиологическая активность (Ф) должна быть функцией химической структуры (С) Первая общая формулировка
- 12. Открытия В 1869 г. Б.Ричардсон обнаружил, что в гомологических рядах спиртов жирного ряда концентрации веществ, вызывающих
- 13. Открытия С.Бинц в 1880-х гг. вывел заключение о возрастании наркотического действия с увеличением количества атомов хлора
- 14. Открытия В 1893 г. Рише получил количественную зависимость токсичностей этилового спирта, диэтилового эфира, «экстракта полыни» и
- 15. На основании полученных результатов Рише сделал заключение: чем более соединение растворимо, тем менее оно токсично.
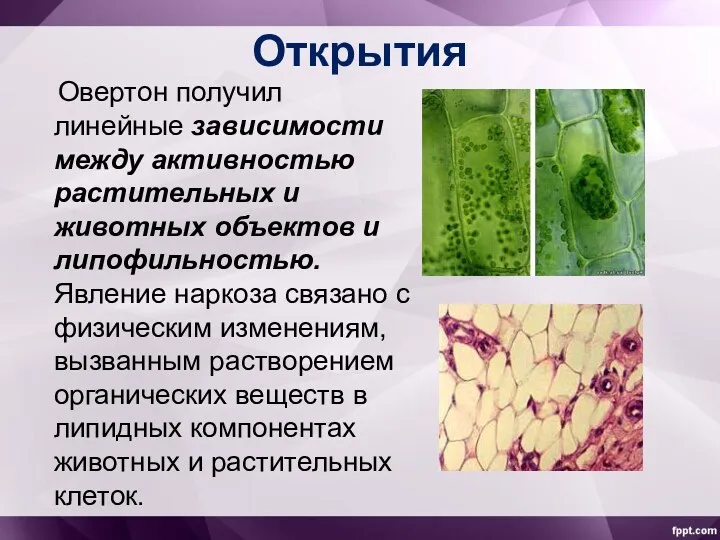
- 16. Открытия Овертон получил линейные зависимости между активностью растительных и животных объектов и липофильностью. Явление наркоза связано
- 17. Открытия В начале 1940-х гг. Николай Васильевич Лазарев проанализировал значения токсичностей и коэффициентов распределения в системе
- 18. Открытия Лазарев построил графические корреляции, используя двойную логарифмическую шкалу, что позволило наблюдать линейные зависимости логарифмов коэффициентов
- 19. Исследования С.Фри и Дж. Вильсона (1964) Биологическая активность определяется как сумма вкладов, вносимых каждым заместителем в
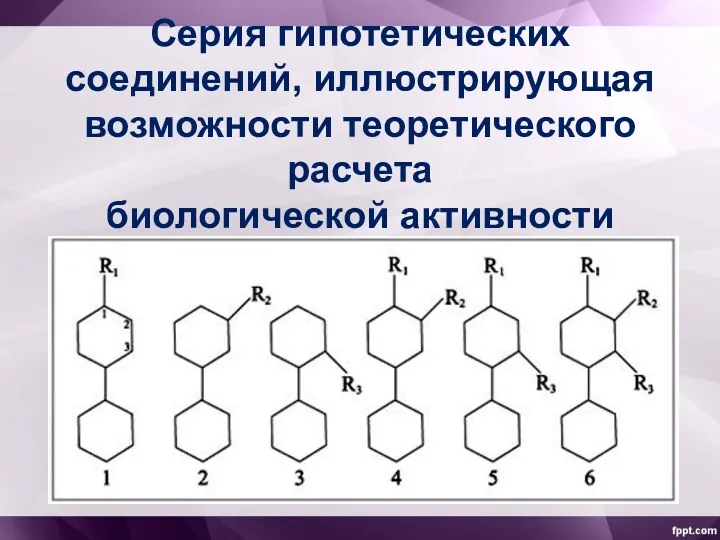
- 20. Так, для серии гипотетических соединений активность (А) будет определяться уравнением: где Ki – вклад заместителя Ri,
- 21. Серия гипотетических соединений, иллюстрирующая возможности теоретического расчета биологической активности
- 22. Корвин Ганч - основатель QSAR
- 23. В 1964 г. Корвин Ганч опубликовал в журнале Американского химического общества свою работу «––– анализ. Метод
- 24. Идеи Корвина Ганча Он предложил скомбинировать в одном уравнении сразу несколько структурных параметров, характеризующих электронные, стерические
- 25. Идеи Корвина Ганча Он заключил, что для связывания с молекулами-мишенями лекарственные соединения должны иметь возможность, с
- 26. Идеи Корвина Ганча Зависимость активности от коэффициента распределения будет представлять собой параболическую кривую, имеющую максимум. Подобные
- 27. Корреляционное уравнение для данного вида активности : где с – любая экспериментальная величина, характеризующая биологическую активность,
- 28. Основной характеристикой липофильности молекулы, используемой в корреляционных уравнениях, является логарифм коэффициента распределения в системе октанол–вода.
- 29. Идеи Корвина Ганча Одна из идей Ганча заключалась в том, что эту величину можно представить как
- 30. Значения для гидрофильных групп (например, для карбоксила) и положительные – для гидрофобных групп (например, для метила).
- 31. В настоящее время подход Ганча получил свое развитие и широко используется для поиска корреляций между биологической
- 32. Корреляционные соотношения чрезвычайно важны для предсказания структурных модификаций химических соединений, способствующих повышению их биологической активности. В
- 33. Место QSAR в системе оценки мутагенности Методология QSAR может быть с успехом использована для внеэкспериментального прогноза
- 35. Скачать презентацию





























 Indicatori di pH
Indicatori di pH Альдегиды и кетоны
Альдегиды и кетоны Химические свойства основных оксидов
Химические свойства основных оксидов Реальные газы, жидкости и твердые тела
Реальные газы, жидкости и твердые тела Лекция Атомное строение твердых тел. 1-01
Лекция Атомное строение твердых тел. 1-01 Vi топ элементтері. Оттегі, күкірт қасиеттері және қосылыстары
Vi топ элементтері. Оттегі, күкірт қасиеттері және қосылыстары Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы
Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы Выращивание кристаллов
Выращивание кристаллов Синтез нуклеотидов
Синтез нуклеотидов Зеленая химия и проблемы устойчивого развития
Зеленая химия и проблемы устойчивого развития Азотная кислота. Получение, свойства. Нитраты, азотные удобрения
Азотная кислота. Получение, свойства. Нитраты, азотные удобрения Переработка тяжелых нефтей, битумов и нефтяных остатков
Переработка тяжелых нефтей, битумов и нефтяных остатков Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Теория сильных и слабых электролитов
Теория сильных и слабых электролитов Общая характеристика неметаллов
Общая характеристика неметаллов Гидролиз. Классификация солей
Гидролиз. Классификация солей Физико-химия поверхностных явлений
Физико-химия поверхностных явлений Предельные одноатомные спирты
Предельные одноатомные спирты Волшебные кристалы
Волшебные кристалы Инертные газы
Инертные газы Кислоты. Классификация кислот, их химические свойства
Кислоты. Классификация кислот, их химические свойства Альдегиды и кетоны. Циветон
Альдегиды и кетоны. Циветон Основи. Хімія
Основи. Хімія Неізогіпсичні перетворення функціональних груп. Реакції окиснення
Неізогіпсичні перетворення функціональних груп. Реакції окиснення Атомный и ионный радиусы. Принципы шаровых упаковок
Атомный и ионный радиусы. Принципы шаровых упаковок Теория электролитической диссоциации
Теория электролитической диссоциации Изомеризация пентан-гексановой фракции
Изомеризация пентан-гексановой фракции Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение