Содержание
- 4. Электролитическая диссоциация (ЭД) – процесс распада молекул электролита на ионы в растворе (под действием молекул воды
- 5. Основные работы посвящены учению о растворах и кинетике химических реакций. На основании своих исследований (1882–1883) высказал
- 8. Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь
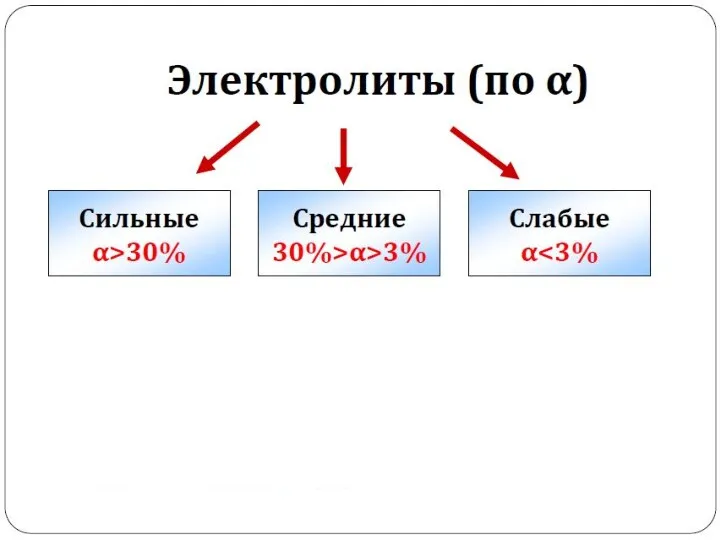
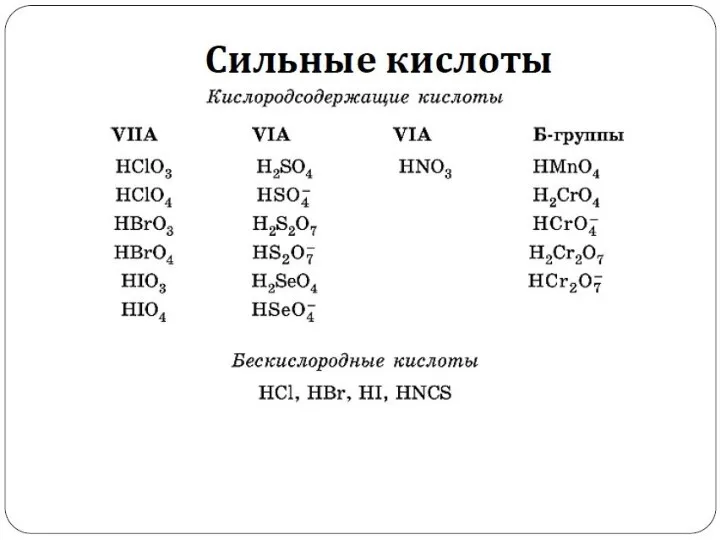
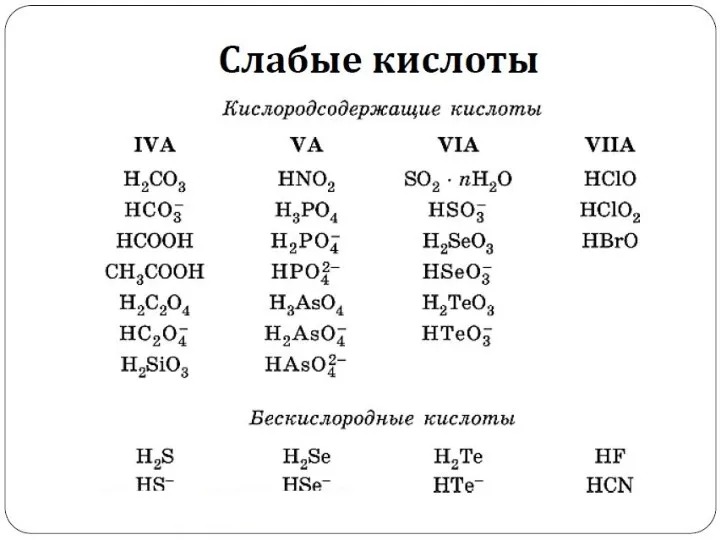
- 11. Сильные и слабые электролиты. Степень и константа диссоциации.
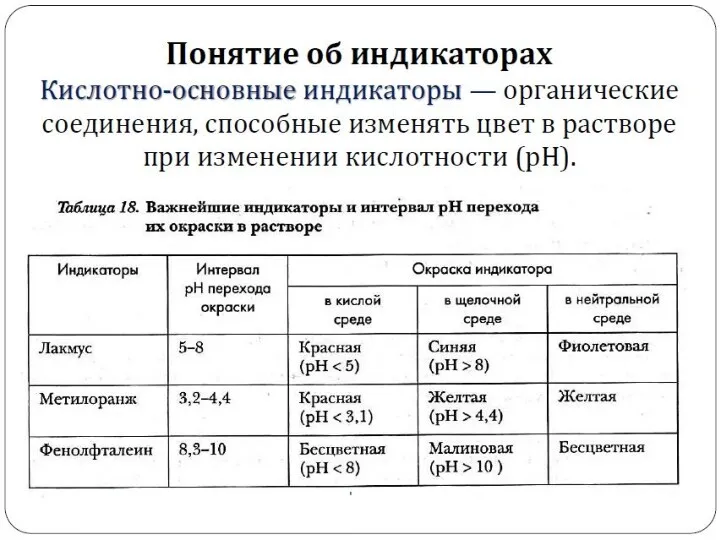
- 23. Ионное произведение воды. Понятие о рН раствора.
- 30. Гидролиз неорганических и органических соединений
- 31. 1. Гидролиз неорганических соединений
- 32. Гидролиз – реакция обменного взаимодействия химического вещества с молекулами воды. Слово «гидролиз» означает разложение водой («гидро»
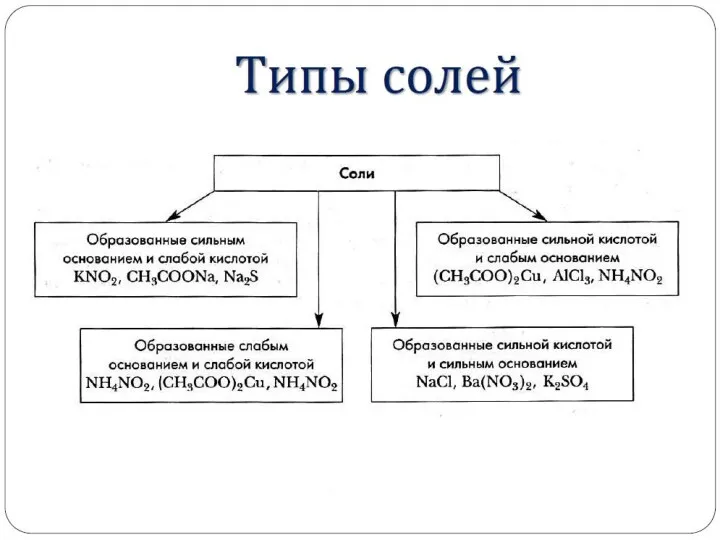
- 34. Соли, образованные слабым основанием и сильной кислотой FeCl2, NH4Cl, Al2(SO4)3, MgSO4 (гидролиз по катиону). Гидролизу подвергаются:
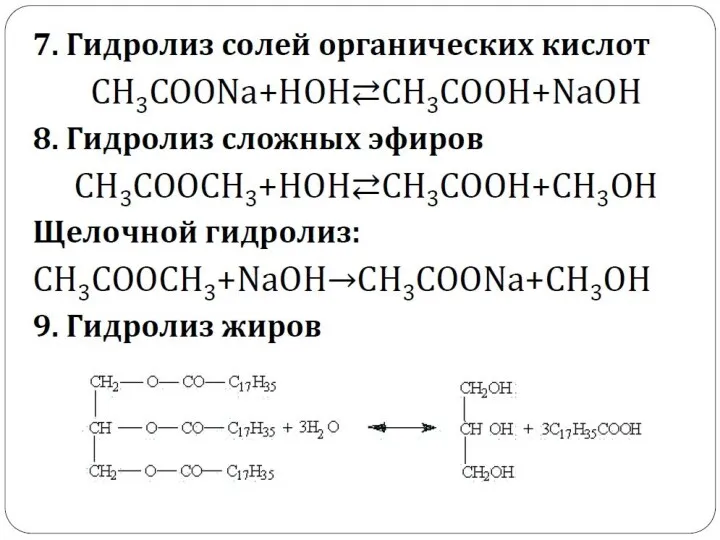
- 39. 2. Гидролиз органических соединений
- 44. Температура. Опыт. Усиление гидролиза солей при нагревании Т.к. реакция гидролиза эндотермическая, повышение температуры смещает равновесие в
- 47. Скачать презентацию






































 Различные теории кислот и оснований
Различные теории кислот и оснований Кремний және оның қосылыстары
Кремний және оның қосылыстары Вычисления по химической формуле
Вычисления по химической формуле Чистые вещества. Смеси. Способы разделения смесей (7 класс)
Чистые вещества. Смеси. Способы разделения смесей (7 класс) Роль металлов в истории человеческой цивилизации
Роль металлов в истории человеческой цивилизации Прочность полимеров
Прочность полимеров Кремний. Характеристики кремния и кристаллическая решетка
Кремний. Характеристики кремния и кристаллическая решетка Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов Углеводы: классификация, строение и физико-химические свойства
Углеводы: классификация, строение и физико-химические свойства Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов Periodic Table and Trends
Periodic Table and Trends Минеральные удобрения. Для школьников
Минеральные удобрения. Для школьников Соли, химические свойства, получения
Соли, химические свойства, получения Химические свойства солей
Химические свойства солей Уникальная соль (для дошколников)
Уникальная соль (для дошколников) Химия и косметика
Химия и косметика Неметаллы VА группы
Неметаллы VА группы Предельные одноатомные спирты
Предельные одноатомные спирты Решение задач на определение массовой и объемной доли вещества для смесей и растворов
Решение задач на определение массовой и объемной доли вещества для смесей и растворов Халькогены. Кислород
Халькогены. Кислород Химическое равновесие. 11 класс
Химическое равновесие. 11 класс Химическая коррозия
Химическая коррозия Химическая термодинамика
Химическая термодинамика Неметаллы
Неметаллы Удивительные свойства воды
Удивительные свойства воды Нефть и нефтепродукты. Происхождение. Состав. Свойства. Переработка
Нефть и нефтепродукты. Происхождение. Состав. Свойства. Переработка Жёсткость воды
Жёсткость воды Растворы и свойства растворов. Лекция 3
Растворы и свойства растворов. Лекция 3