Содержание
- 2. - Из всех неорганических соединений соли являются самым многочисленным классом веществ. - Это твёрдые вещества, они
- 3. Соли – это сложные вещества, состоящие из ионов металла и кислотных остатков. Соли – это электролиты,
- 4. Как можно получить соли? Кислота + основание = соль + вода реакция нейтрализации КОН + H2SO4
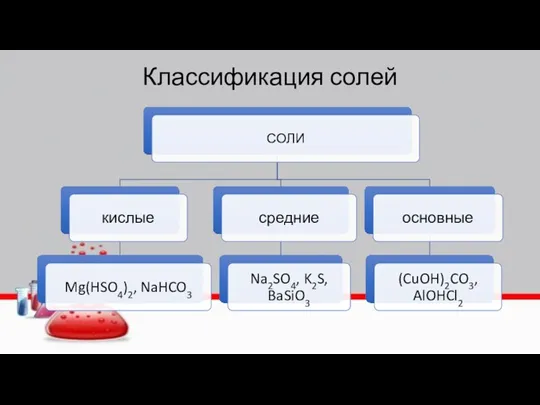
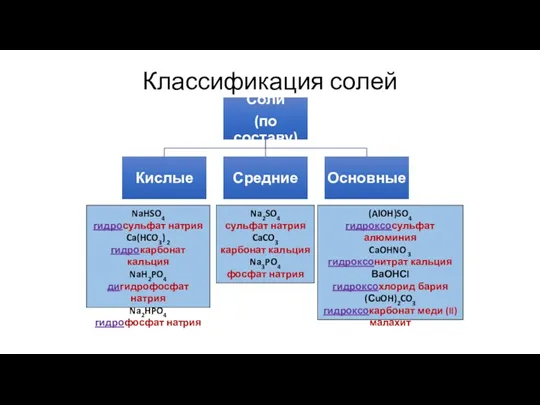
- 5. Классификация солей
- 6. Соли получаются при замене атомов водорода в кислоте на атомы металла. Что получится, если не все
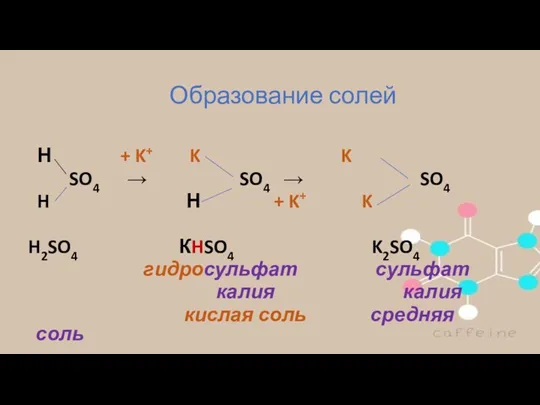
- 7. Образование солей Н + K+ K K SO4 → SO4 → SO4 H Н + K+
- 8. Классификация солей NaHSO4 гидросульфат натрия Ca(HCO3) 2 гидрокарбонат кальция NaH2PO4 дигидрофосфат натрия Na2HPO4 гидрофосфат натрия (AlOH)SO4
- 9. Химические свойства солей 1. Взаимодействие с кислотами Соль + кислота = другая соль + другая кислота
- 10. Химические свойства солей 2. Взаимодействие со щелочами Соль + щёлочь = другая соль + другое основание
- 11. Химические свойства солей 3. Взаимодействие с растворами солей Соль1 (р) + соль2 (р) = соль3 +
- 13. Скачать презентацию







 Хром
Хром Металлы. Лекция № 9
Металлы. Лекция № 9 Решение упражнений по теме: Углеводы
Решение упражнений по теме: Углеводы Контрольная работа. Разбор. 9 класс
Контрольная работа. Разбор. 9 класс Защитные материалы
Защитные материалы Магнитные наночастицы: проблемы и достижения
Магнитные наночастицы: проблемы и достижения Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3)
Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3) Палладий. История открытия химических веществ
Палладий. История открытия химических веществ Общая характеристика неметаллов
Общая характеристика неметаллов Аммиак. Строение, свойства, получение, применение
Аммиак. Строение, свойства, получение, применение Оксиды. Понятия об оксидах
Оксиды. Понятия об оксидах Путешествие на остров Соединений химических элементов. Урок-игра
Путешествие на остров Соединений химических элементов. Урок-игра Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов. Структура и функции биолекул
Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов. Структура и функции биолекул Алюминий и его соединения
Алюминий и его соединения Растворы. (Лекция 7)
Растворы. (Лекция 7) Химические методы определения U, Pu, Th
Химические методы определения U, Pu, Th Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Химическое равновесие
Химическое равновесие d997-13229e5e
d997-13229e5e Типы химических реакций
Типы химических реакций Методы выделения и очистки продуктов биотехнологических производств
Методы выделения и очистки продуктов биотехнологических производств Соли аммония
Соли аммония Минералогический состав почв
Минералогический состав почв Physical chemistry of nanostructured systems
Physical chemistry of nanostructured systems Азотсодержащие органические соединения
Азотсодержащие органические соединения История развитии химии
История развитии химии Objectives and background. Apply for an unknown mixture
Objectives and background. Apply for an unknown mixture Аллотропные модификации кремния
Аллотропные модификации кремния