Содержание
- 2. НЕМЕТАЛЛЫ- ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ ,У КОТОРЫХ НА ПОСЛЕДНЕМ ЭНЕРГИТИЧЕСКОМ УРОВНЕ НАХОДИТСЯ ОТ 4 ДО 8 ЭЛЕКТРОНОВ СЛОВАРЬ
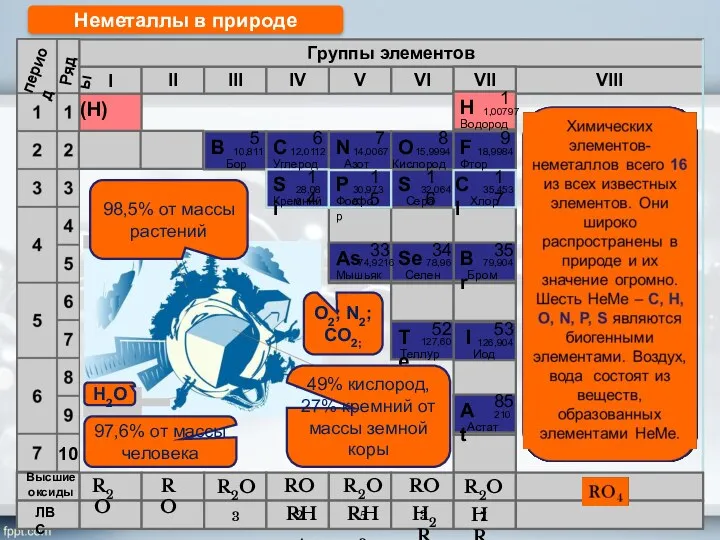
- 3. R2O RO R2O3 RO2 R2O5 RO3 R2O7 RH4 RH3 H2R HR Высшие оксиды ЛВС Неметаллы в
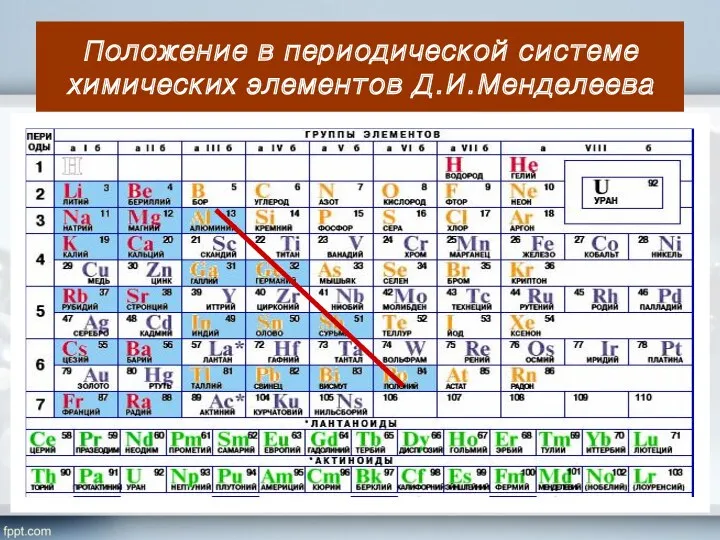
- 4. Положение в периодической системе химических элементов Д.И.Менделеева
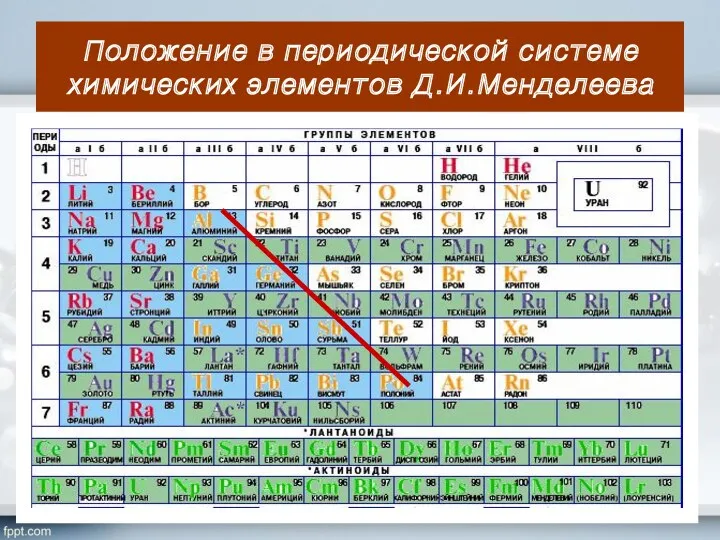
- 5. Положение в периодической системе химических элементов Д.И.Менделеева
- 6. Положение в периодической системе химических элементов Д.И.Менделеева
- 7. Положение в периодической системе химических элементов Д.И.Менделеева
- 8. Особенности атомного строения неметаллов Небольшой атомный радиус На внешнем уровне 4-8 электронов Располагаются только в главных
- 9. Электроотрицательность – это свойство атомов химических элементов поляризовать химическую связь, оттягивать к себе общие электронные пары
- 10. ФИЗИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ
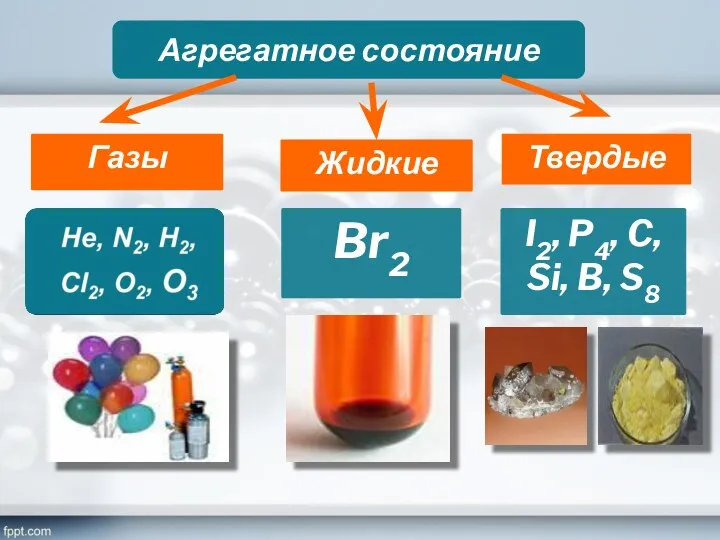
- 11. Агрегатное состояние Газы Жидкие Твердые Br2 I2, P4, C, Si, B, S8
- 12. Цвет неметаллов КРАСНЫЙ ЖЕЛТЫЙ ФИОЛЕТОВЫЙ ФОСФОР СЕРА ЙОД БЕСЦВЕТНЫЙ УГЛЕРОД
- 13. В чем причина разнообразия физических свойств у неметаллов ?
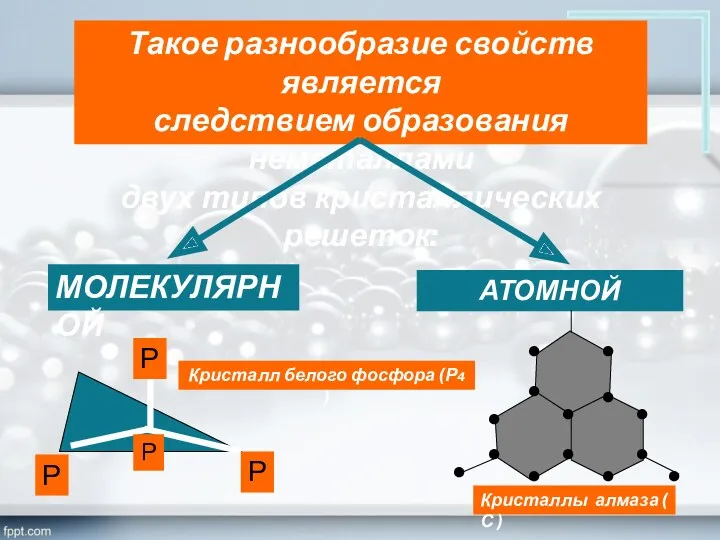
- 14. Такое разнообразие свойств является следствием образования неметаллами двух типов кристаллических решеток: МОЛЕКУЛЯРНОЙ АТОМНОЙ Р Р Р
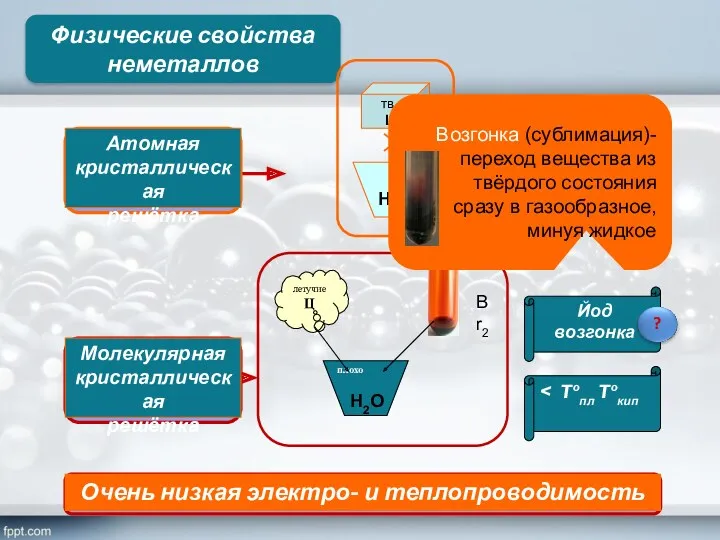
- 15. Физические свойства неметаллов > Tºпл Tºкип Йод возгонка Н2О Н2О
- 16. Аллотро́пия (от др-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того же
- 17. Причины аллотропии: Разные типы кристаллических решеток (белый фосфор Р4 – молекулярная, красный фосфор Р – атомная).
- 18. Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропных модификаций; вопрос аллотропии фосфора сложен и
- 19. Ромбическая (a - сера) - S8 t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая модификация.
- 21. Скачать презентацию












 Химические свойства металлов
Химические свойства металлов Золото. Что о нём мы можем рассказать?
Золото. Что о нём мы можем рассказать? d-элементы
d-элементы Подготовка к ВПР по химии. 11 класс
Подготовка к ВПР по химии. 11 класс Метаболизм кетоновых тел. Метаболизм холестерина
Метаболизм кетоновых тел. Метаболизм холестерина Химический потенциал. Фазовые равновесия
Химический потенциал. Фазовые равновесия Кислотные дожди
Кислотные дожди The Molecules of Life
The Molecules of Life Цинк и его соединения
Цинк и его соединения Фосфор и его соединения
Фосфор и его соединения Химия воды
Химия воды Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Классификация химических элементов
Классификация химических элементов Способы выражения состава раствора. Задача 7
Способы выражения состава раствора. Задача 7 НЮ 2.1.1. Металлы - общая характеристика
НЮ 2.1.1. Металлы - общая характеристика Гониометрическое исследование кристаллов
Гониометрическое исследование кристаллов Сплавы железа с углеродом: стали и чугуны
Сплавы железа с углеродом: стали и чугуны Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування
Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування Мінерали та гірські породи
Мінерали та гірські породи Серная кислота
Серная кислота Electrolysis
Electrolysis Вещества
Вещества Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Аминокислоты 2
Аминокислоты 2 Метаболизм углеводов
Метаболизм углеводов Спектральные методы: атомная спектроскопия
Спектральные методы: атомная спектроскопия Валентность и степень окисления. Химическая связь
Валентность и степень окисления. Химическая связь Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості