Содержание
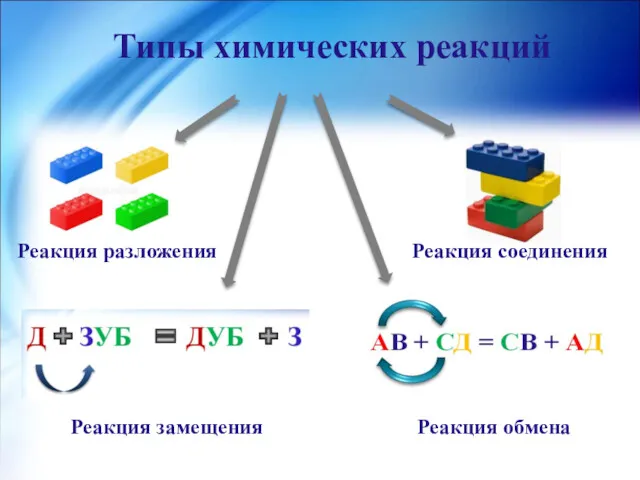
- 2. Типы химических реакций Реакция разложения Реакция соединения Реакция замещения Реакция обмена
- 3. Что общего в данных реакциях? 2Н2О = 2Н2↑ + О2↑ 2KMnO4 = K2MnO4 + MnO2 +
- 4. Реакция разложения- реакция, в результате которой из одного сложного вещества образуются два или несколько простых или
- 5. Реакция разложения
- 6. Что общего в данных реакциях? 2Mg + O2 = 2MgO BaO + H2O = Ba(OH)2 Fe
- 7. Реакция соединения- реакция, в результате которой из двух или нескольких простых или сложных веществ образуется одно
- 8. Реакция соединения
- 9. Что общего в данных реакциях? Zn + 2HCl = ZnCl2 + H2↑ H2 + CuO =
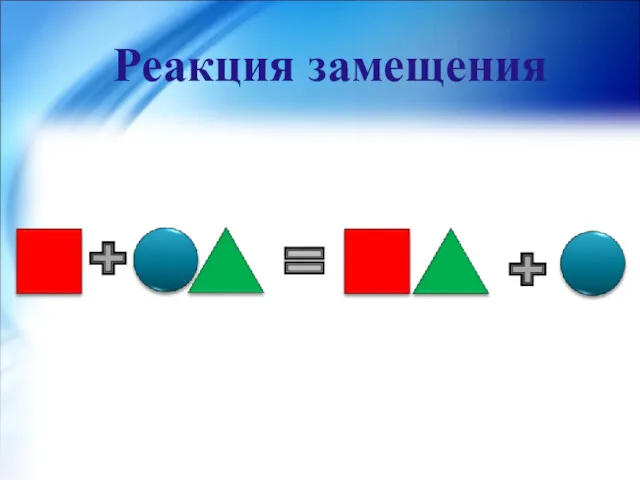
- 10. Реакция замещения- реакция между простым и сложным веществами, в результате которой атомы простого вещества замещают атомы
- 11. Реакция замещения
- 12. Что общего в данных реакциях? Zn(OH)2 + 2HCl = ZnCl2 + 2H2O 2HCl + CuS =
- 13. Реакция обмена- реакция между двумя сложными веществами, в результате которой происходит обмен составными частями сложных веществ.
- 14. Реакция обмена
- 16. Скачать презентацию











 Поняття про родини хімічних елементів: лужні метали, галогени, інертні елементи. Урок хімії у 8 класі
Поняття про родини хімічних елементів: лужні метали, галогени, інертні елементи. Урок хімії у 8 класі Коллигативные свойства растворов
Коллигативные свойства растворов Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність Свойства природного газа
Свойства природного газа Стали и чугуны. Классификация и маркировка
Стали и чугуны. Классификация и маркировка Химические реакции в растворах электролитов. Обобщение и систематизация знаний
Химические реакции в растворах электролитов. Обобщение и систематизация знаний Щелочные и щелочноземельные металлы
Щелочные и щелочноземельные металлы Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Сложные эфиры
Сложные эфиры Пластмаси. Види пластмас. (11 клас)
Пластмаси. Види пластмас. (11 клас) Волшебница - вода
Волшебница - вода Строение атома и атомного ядра. Изотопы
Строение атома и атомного ядра. Изотопы Твердые смазки
Твердые смазки Маркировка пластиковой посуды
Маркировка пластиковой посуды Термодинамика растворов неэлектролитов
Термодинамика растворов неэлектролитов Модифицированные природные полимеры. Их свойства
Модифицированные природные полимеры. Их свойства Законы химии. Классы неорганических соединений
Законы химии. Классы неорганических соединений Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа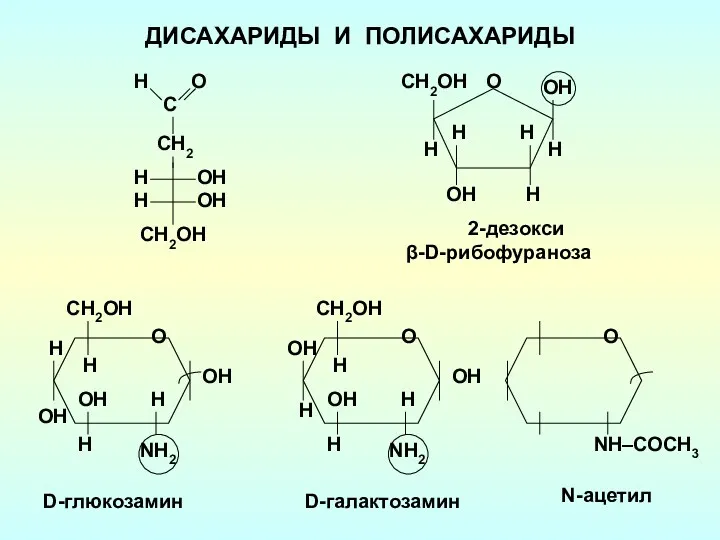 Дисахариды и полисахариды
Дисахариды и полисахариды Щелочноземельные металлы
Щелочноземельные металлы Теплота горения
Теплота горения Процессы нитрозирования и основные реакции диазосоединений
Процессы нитрозирования и основные реакции диазосоединений Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие
Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие Окислительно- восстановительные реакции
Окислительно- восстановительные реакции Чистые вещества и смеси
Чистые вещества и смеси Прикладная геохимия. Первичные ореолы
Прикладная геохимия. Первичные ореолы Почему протекают химические реакции
Почему протекают химические реакции Электрохимия. Окислительно-восстановительные реакции
Электрохимия. Окислительно-восстановительные реакции