Содержание
- 2. Понятие о химической кинетике Химической кинетикой называется учение о скорости химических реакций и ее зависимости от
- 3. О скорости химической реакции судят по изменению концентрации реагирующих веществ в единицу времени. При этом учитывается
- 4. Истинная скорость – это скорость химической реакции в данный момент времени и представляет собой первую производную
- 5. Скорость всегда положительна, знак ± относится к изменению концентрации, если концентрация в ходе процесса увеличивается, то
- 6. Факторы, влияющие на скорость химических реакций. Закон действующих масс На скорость химических реакций оказывают влияние следующие
- 7. Для гомогенной реакции общего вида аA + вB → сC + dD υпр = k1CАа CВв,
- 8. Для газов вместо концентрации можно использовать давления υпр = k1РАа РВв. Определим физический смысл константы скорости.
- 9. Зависимость константы скорости (и скорости) процесса от температуры определяет приближенное правило Вант-Гоффа: увеличение температуры на каждые
- 10. Правило Вант-Гоффа применяют при изменении температуры ниже 30 ºС. При более высоких изменениях температуры используют уравнение
- 11. Если реакция идет между атомами или свободными радикалами, то обычно Еа не превышает 40 кДж/моль, между
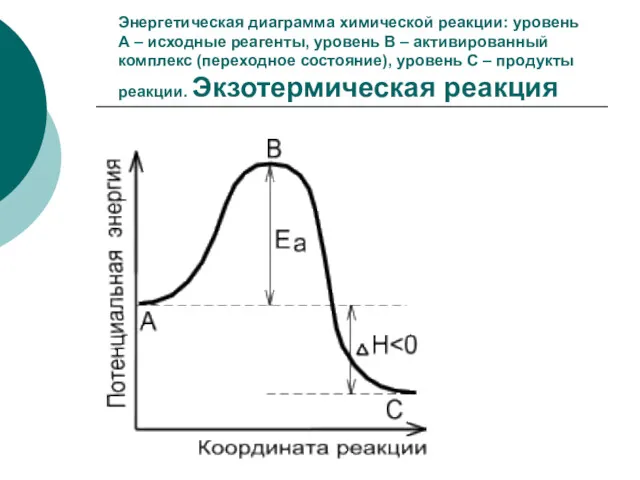
- 12. Энергетическая диаграмма химической реакции: уровень А – исходные реагенты, уровень В – активированный комплекс (переходное состояние),
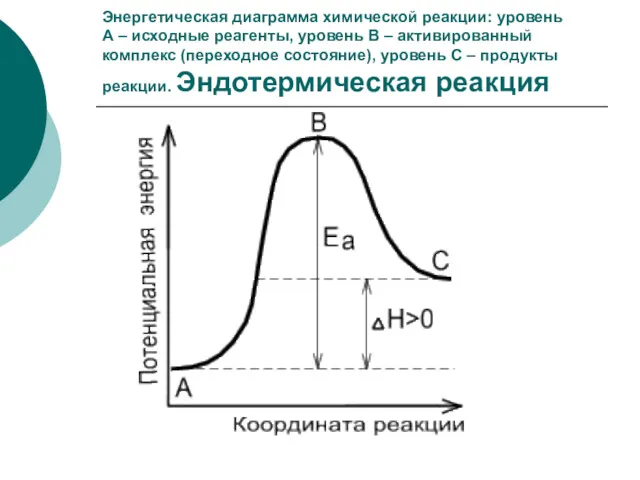
- 13. Энергетическая диаграмма химической реакции: уровень А – исходные реагенты, уровень В – активированный комплекс (переходное состояние),
- 14. Скорость гетерогенных реакций Поэтому первой особенностью кинетики этих реакций является влияние площади реакционной поверхности на скорость
- 15. Классификация химических реакций по молекулярности и по порядку Все кинетические реакции различают по молекулярности и по
- 16. Сложные реакции классифицируют по порядку, то есть, по сумме стехиометрических коэффициентов при концентрации реагирующих веществ. В
- 17. Сложные реакции Сложные реакции описываются кинетическим уравнением, содержащим несколько констант скоростей. К сложным реакциям относятся обратимые,
- 18. Параллельными реакциями называют реакции, которые имеют вид А⭧ В + Д ⭨ С + К, т.
- 19. Последовательными называют реакции, которые протекают через ряд последовательных стадий по схеме А → В→ С→ D…
- 20. Обратимыми называют реакции, скорость которых равна разности между прямой и обратной реакцией υреакции = υпр -
- 21. Особенности каталитических реакций. Теории катализа Скорость химической реакции можно регулировать с помощью катализатора. Вещества, которые участвуют
- 22. Катализаторами могут быть вещества : кислоты, соли, основания, оксиды, металлы, их атомы, молекулы или ионы, различные
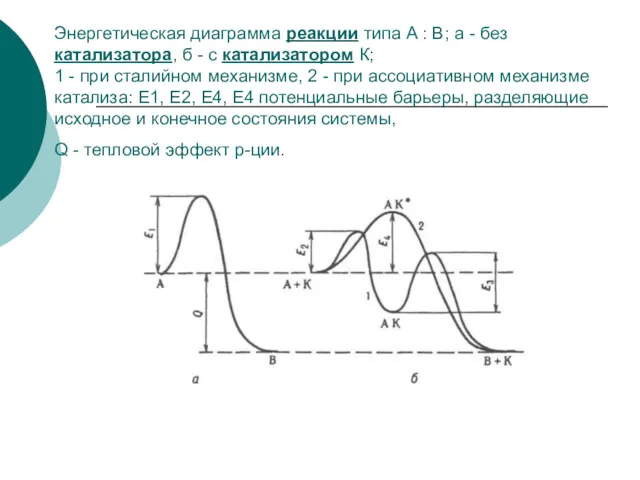
- 23. Энергетическая диаграмма реакции типа А : В; а - без катализатора, б - с катализатором К;
- 24. В ряде случаев присутствие посторонних веществ изменяет действие катализаторов: те вещества, которые усиливают положительную активность катализаторов,
- 25. На скорость каталитических реакций влияет площадь поверхности катализатора или его степень дисперсности, температура (обычно увеличивает скорость
- 26. Обратимые и необратимые реакции. Признаки химического равновесия Обратимые реакции не доходят до конца, до полного исчезновения
- 27. Константа химического равновесия Рассмотрим обратимую химическую реакцию общего вида, в которой все вещества находятся в одном
- 28. Скорость обратной реакции и она будет равна υобр = k2CCсCDd (6.2) где k2 – константа скорости
- 29. Отношение двух постоянных величин есть величина постоянная, и называется она константой химического равновесия: Константа равновесия показывает
- 30. Величина константы равновесия зависит от природы реагирующих веществ и температуры, и не зависит от концентрации в
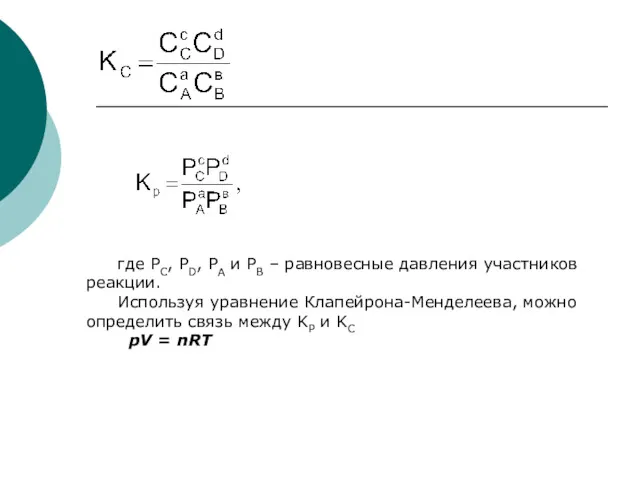
- 31. где РС, РD, РА и РВ – равновесные давления участников реакции. Используя уравнение Клапейрона-Менделеева, можно определить
- 32. где Δn – изменение числа молей газообразных участников реакции Δn = (с + d) – (а
- 33. Константа равновесия имеет большое теоретическое и практическое значение. Численное значение константы равновесия позволяет судить о практической
- 34. Факторы, влияющие на химическое равновесие. Принцип Ле-Шателье При воздействии на систему происходит смещение химического равновесия, т.
- 35. Рассмотрим влияние каждого фактора на смещение химического равновесия для реакции общего вида: аA + вB =
- 36. Влияние температуры. Общее правило, определяющее влияние температуры на равновесие, имеет следующую формулировку: повышение температуры способствует сдвигу
- 38. Скачать презентацию































 Чистые вещества и смеси
Чистые вещества и смеси Вода-растворитель. Работа воды в природе
Вода-растворитель. Работа воды в природе Щелочные металлы
Щелочные металлы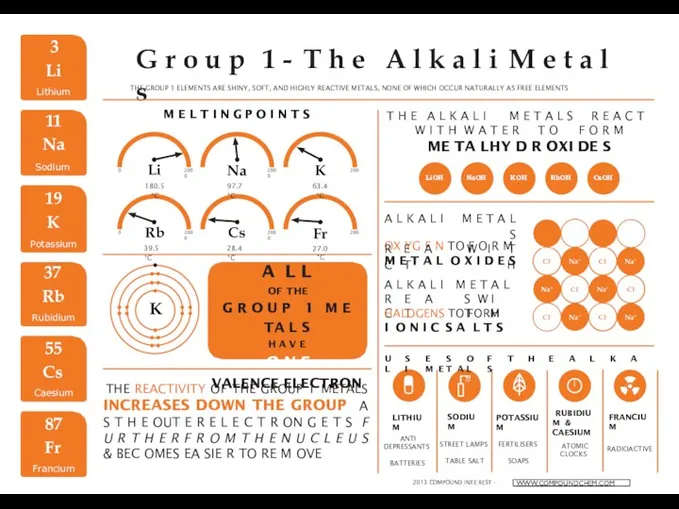 The alkali metals
The alkali metals Предмет органической химии
Предмет органической химии Приготування розчинів
Приготування розчинів Периодическая система Д.И. Менделеева
Периодическая система Д.И. Менделеева Энергоресурсы и их использование
Энергоресурсы и их использование Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Химические соединения в организме человека
Химические соединения в организме человека Углеводы. Моносахариды
Углеводы. Моносахариды Карбоновые кислоты. Нахождение в природе
Карбоновые кислоты. Нахождение в природе Электростатические взаимодействия, как фактор, определяющий структуру и реакционную способность органических соединений
Электростатические взаимодействия, как фактор, определяющий структуру и реакционную способность органических соединений Химические формулы
Химические формулы Задачі на визначення ступеню електролітичної дисоціації
Задачі на визначення ступеню електролітичної дисоціації Закон збереження маси речовини. Хімічні рівняння
Закон збереження маси речовини. Хімічні рівняння Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20 История мыловарения. Моющее действие мыла
История мыловарения. Моющее действие мыла Чистые вещества и смеси
Чистые вещества и смеси Подготовка к ГИА. В3. Степень окисления химических элементов. Окислительно-восстановительные реакции
Подготовка к ГИА. В3. Степень окисления химических элементов. Окислительно-восстановительные реакции Добування кисню
Добування кисню Основы теории смазывания и стандарты качества моторных масел
Основы теории смазывания и стандарты качества моторных масел Гидроксид аммония
Гидроксид аммония Structural revision of (+)-uprolide F diacetate confirmed by asymmetric total synthesis
Structural revision of (+)-uprolide F diacetate confirmed by asymmetric total synthesis Кислород O2
Кислород O2 Химия и живопись
Химия и живопись Кислородные соединения азота
Кислородные соединения азота Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату