Содержание
- 2. Щёлочноземельные металлы-элементы IIA группы Щелочноземельными являются не все элементы IIА группы, а только начиная с кальция
- 3. Ве - амфотерный металл, Mg – металл, Сa, Sr,Ba - щёлочноземельные металлы Ra –радиоактивный элемент
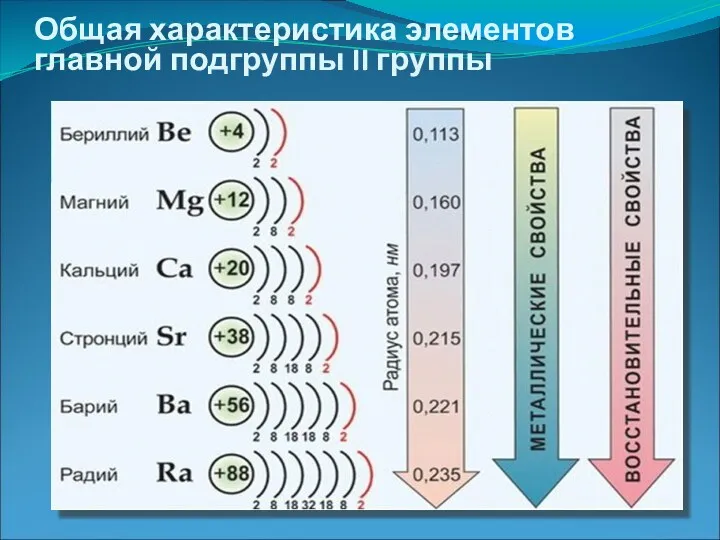
- 4. Общая характеристика элементов главной подгруппы II группы
- 5. Общая характеристика элементов главной подгруппы II группы Одинаковое строение внешнего электронного слоя Элементы проявляют СО +2
- 6. Бериллий Магний Кальций Стронций Барий Радий
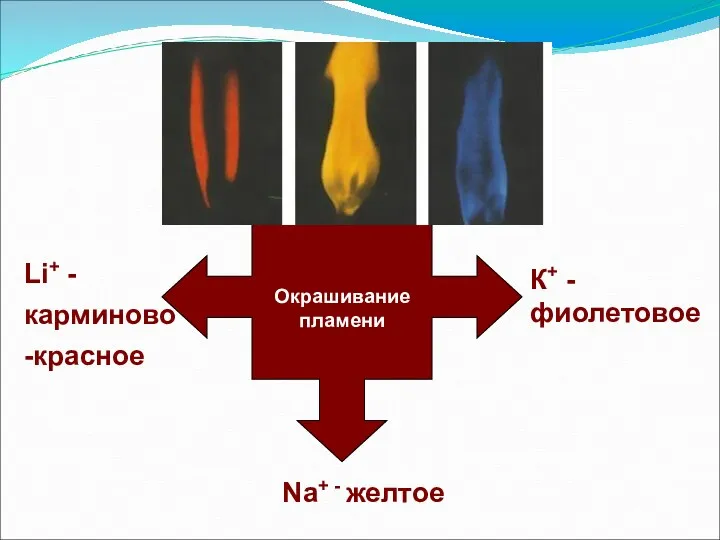
- 7. Окрашивание пламени К+ - фиолетовое Na+ - желтое Li+ - карминово -красное
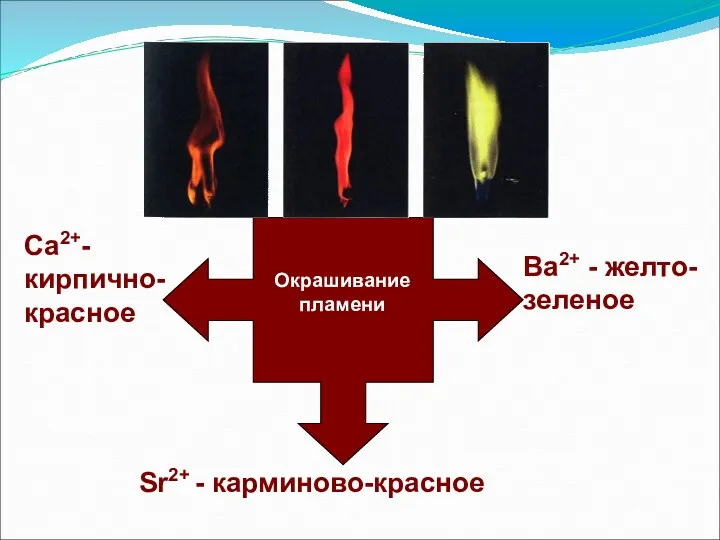
- 8. Окрашивание пламени Са2+- кирпично-красное Sr2+ - карминово-красное Bа2+ - желто- зеленое
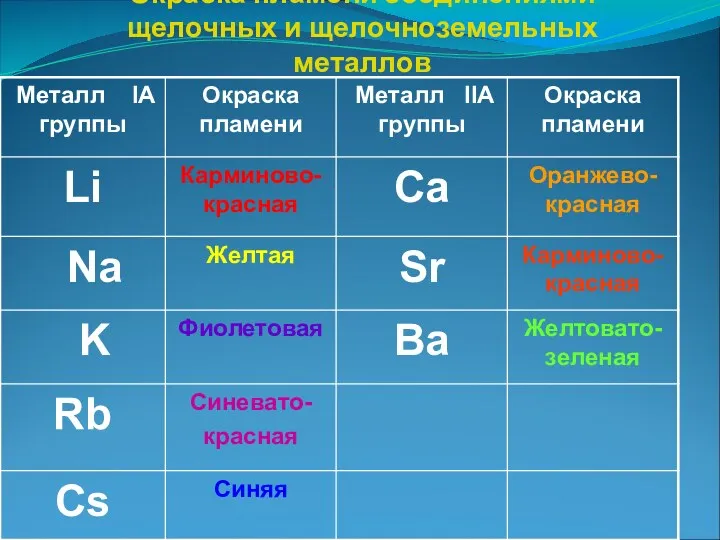
- 9. Окраска пламени соединениями щелочных и щелочноземельных металлов
- 10. РАЗДЕЛ: Соли элементов IIA группы
- 12. Химические свойства элементов IIА группы Взаимодействуют с простыми веществами
- 13. Взаимодействие с кислотами Все взаимодействуют с хлороводородной и разбавленной серной кислотами с выделением водорода: Be +
- 14. Взаимодействие со щелочами Бериллий взаимодействует с водными растворами щелочей: Be + 2NaOH + 2H2O = Na2[Be(OH)4]
- 15. Как и алюминий, Mg и Са способны восстанавливать редкие металлы из их оксидов: 2Mg+TiO2=2MgO + Ti
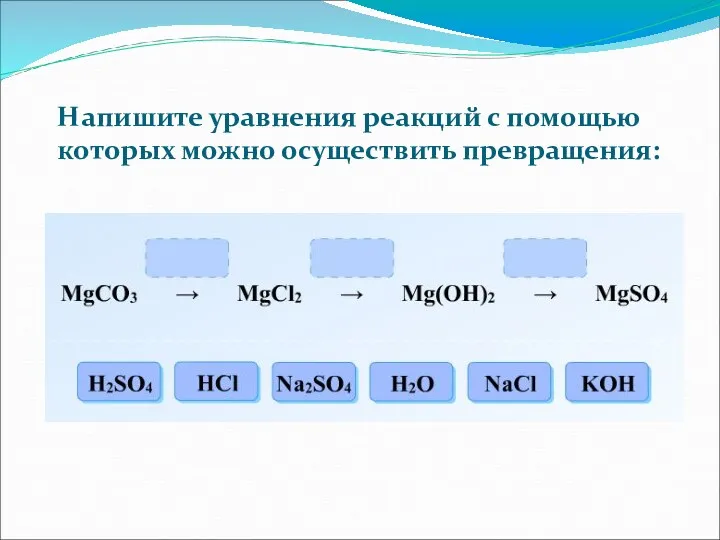
- 16. Напишите уравнения реакций с помощью которых можно осуществить превращения:
- 18. Скачать презентацию










 Номенклатура органических веществ
Номенклатура органических веществ Технологическое проектирование процессов переработки пэн
Технологическое проектирование процессов переработки пэн Электролитическая диссоциация кислот, солей и оснований Степень электролитической диссоциации. Сильные и слабые электролиты
Электролитическая диссоциация кислот, солей и оснований Степень электролитической диссоциации. Сильные и слабые электролиты Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Кислородсодержащие соединения серы
Кислородсодержащие соединения серы Целлюлоза. Строение
Целлюлоза. Строение Водородная связь
Водородная связь Автомобильные бензины
Автомобильные бензины Химиялық элемент оттегі
Химиялық элемент оттегі Химические свойства солей
Химические свойства солей Энтальпия. Тепловой эффект химической реакции. 11 класс
Энтальпия. Тепловой эффект химической реакции. 11 класс Теория радикалов (30 гг. XIX в Й.Берцелиус, Ю.Либих, Ж.Дюма)
Теория радикалов (30 гг. XIX в Й.Берцелиус, Ю.Либих, Ж.Дюма) Карбоновые кислоты
Карбоновые кислоты Коллоидные ПАВ
Коллоидные ПАВ Топливо. Классификация
Топливо. Классификация Минералды тыңайтқыштар
Минералды тыңайтқыштар Кремний и его соединения
Кремний и его соединения Оксиды и гидроксиды
Оксиды и гидроксиды Алюминий и его сплавы
Алюминий и его сплавы Классификация опасных грузов
Классификация опасных грузов Stirring in liquid media
Stirring in liquid media Смещение химического равновесия
Смещение химического равновесия Аминокислоты
Аминокислоты Степень окисления. Подготовка к контрольной работе
Степень окисления. Подготовка к контрольной работе La notion de catabolisme et d’anabolisme. La bioenergetique. La chaine mitochondriale de transfert d’electrons
La notion de catabolisme et d’anabolisme. La bioenergetique. La chaine mitochondriale de transfert d’electrons Непредельные углеводороды: этилен
Непредельные углеводороды: этилен Уход за волосами
Уход за волосами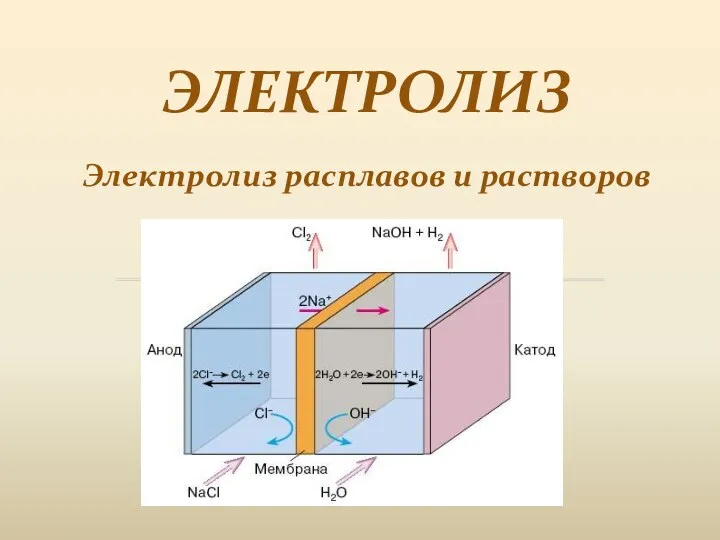 Электролиз. Электролиз расплавов и растворов
Электролиз. Электролиз расплавов и растворов