Слайд 2

Вспомним:
Что изучает органическая химия?
- Что такое органические вещества?
- Какой класс веществ
вами изучен?
Слайд 3

«Верно-неверно» о метане:
1) молекула содержит 4 атома водорода
2) является непредельным углеводородом
3)
атом углерода в молекуле соединён с атомами водорода двойной связью
4) вступает в реакцию замещения с хлором
5) не вступает в реакции присоединения с бромоводородом
6) нерастворим в воде
7) при сгорании выделяется большое количество теплоты
8) реагирует с водородом
Слайд 4

Мнение психологов:
Человек, который успешно изучает химию, обладает логическим мышлением, но
тот, кто разобрался в органической химии – обладает колоссальной логикой…
Слайд 5

Задание:
Составить развернутые структурные формула следующих веществ:
С3Н8 и С2Н4.
Слайд 6
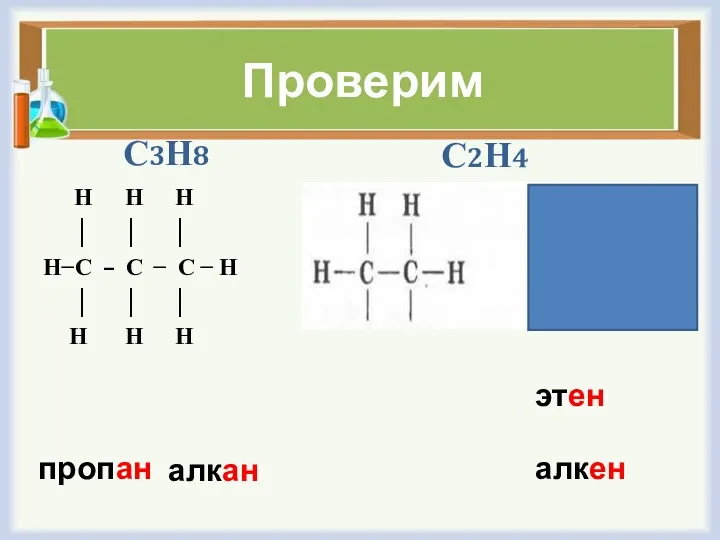
Проверим
С3Н8
Н Н Н
│ │ │
Н−С – С −
С − Н
│ │ │
Н Н Н
С2Н4
пропан
алкан
этен
алкен
Слайд 7

История открытия этилена
1669 г.
немецкий ученый Иоганн Иохим Бехер
Нагревая этиловый спирт
с серной кислотой, получил неизвестный ранее газ, названный «газ Бехера»
Слайд 8

История открытия этилена
1795 г.
голландский химик И. Дейман
установил, что «газ Бехера»
состоит из
углерода и водорода,
при взаимодействии с хлором превращается в маслянистую жидкость (1,2-дихлорэтан)
Слайд 9

Непредельные углеводороды
олефины (маслородный)
Алкены
Слайд 10

1860 г.
А. М. Бутлеров
установил, что в этилене на два атома
углерода приходится четыре атома водорода.
Слайд 11
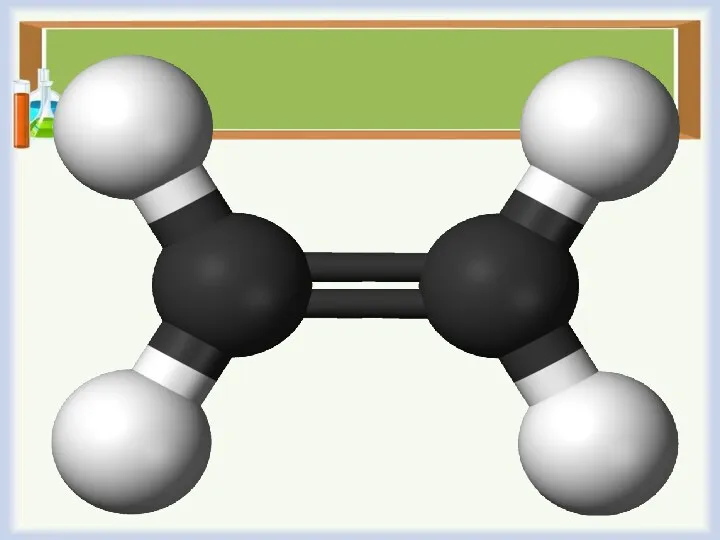
Слайд 12

Гомологический ряд
этилен (международное название — этен) СН2=СН2
пропилен ( международное название –
пропен) СН2=СН СН3
Запишите 2 последующих у/ в .
( С4, С5). Назовите их.
4. Составьте общую формулу класса алкенов.
CnH2n
Слайд 13

Сделайте вывод:
Как отличается состав этиленового углеводорода от состава предельного с
тем же числом углеродных атомов?
Слайд 14

Алкан → алкен + Н2
(дегидрирование)
Слайд 15

Физические свойства
По физическим свойствам этиленовые углеводороды близки к алканам. При
нормальных условиях углеводороды C2–C4 – газы, C5–C15 – жидкости, высшие представители – твердые вещества. Температура их плавления и кипения, а также плотность увеличиваются с ростом молекулярной массы. Все они легче воды, плохо растворимы в ней, однако растворимы в органических растворителях.
Слайд 16

Химические свойства
Для алкенов наиболее типичными являются реакции присоединения.
1)
обесцвечивание бромной воды.
H2C=CH2 + Br2 → BrCH2–CH2Br
Приведенная реакция - обесцвечивание алкеном бромной воды является качественной реакцией на двойную связь.
Слайд 17

2) Гидрирование. Легко присоединяют водород в присутствии катализаторов (Pt, Pd, Ni)
образуя предельные углеводороды.
CH3–CH=CH2 + H2 ––Ni→ CH3–CH2–CH3
3) Горение.
При сжигании в кислороде алкены дают
углекислый газ и воду.
H2C=CH2 + 3O2 → 2CO2 + 2H2O
Слайд 18

4)Реакция полимеризации.
Реакцией полимеризации называется процеcc соединения нескольких молекул низкомолекулярного
вещества с образованием высокомолекулярного соединения (полимера) .
Полимеризация алкенов происходит при нагревании, при повышенном давлении, при участии катализаторов
nH2C=CH2 →(- H2C-CH2 - )n
этилен полиэтилен
Слайд 19
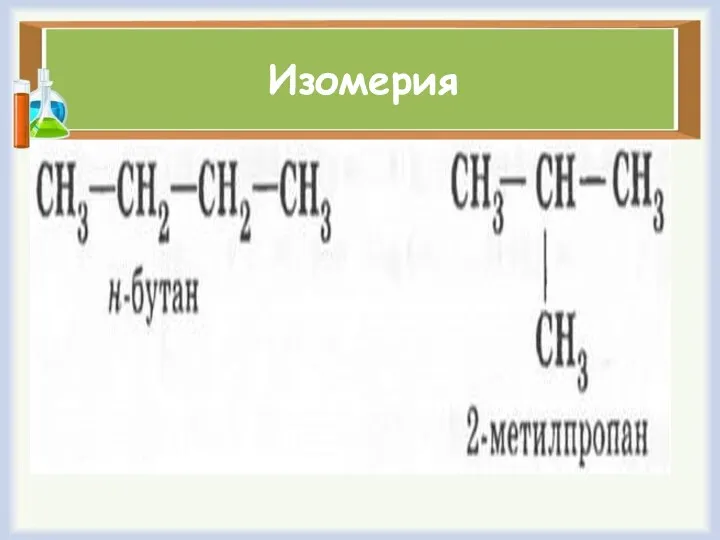
Изомерия
Вспомните определение явления изомерии и поясните его на примере бутана.
Слайд 20
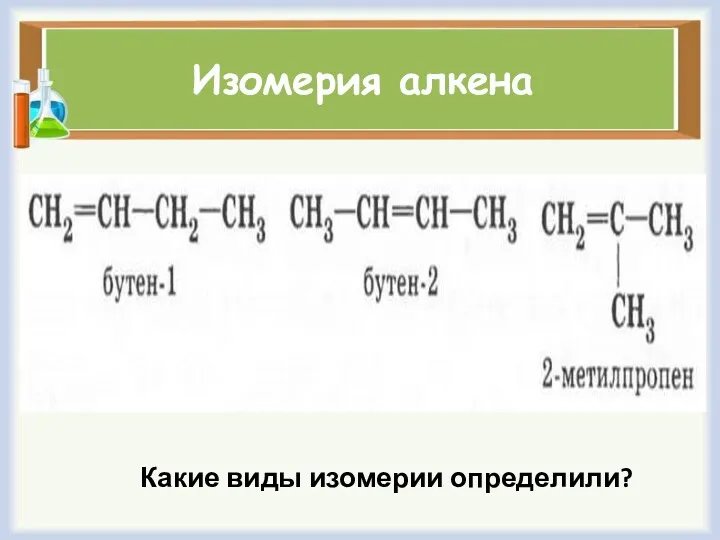
Изомерия алкена
Какие виды изомерии определили?
Слайд 21

Закрепление
1.Выпишите отдельно формулы предельных и этиленовых углеводородов и назовите вещества:
С5Н10;
С2Н2;СН4;С2Н6; С3Н4;C4H10;С2Н2; C6H6
Слайд 22

Непредельный углеводород
Предположите,в какие реакции будут вступать непредельные углеводороды.
Слайд 23

Применение этилена
В 1938 г. в России (тогда — в Советском Союзе)
вступил в строй первый завод по производству полиэтилена.






















 Металлы и сплавы с высокой удельной прочностью
Металлы и сплавы с высокой удельной прочностью Химическая термодинамика
Химическая термодинамика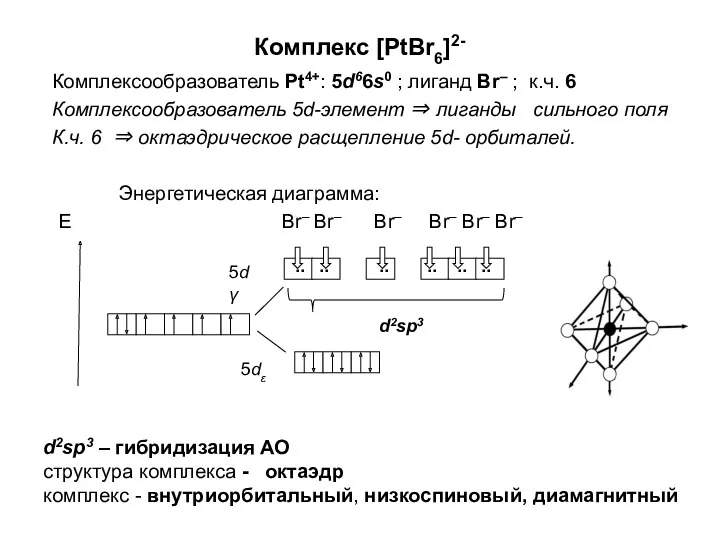 Комплексообразователь. (Лекция 5)
Комплексообразователь. (Лекция 5)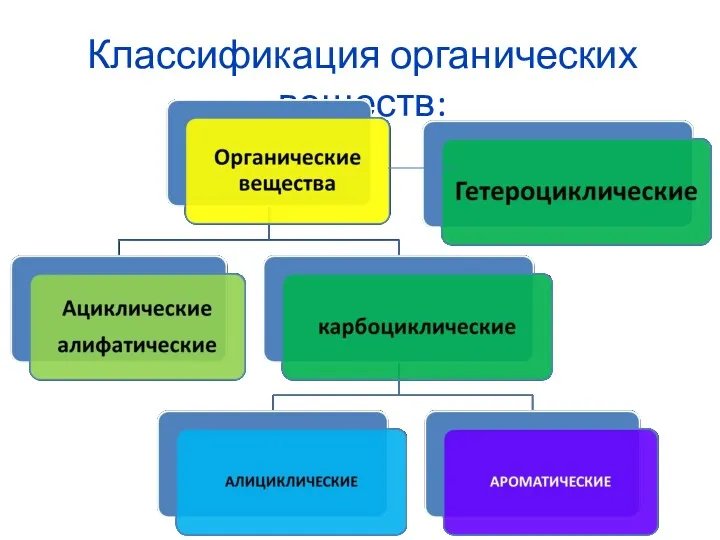 Классификация органических веществ
Классификация органических веществ Сравнительная характеристика галогенов
Сравнительная характеристика галогенов Амин қышқылдар
Амин қышқылдар Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость
Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость Фенол и его свойства. (10 класс)
Фенол и его свойства. (10 класс) Строение атома
Строение атома Липиды. Классификация липидов
Липиды. Классификация липидов Крахмал. Строение вещества
Крахмал. Строение вещества Значення хімії у житті людини
Значення хімії у житті людини Определение нефтепродуктов в воде с использованием Флюората-02-5М
Определение нефтепродуктов в воде с использованием Флюората-02-5М Каменный уголь
Каменный уголь Экспертные системы распознавания химических веществ
Экспертные системы распознавания химических веществ Бензо́л (C6H6, PhH)
Бензо́л (C6H6, PhH) Поняття про валентність. Ребус
Поняття про валентність. Ребус Текстовые задачи на проценты, смеси и сплавы
Текстовые задачи на проценты, смеси и сплавы Строение и свойства металлов. Физические и механические свойства металлов
Строение и свойства металлов. Физические и механические свойства металлов Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей
Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей Природные источники углеводородов
Природные источники углеводородов Покрытия: виды, принципы создания, свойства, применение. Получение покрытий золь-гель методом. Супергидрофобные покрытия
Покрытия: виды, принципы создания, свойства, применение. Получение покрытий золь-гель методом. Супергидрофобные покрытия Органическая химия
Органическая химия 21. Кислоты. Определение кислот
21. Кислоты. Определение кислот Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Общая характеристика неметаллов
Общая характеристика неметаллов Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы
Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений