Содержание
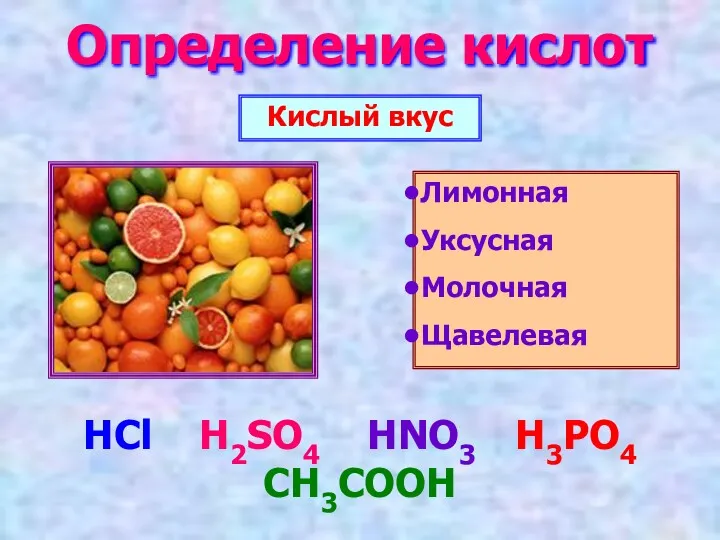
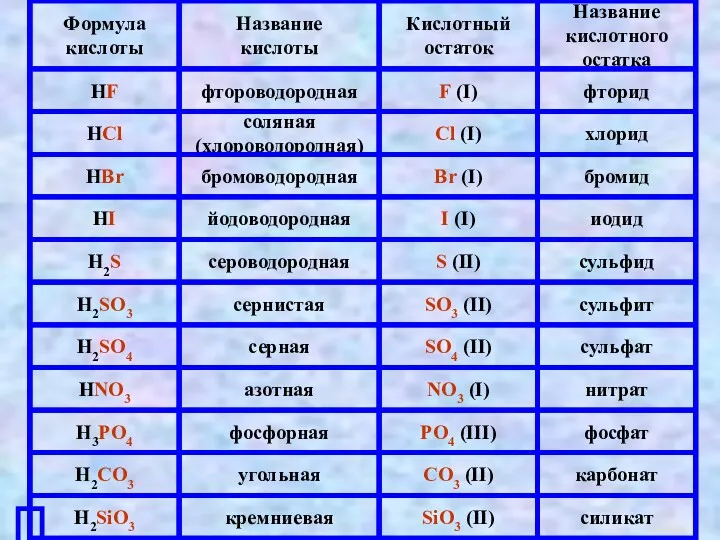
- 2. Определение кислот Кислый вкус Лимонная Уксусная Молочная Щавелевая HCl H2SO4 HNO3 H3PO4 CH3COOH
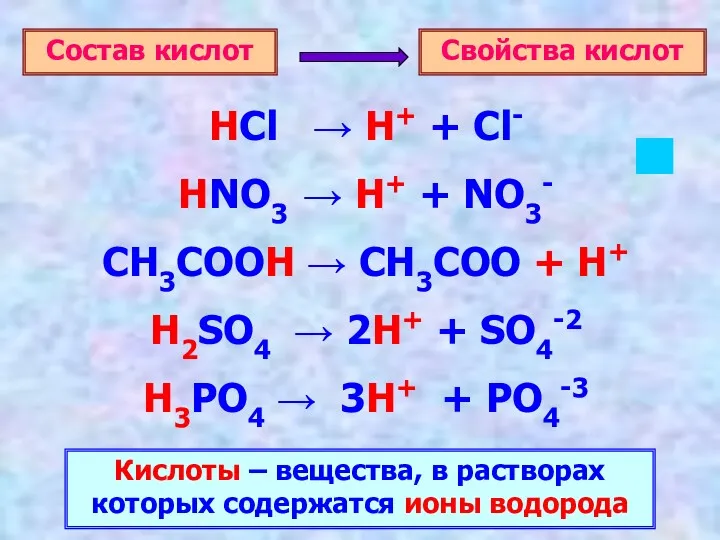
- 3. HCl → H+ + Cl- HNO3 → H+ + NO3- CH3COOH → CH3COO + H+ H2SO4
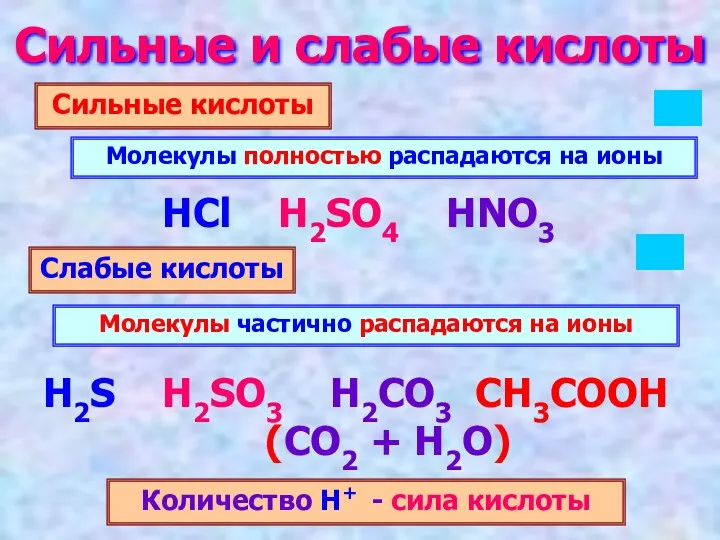
- 4. Сильные и слабые кислоты Сильные кислоты Слабые кислоты Молекулы полностью распадаются на ионы Молекулы частично распадаются
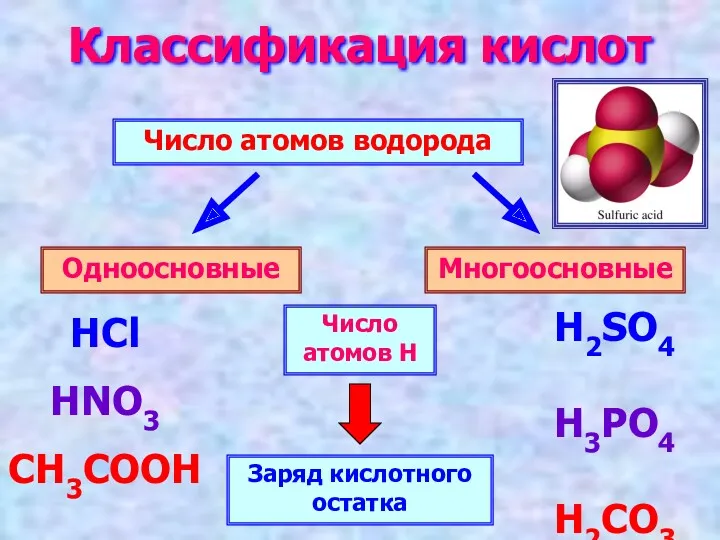
- 5. Классификация кислот Число атомов водорода Одноосновные Многоосновные HCl HNO3 CH3COOH H2SO4 H3PO4 H2CO3 Число атомов Н
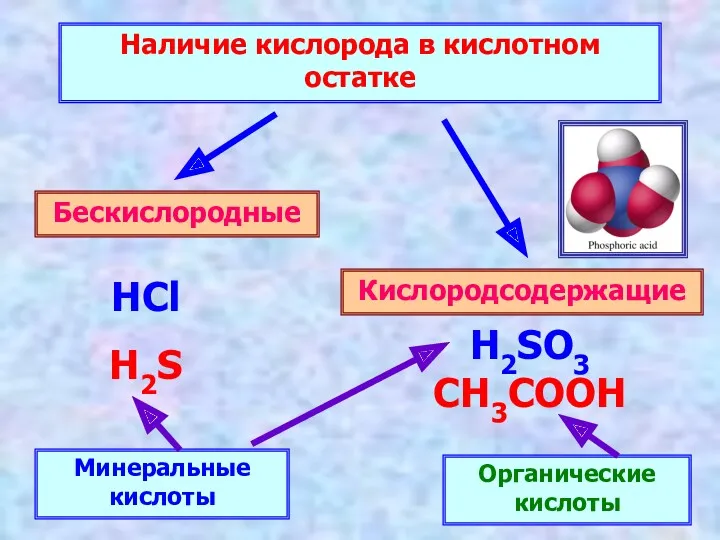
- 6. Наличие кислорода в кислотном остатке Бескислородные Кислородсодержащие HCl H2S H2SO3 CH3COOH Минеральные кислоты Органические кислоты
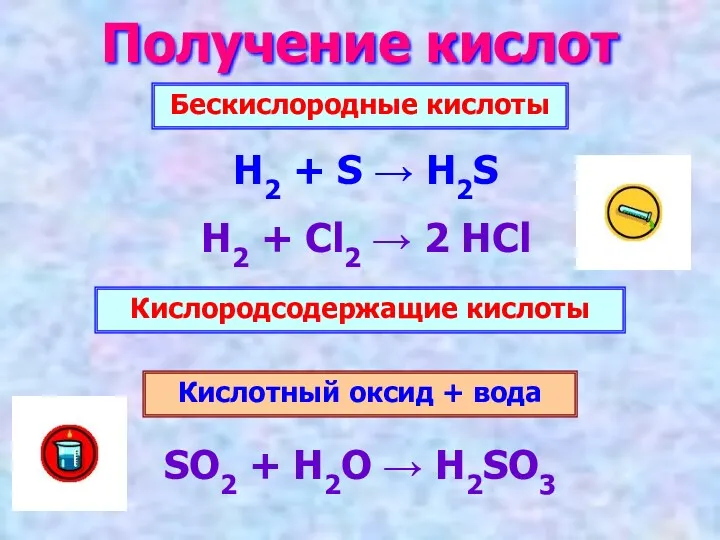
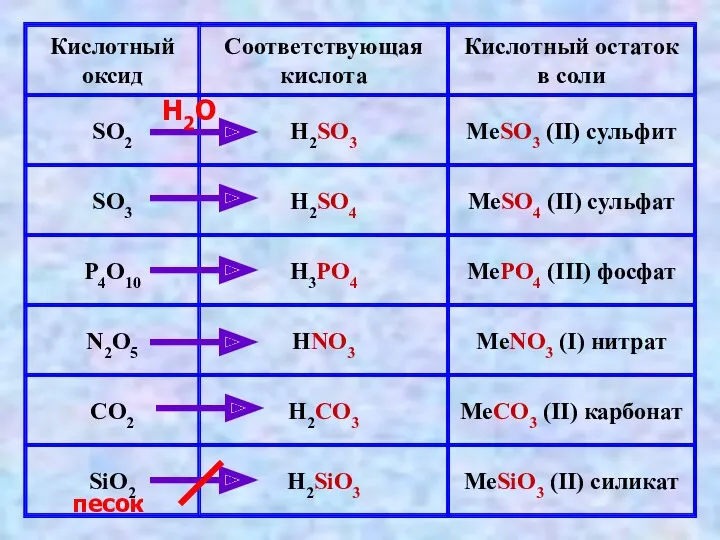
- 8. Получение кислот Бескислородные кислоты Кислородсодержащие кислоты H2 + S → H2S H2 + Cl2 → 2
- 9. песок H2O
- 10. Физические свойства кислот Кислый вкус Плотность больше плотности воды Разъедающее действие Вода, раствор питьевой соды
- 11. Сначала вода, потом кислота – иначе случится большая беда!
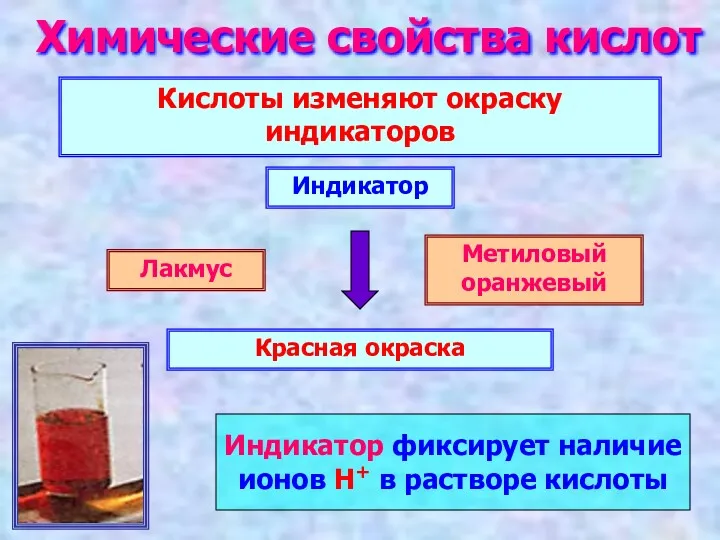
- 12. Химические свойства кислот Кислоты изменяют окраску индикаторов Лакмус Метиловый оранжевый Красная окраска Индикатор Индикатор фиксирует наличие
- 13. Кислоты реагируют с металлами, стоящими в ряду активности до водорода Zn + 2HCl → ZnCl2 +
- 15. Скачать презентацию



 Соединения химических элементов. Урок-игра. 8 класс
Соединения химических элементов. Урок-игра. 8 класс Комплексонометрия – метод количественного титриметрического анализа
Комплексонометрия – метод количественного титриметрического анализа Экстракционные методы выделения продуктов микробиологического синтеза
Экстракционные методы выделения продуктов микробиологического синтеза Химическая связь
Химическая связь Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6
Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6 большая стирка
большая стирка Алкадиены. Гомологический ряд, номенклатура и изомерия
Алкадиены. Гомологический ряд, номенклатура и изомерия Химическая связь
Химическая связь Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату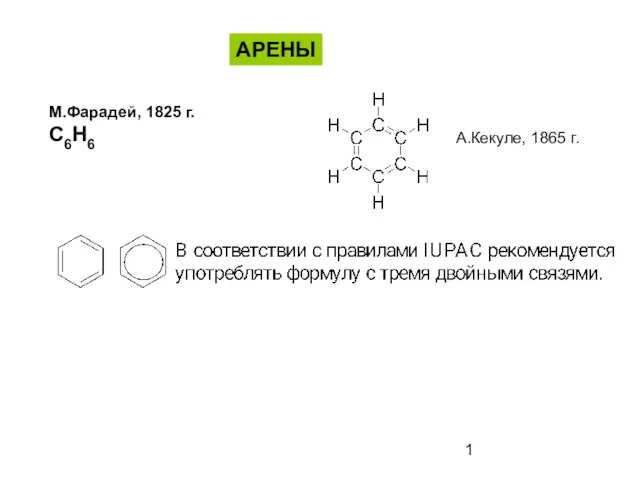 Ароматические соединения - арены
Ароматические соединения - арены Водородная связь
Водородная связь Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей
Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей Атомный и ионный радиусы. Принципы шаровых упаковок
Атомный и ионный радиусы. Принципы шаровых упаковок Азот и его соединения
Азот и его соединения Технология оптического стекла
Технология оптического стекла Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Электрохимические процессы
Электрохимические процессы Простые вещества
Простые вещества Кислород
Кислород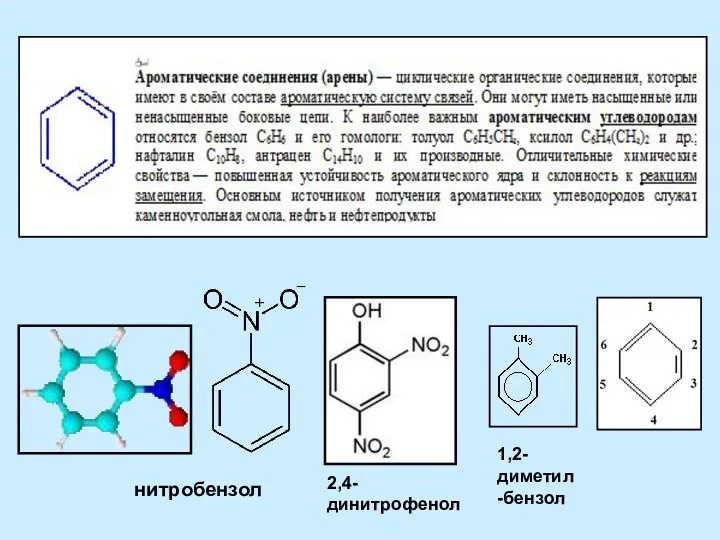 Ароматические соединения (арены)
Ароматические соединения (арены) Алкалоидтар
Алкалоидтар Лекция 2. Строение атома и Периодический закон Д.И. Менделеева
Лекция 2. Строение атома и Периодический закон Д.И. Менделеева Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Общая характеристика твердого, жидкого и газообразного видов топлива
Общая характеристика твердого, жидкого и газообразного видов топлива Химия в строительстве
Химия в строительстве Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений Углерод
Углерод