Тепловой эффект процесса (1)
Тепловой эффект процесса – теплота, выделенная или поглощенная
термодинамической
системой при протекании в ней процесса при
условии, что данная система не совершает никакой работы,
кроме работы расширения, а температура остается постоянной.
При постоянном объеме тепловой эффект равен изменению
внутренней энергии системы ΔU, при постоянном давлении –
изменению энтальпии ΔН.
Тепловой эффект ΔН положительный для эндотермических
процессов (рис. 2, а) и отрицательный для экзотермических (рис. 2, б).
Рис. 2. Энтальпийная диаграмма для эндотермического (а)
и экзотермического (б) процессов1
1 Индексы кон и исх относятся соответственно к продуктам реакции и к исходным веществам.






 Силикаты. Гранат. Берилл
Силикаты. Гранат. Берилл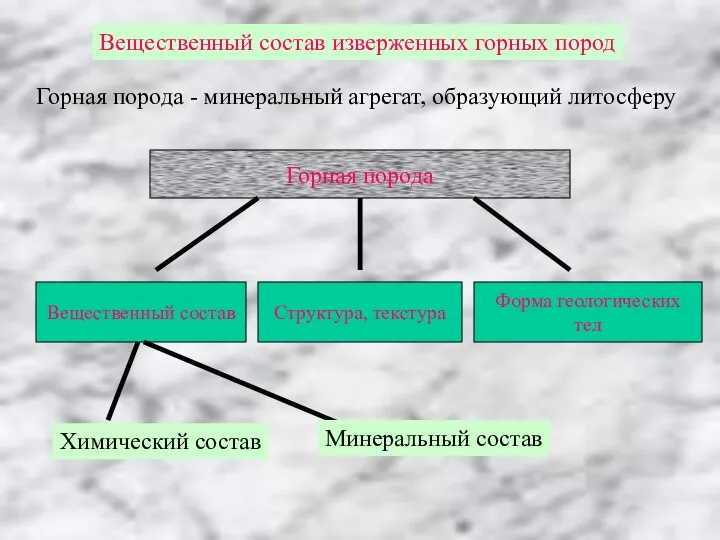 Вещественный состав изверженных горных пород
Вещественный состав изверженных горных пород Месторождения берилла и топаза
Месторождения берилла и топаза Основные понятия и законы химии. Тема 1
Основные понятия и законы химии. Тема 1 Алканы
Алканы Special subject chemistry
Special subject chemistry Непредельные углеводороды: алкены, олефины
Непредельные углеводороды: алкены, олефины Классификация, номенклатура, изомерия органических соединений
Классификация, номенклатура, изомерия органических соединений Циклоалкандар
Циклоалкандар Эквивалент. Лекция 1
Эквивалент. Лекция 1 Кремний и его соединения
Кремний и его соединения Основные классы неорганических веществ. Соединения химических элементов
Основные классы неорганических веществ. Соединения химических элементов Количество вещества. Единица измерения вещества моль
Количество вещества. Единица измерения вещества моль Особенности применения проблемных моделей обучения на уроках химии
Особенности применения проблемных моделей обучения на уроках химии Кремнийдің құрамы, құрылысы және қасиеттері
Кремнийдің құрамы, құрылысы және қасиеттері Природні джерела вуглеводнів і їх переробка
Природні джерела вуглеводнів і їх переробка Валентность химических элементов
Валентность химических элементов Химический элемент уран
Химический элемент уран Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе
Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе Арены. Бензол
Арены. Бензол Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною
Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною Лантаноиды. Лантан
Лантаноиды. Лантан Строение, реакционные способности и методы синтеза алкадиенов
Строение, реакционные способности и методы синтеза алкадиенов Химия 20 века
Химия 20 века Азот және он қосылыстары
Азот және он қосылыстары Базиты. Химический состав
Базиты. Химический состав История открытия фосфора
История открытия фосфора Предельные углеводороды. Алканы. 10 класс
Предельные углеводороды. Алканы. 10 класс