Содержание
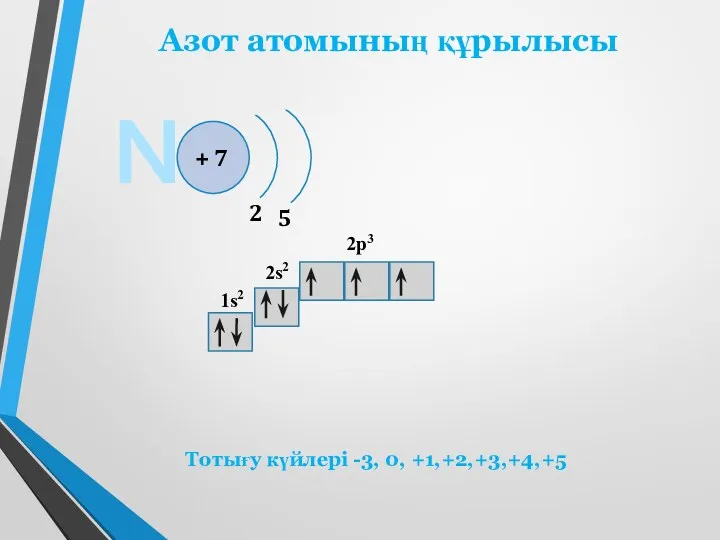
- 2. Азот атомының құрылысы N + 7 2 5 1s2 2s2 2p3 Тотығу күйлері -3, 0, +1,+2,+3,+4,+5
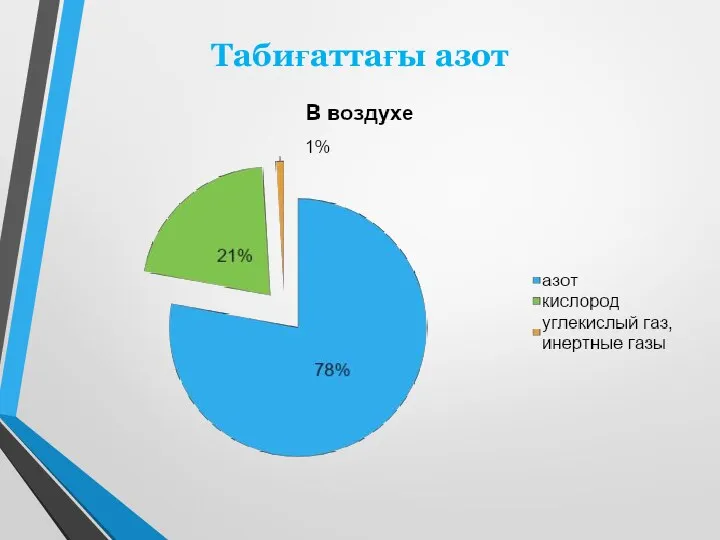
- 3. Табиғаттағы азот
- 4. Азот қасиеттері Бос күйде азот екі атомды N2 молекулалар түрінде болады. Бұл молекулаларда екі азот атомы
- 5. Азоттың химиялық қасиеттері Химиялық тұрғыдан азот күшті коваленттік байланысқа байланысты өте инертті газ болып табылады. Металдардың
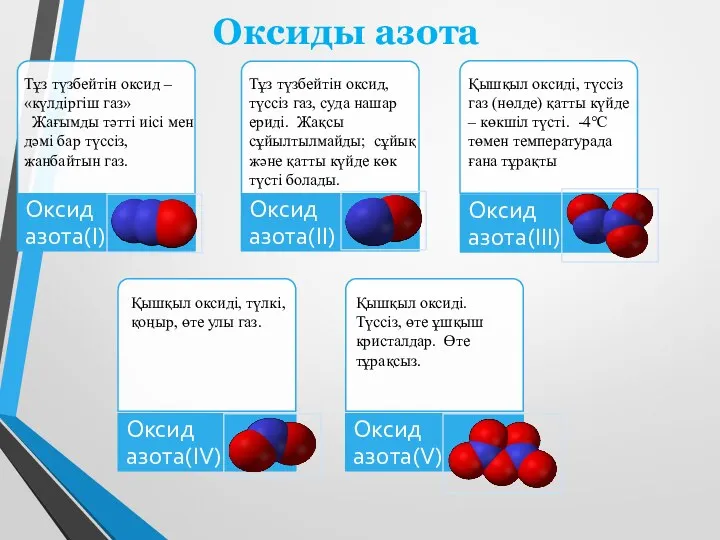
- 6. Оксиды азота Тұз түзбейтін оксид – «күлдіргіш газ» Жағымды тәтті иісі мен дәмі бар түссіз, жанбайтын
- 7. Аммиак Аммиак – ауадан екі есе дерлік жеңіл, өткір иісі бар түссіз газ. Аммиакты ұзақ уақыт
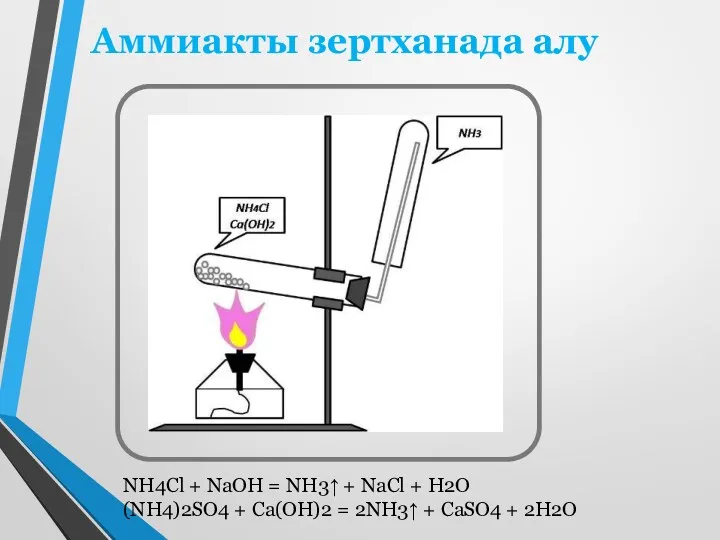
- 8. Аммиакты зертханада алу NH4Cl + NaOH = NH3↑ + NaCl + H2O (NH4)2SO4 + Ca(OH)2 =
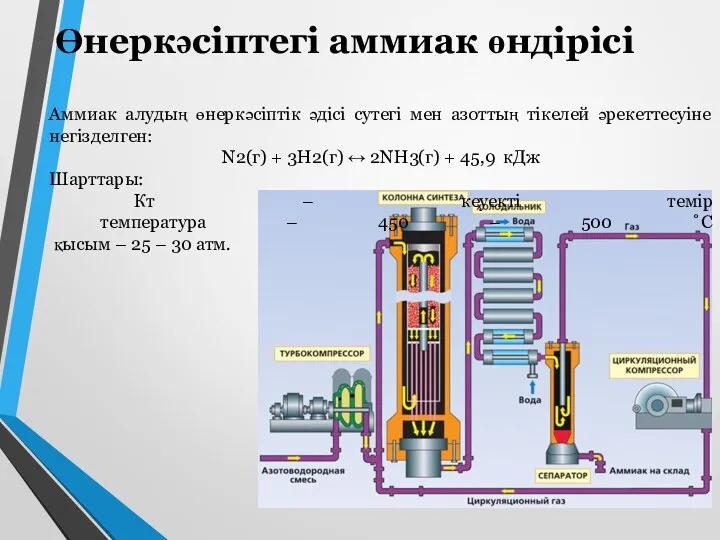
- 9. Өнеркәсіптегі аммиак өндірісі Аммиак алудың өнеркәсіптік әдісі сутегі мен азоттың тікелей әрекеттесуіне негізделген: N2(г) + 3H2(г)
- 10. Аммиактың химиялық қасиеттері . NH3-күшті тотықсыздандырғыш болып табылады. NH3 + CuO = N2 + Cu +
- 11. Егер аммиак ерітіндісіне фенолфталеиннің бірнеше тамшысын қоссаңыз, ол қызыл түске боялады, яғни сілтілі ортаны көрсетеді: NH3
- 12. Аммиак қолдану
- 13. Медицинада аммиактың 10% сулы ерітіндісі аммиак деп аталады. Аммиактың өткір иісі мұрынның шырышты қабығындағы ерекше рецепторларды
- 14. Аммоний тұзы. Қышқылдармен және тұздармен алмасу реакциясына түседі: (NH4)2SO4 + Ba(NO3)2 → BaSO4 ↓ + 2NH4NO3
- 15. NH4H2PO4 (NH4)2Cr2O (NH4)2SO4∙FeSO4∙6H2O; FeSO4·(NH4)2SO4·6H2O.
- 17. Скачать презентацию









 Стекловолокно. Что такое стекловолокно?
Стекловолокно. Что такое стекловолокно? Поверхностно-активные вещества и их роль
Поверхностно-активные вещества и их роль Углерод и кремний
Углерод и кремний Железо и его соединения
Железо и его соединения Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Определения оксидов, кислот, оснований, амфотерные и несолеобразующие оксиды
Определения оксидов, кислот, оснований, амфотерные и несолеобразующие оксиды Аналитические химические реакции. Классификация аналитических химических реакций
Аналитические химические реакции. Классификация аналитических химических реакций План характеристики елемента за його положенням у періодичній системі та будовою атома
План характеристики елемента за його положенням у періодичній системі та будовою атома Изучение свойств горных пород, минералов и полезных ископаемых
Изучение свойств горных пород, минералов и полезных ископаемых Общая характеристика отравляющих и высокотоксичных веществ. (Тема 8)
Общая характеристика отравляющих и высокотоксичных веществ. (Тема 8) Бензен. Номенклатура. Хімічні властивості
Бензен. Номенклатура. Хімічні властивості Основні поняття матеріального балансу. Розрахунок об’єму повітря та продуктів згоряння при горінні речовин та матеріалів
Основні поняття матеріального балансу. Розрахунок об’єму повітря та продуктів згоряння при горінні речовин та матеріалів Перегонка воды (дистилляция). Демонстрационный вариант
Перегонка воды (дистилляция). Демонстрационный вариант Простые эфиры
Простые эфиры Беттiк құбылыстар, олардың ағзадағы маңызы. Адсорбция
Беттiк құбылыстар, олардың ағзадағы маңызы. Адсорбция Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ
Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ Растворы. Электролитическая диссоциация
Растворы. Электролитическая диссоциация Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Предельные углеводороды. Алканы
Предельные углеводороды. Алканы Полиэтилен — [—CH2--CH2—]n ақ түсті термопластикалық полимер
Полиэтилен — [—CH2--CH2—]n ақ түсті термопластикалық полимер Аммиак
Аммиак Железо. Физические свойства
Железо. Физические свойства Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння Альдегиды и кетоны
Альдегиды и кетоны Скорость химических реакций. Молекулярные гонки
Скорость химических реакций. Молекулярные гонки Аммиак. Состав вещества
Аммиак. Состав вещества Origin of petroleum dilemma
Origin of petroleum dilemma Основные понятия и законы химии
Основные понятия и законы химии