Содержание
- 2. Химизм нитрозирования Формально большинство процессов нитрозирования можно отнести к реакциям электрофильного замещения, т.к. нитрит натрия в
- 3. Механизм реакции диазотирования Лимитирующей стадией процесса является нитрозирование, поэтому скорость реакции зависит от рКа амина и
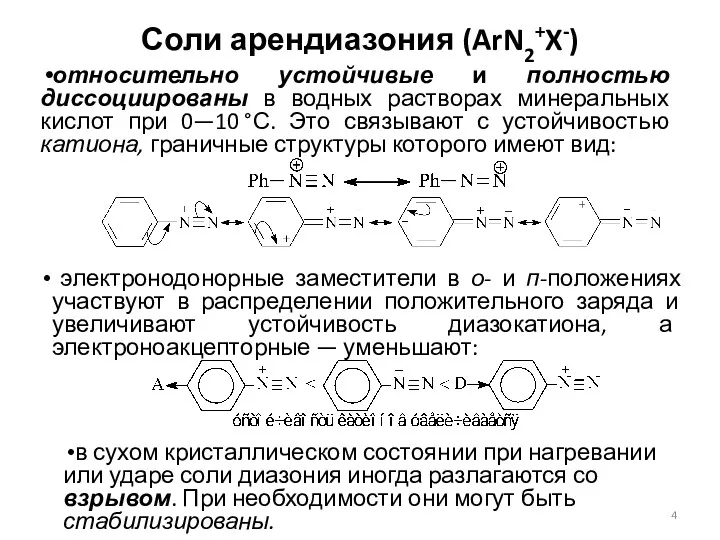
- 4. Соли арендиазония (ArN2+X-) относительно устойчивые и полностью диссоциированы в водных растворах минеральных кислот при 0—10 °С.
- 5. Алифатические соли диазония (RN2+X-) неустойчивые (радикал плохо распределяет заряд), поэтому отщепляется азот, образуется карбокатион и далее
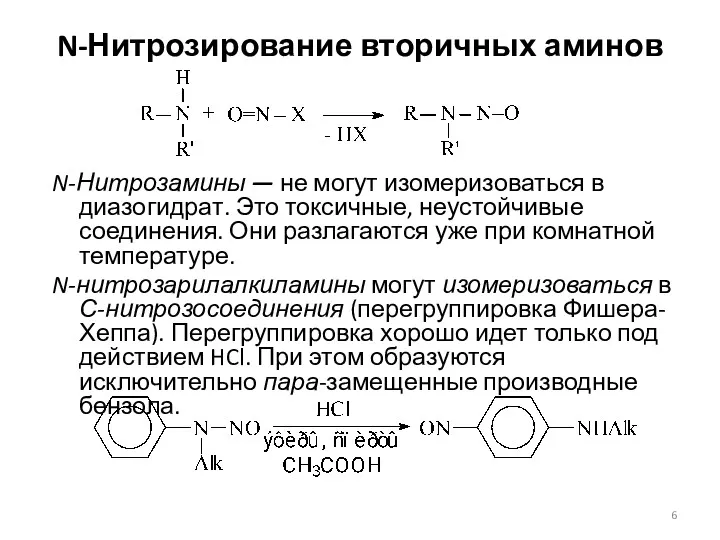
- 6. N-Нитрозирование вторичных аминов N-Нитрозамины — не могут изомеризоваться в диазогидрат. Это токсичные, неустойчивые соединения. Они разлагаются
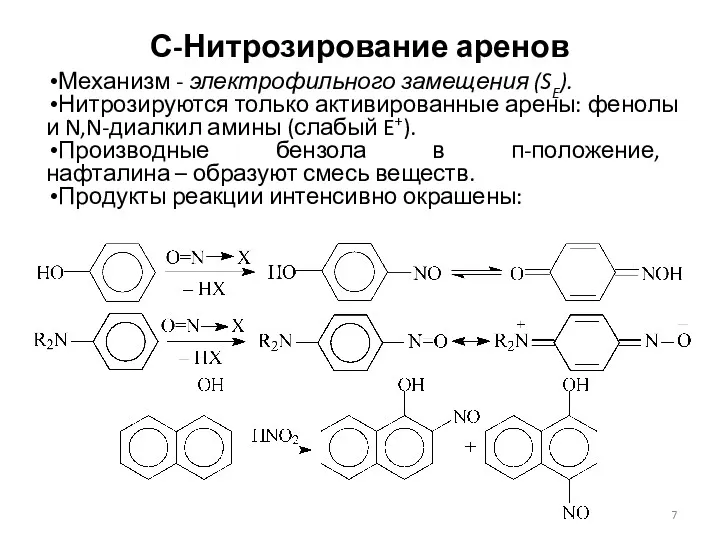
- 7. С-Нитрозирование аренов Механизм - электрофильного замещения (SE). Нитрозируются только активированные арены: фенолы и N,N-диалкил амины (слабый
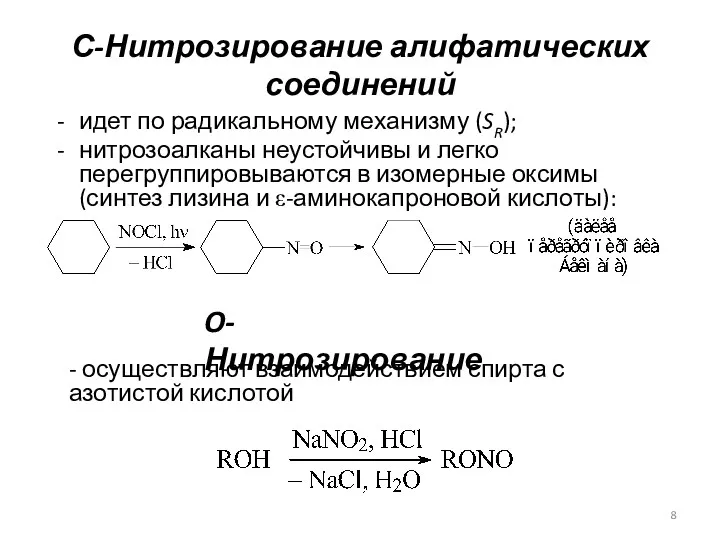
- 8. С-Нитрозирование алифатических соединений идет по радикальному механизму (SR); нитрозоалканы неустойчивы и легко перегруппировываются в изомерные оксимы
- 9. Параметры процесса диазотирования. Температура Обычно диазотирование ведут при температуре (0—5 °С). При ее повышении: увеличивается скорость
- 10. Кислотность среды - определяется pKb конкретного амина. Диазотирование ароматических аминов ведут при рН Избыток кислоты необходим
- 11. Кислотность среды в случае алкиламинов и очень слабых оснований Алифатические амины (сильные основания) в слишком кислой
- 12. Концентрация нитрита натрия в процессе диазотирования изменяется в широких пределах до 20 %. Нитрит натрия не
- 13. Другие параметры процесса диазотирования Перемешивание реакционной массы должно быть интенсивное, поскольку выделяется большое количество тепла и
- 14. Кислотно-основные превращения ароматических диазосоединений Строение и свойства диазосоединений зависят от значения рН среды: катион диазония (I)
- 15. Реакции замены диазониевой группы Диазониевую группу можно заместить на гидроксил, галоген, циано-, нитро- и другие группы.
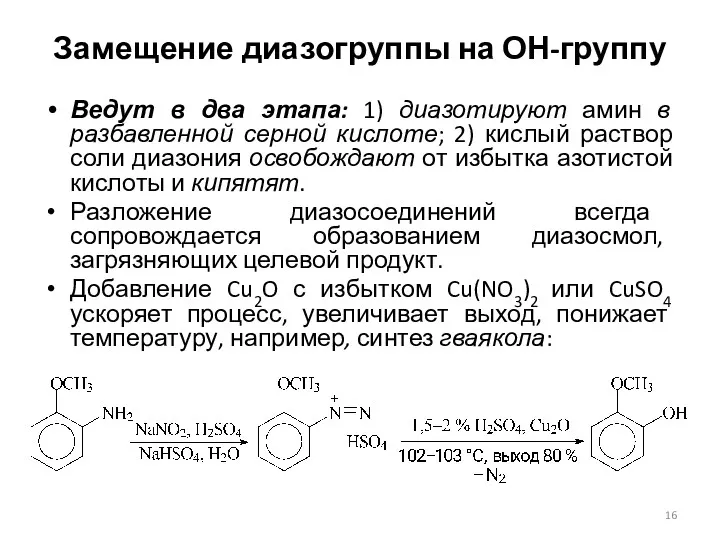
- 16. Замещение диазогруппы на ОН-группу Ведут в два этапа: 1) диазотируют амин в разбавленной серной кислоте; 2)
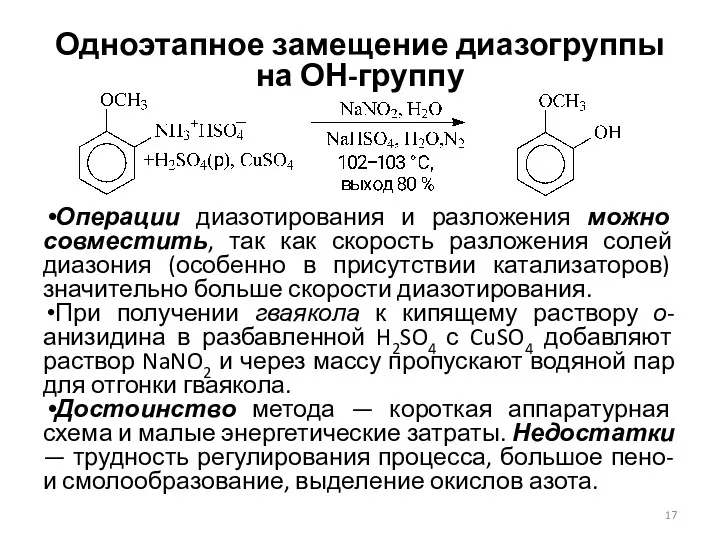
- 17. Одноэтапное замещение диазогруппы на ОН-группу Операции диазотирования и разложения можно совместить, так как скорость разложения солей
- 18. Замена диазогруппы на галоген и другие группы (реакция Зандмейра-Гаттермана) Целевой продукт получается с высоким выходом. Побочные
- 19. Реакция Зандмейра При замене диазониевой группы на циано- и нитро-группу необходимо поддерживать нейтральную среду или щелочную
- 20. Замена диазогруппы на иод Реакцию осуществляют солями иода в отсутствие катализатора и с хорошими выходами. По-видимому,
- 21. Замена диазогруппы на фтор (реакция Шимана) К растворам солей диазония добавляют холодный водный раствор NaBF4, HBF4
- 22. Гидридное замещение диазониевой группы — метод удаления аминогруппы из ароматического кольца. Используется фосфорноватистая кислота (H3PO2) и
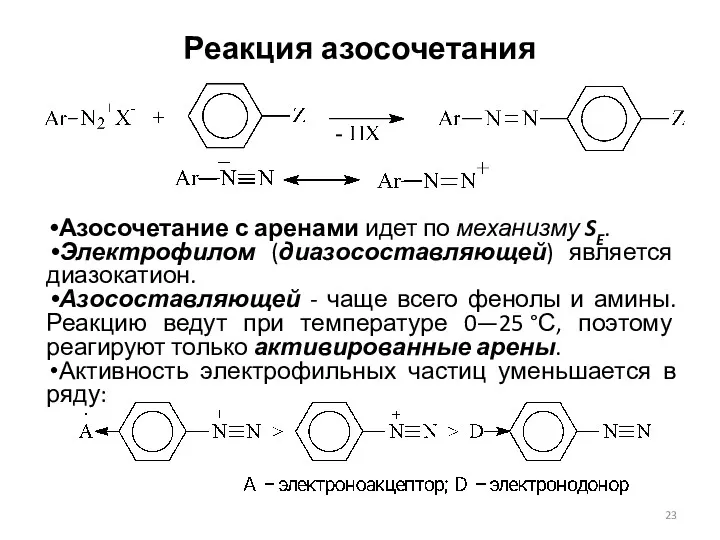
- 23. Реакция азосочетания Азосочетание с аренами идет по механизму SE. Электрофилом (диазосоставляющей) является диазокатион. Азосоставляющей - чаще
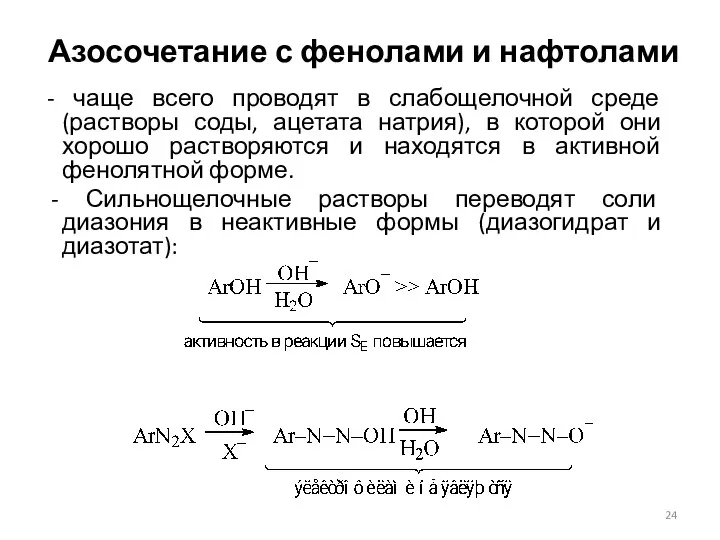
- 24. Азосочетание с фенолами и нафтолами - чаще всего проводят в слабощелочной среде (растворы соды, ацетата натрия),
- 25. Азосочетание с аминами Ведут в слабокислой среде (разбавленная уксусная кислота): амины растворяются, и значительная часть их
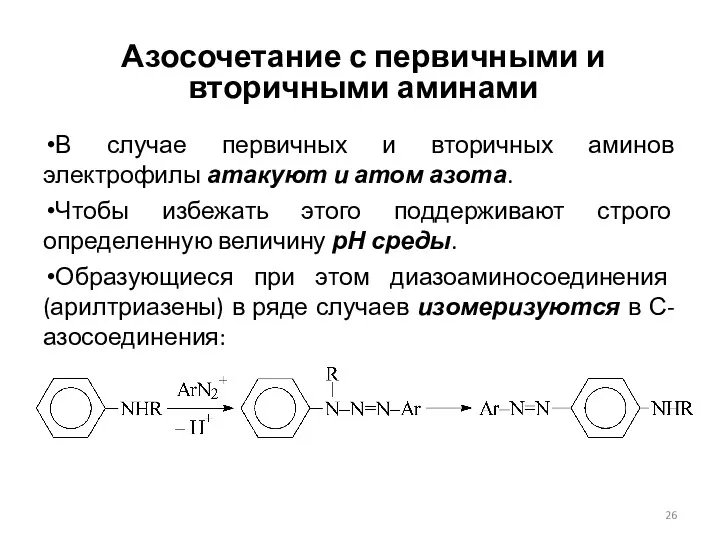
- 26. Азосочетание с первичными и вторичными аминами В случае первичных и вторичных аминов электрофилы атакуют и атом
- 28. Скачать презентацию
















 Органикалық қосылыстар
Органикалық қосылыстар Діагностика за показами газоаналізатора. Типи газоаналізаторів
Діагностика за показами газоаналізатора. Типи газоаналізаторів Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем
Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем Дисперсные системы. Дисперсное состояние вещества. Лекция 10
Дисперсные системы. Дисперсное состояние вещества. Лекция 10 Теория электролитической диссоциации
Теория электролитической диссоциации Производные фенантренизохинолина
Производные фенантренизохинолина Вчення про розчини. Рівновага в розчинах електролітів
Вчення про розчини. Рівновага в розчинах електролітів Паровые зоны в гидротермальных системах
Паровые зоны в гидротермальных системах Химические свойства легкоплавких металлов
Химические свойства легкоплавких металлов Сильные и слабые электролиты. Равновесие в растворах слабых электролитов. (Лекция 8)
Сильные и слабые электролиты. Равновесие в растворах слабых электролитов. (Лекция 8) Алюминий и его соединения
Алюминий и его соединения Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас
Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Металдарға жалпы сипаттама
Металдарға жалпы сипаттама Пируватдегидрогеназный комплекс
Пируватдегидрогеназный комплекс Углерод. Carbon
Углерод. Carbon Газы, применяемые при сварке
Газы, применяемые при сварке Коррозия и защита строительных материалов
Коррозия и защита строительных материалов Ароматические соединения. Тема № 5
Ароматические соединения. Тема № 5 Алюминий
Алюминий Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы Своя игра по химии
Своя игра по химии Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Нафта. Класифікація нафти
Нафта. Класифікація нафти Химическая связь
Химическая связь Карбоновые кислоты
Карбоновые кислоты Основные химические понятия и законы
Основные химические понятия и законы Теория электролитической диссоциации
Теория электролитической диссоциации