Содержание
- 2. План: Понятие о карбоновых кислотах. Одноосновные карбоновые кислоты Двухосновные карбоновые кислоты.
- 3. Карбоновыми кислотами называются производные углеводородов, в молекуле которых содержится одна или несколько карбоксильных групп –COOH, связанных
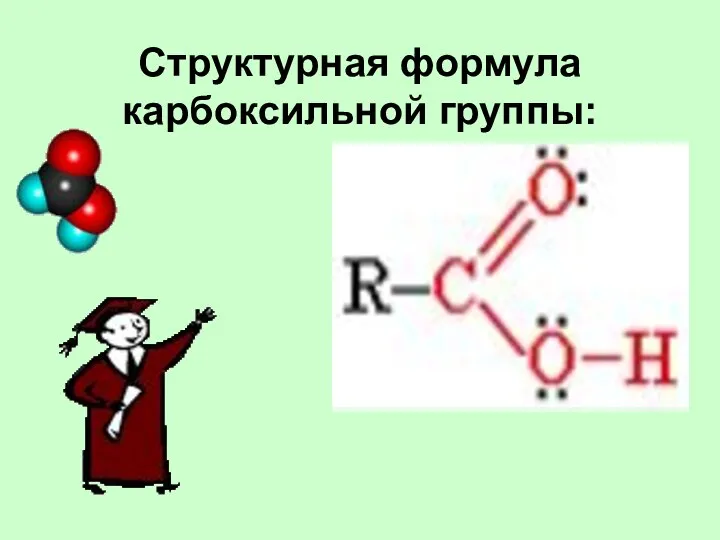
- 4. Структурная формула карбоксильной группы:
- 5. Классификация карбоновых кислот По числу карбоксиль- ных групп непредельные ароматические одноосновные двухосновные многоосновные предельные По типу
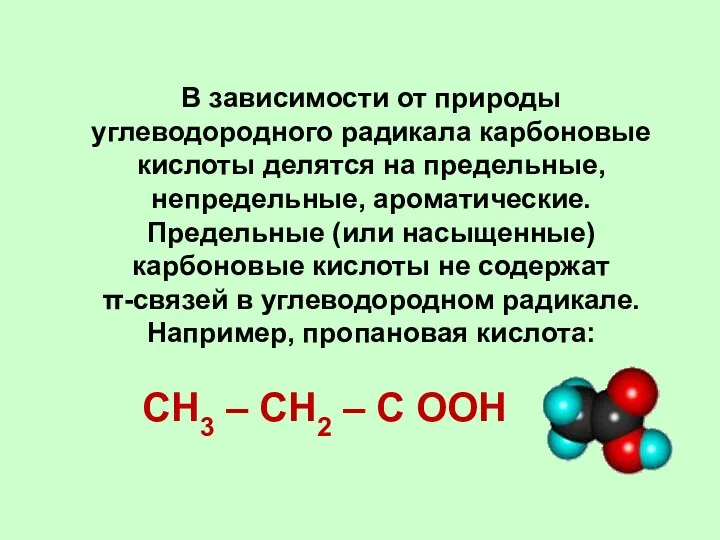
- 6. В зависимости от природы углеводородного радикала карбоновые кислоты делятся на предельные, непредельные, ароматические. Предельные (или насыщенные)
- 7. В молекулах непредельных карбоновых кислот карбоксильная группа связана с ненасыщенным, непредельным углеводородным радикалом. Например, акриловая кислота:
- 8. Ароматические кислоты содержат в молекуле ароматическое (бензольное) кольцо. Например, бензойная кислота: COOH
- 9. Номенклатура
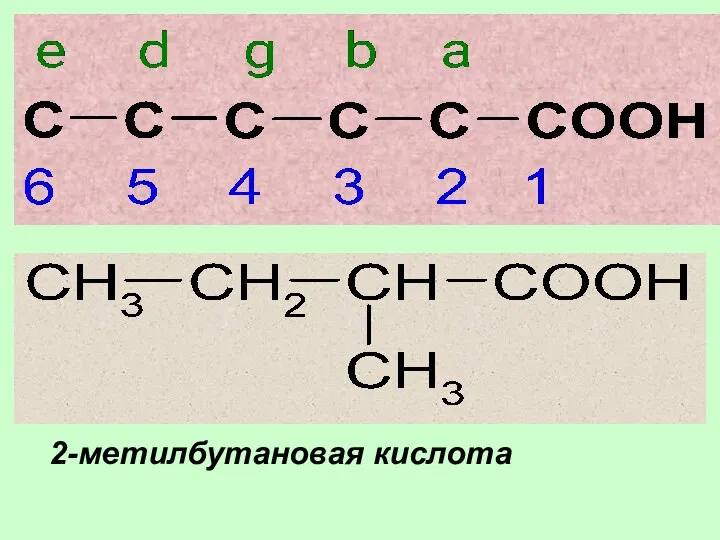
- 10. 2-метилбутановая кислота
- 11. Гомологический ряд
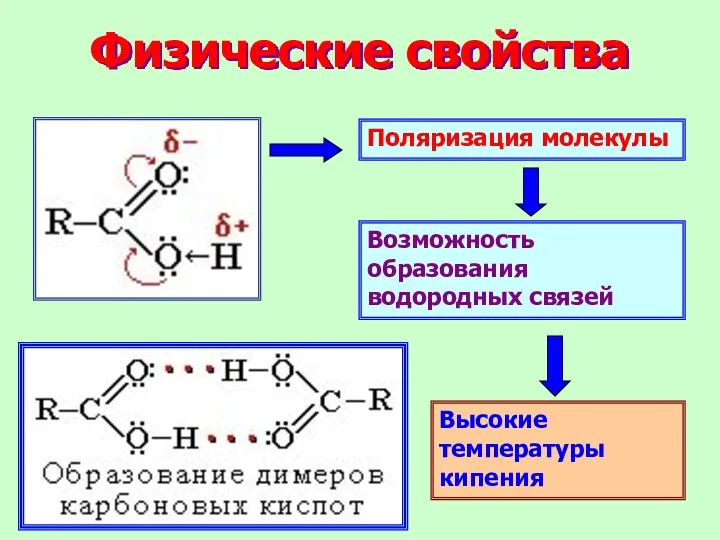
- 12. Физические свойства Поляризация молекулы Возможность образования водородных связей Высокие температуры кипения
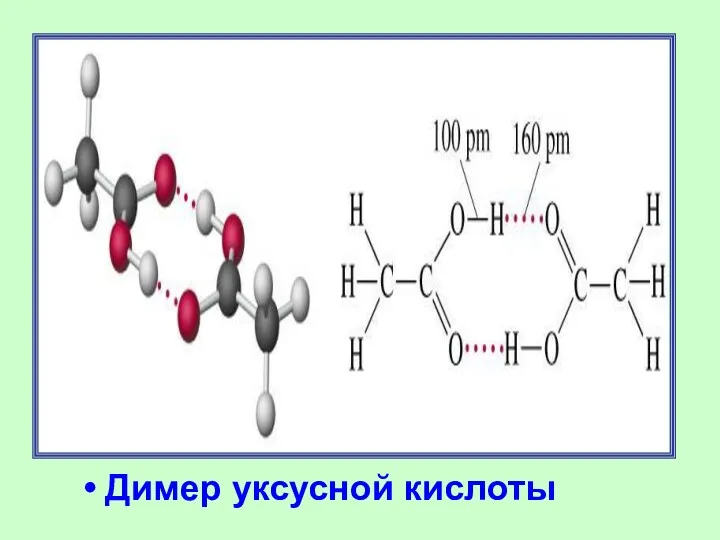
- 13. Димер уксусной кислоты
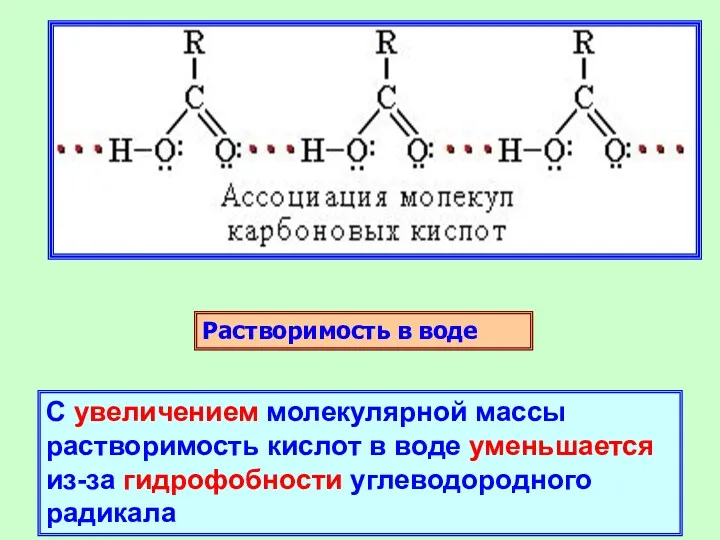
- 14. Растворимость в воде С увеличением молекулярной массы растворимость кислот в воде уменьшается из-за гидрофобности углеводородного радикала
- 15. Физические свойства Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в воде. С повышением
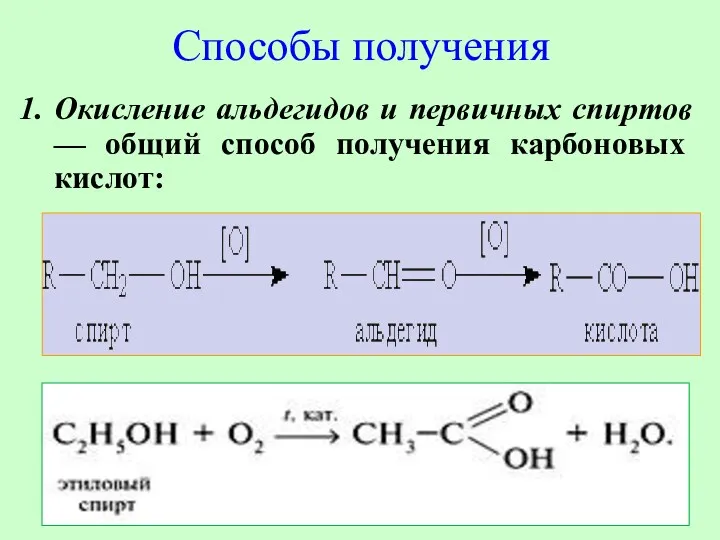
- 16. Способы получения Окисление альдегидов и первичных спиртов — общий способ получения карбоновых кислот:
- 17. 2. Другой общий способ — гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода:
- 18. 3. Взаимодействие реактива Гриньяра с СО2:
- 19. 4.Гидролиз сложных эфиров: O ║ CH3 –C – O – C2H5 + H2O → CH3 –
- 20. 5.Лабораторный способ
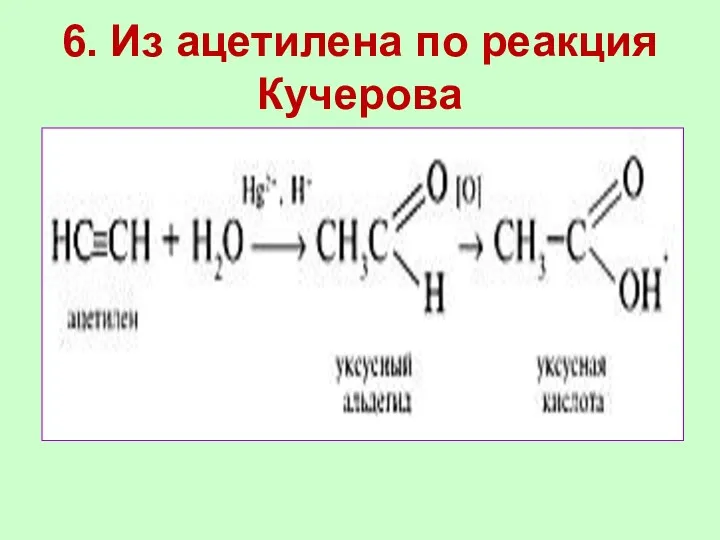
- 21. 6. Из ацетилена по реакция Кучерова
- 22. 7.Окисление бутана:
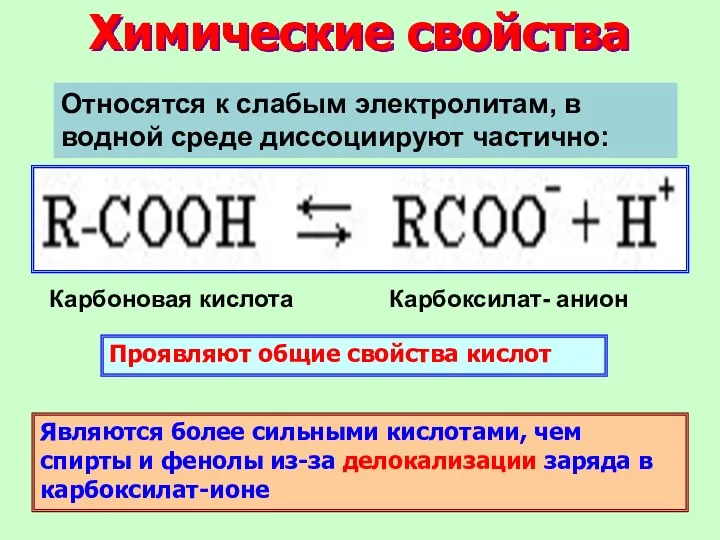
- 23. Химические свойства Проявляют общие свойства кислот Являются более сильными кислотами, чем спирты и фенолы из-за делокализации
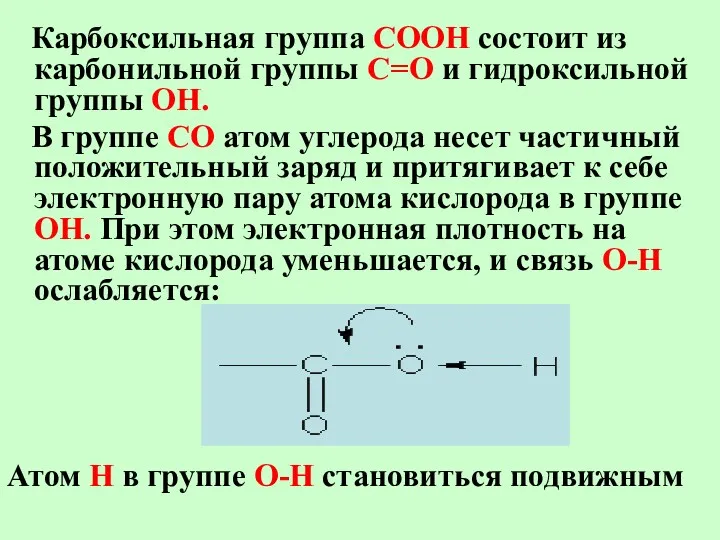
- 24. Карбоксильная группа СООН состоит из карбонильной группы С=О и гидроксильной группы ОН. В группе СО атом
- 25. Уксусная кислота Уксусная кислота (этановая)СН3СООН– самая древняя из органических кислот. Аптекари – алхимики средневековья получали её
- 26. Уксусная кислота в больших количествах применяется в химической промышленности. Основную часть уксусной кислоты используют для получения
- 27. Модель молекулы уксусной кислоты:
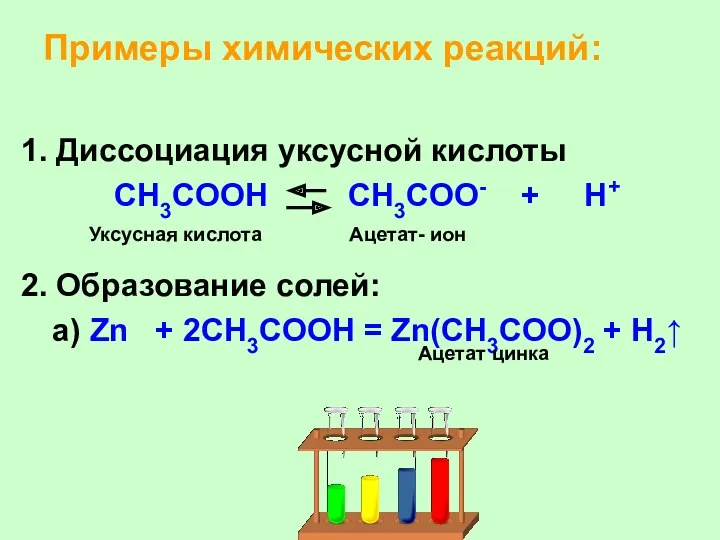
- 28. Примеры химических реакций: 1. Диссоциация уксусной кислоты CH3COOH CH3COO- + H+ 2. Образование солей: а) Zn
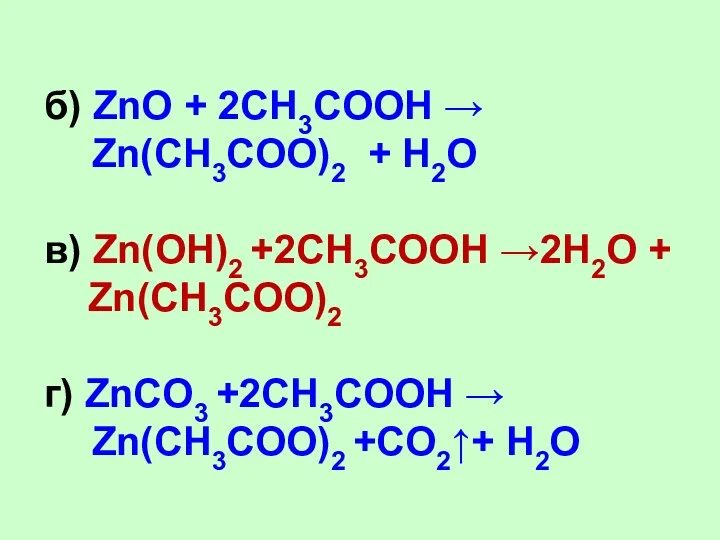
- 29. б) ZnO + 2CH3COOH → Zn(CH3COO)2 + H2O в) Zn(OH)2 +2CH3COOH →2H2O + Zn(CH3COO)2 г) ZnCO3
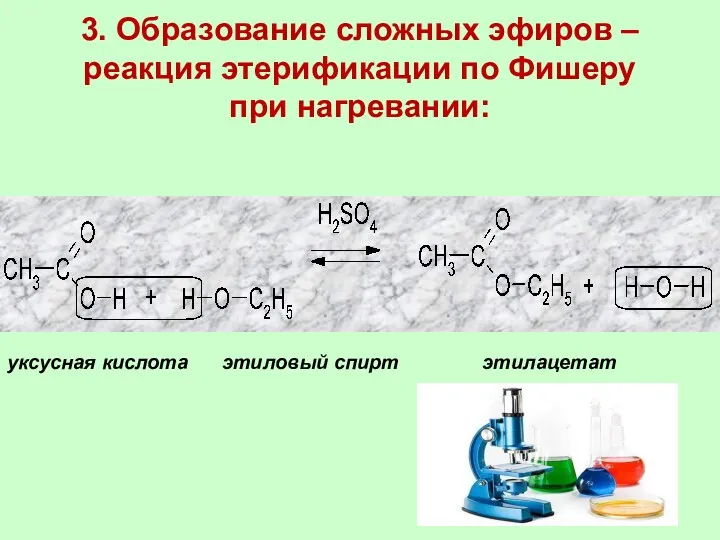
- 30. 3. Образование сложных эфиров – реакция этерификации по Фишеру при нагревании: уксусная кислота этиловый спирт этилацетат
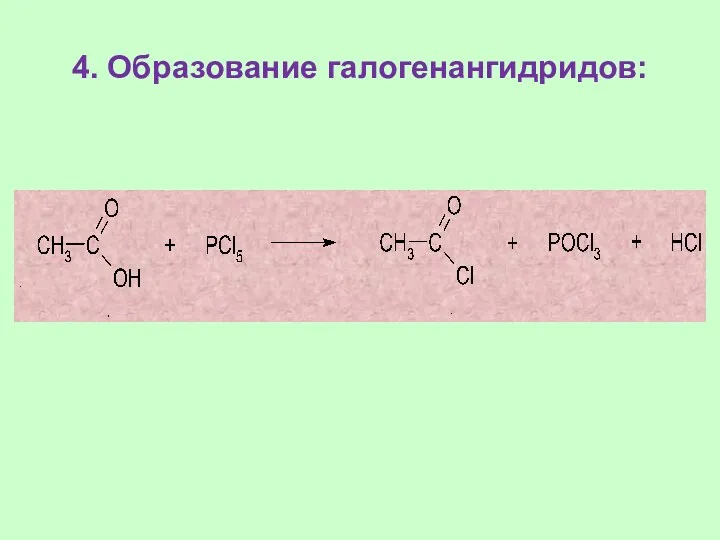
- 31. 4. Образование галогенангидридов:
- 32. 5. Реакции замещения (с галогенами) – в нее способны вступать предельные карбоновые кислоты. CH3 – COOH
- 33. 6. Образование амидов: CH3 – COOH + NН3 → CH3–CO NН2+ H2О ацетамид
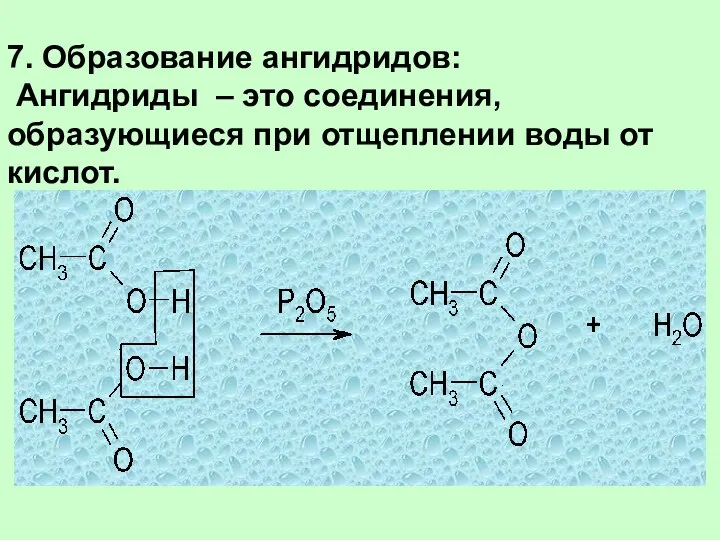
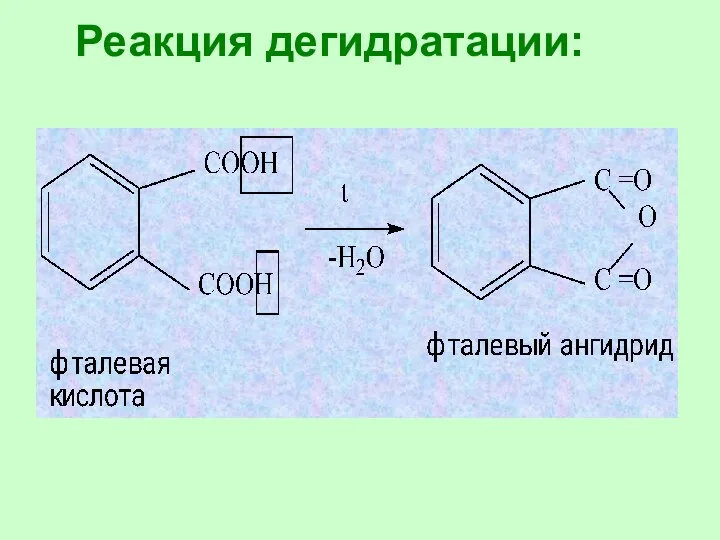
- 34. 7. Образование ангидридов: Ангидриды – это соединения, образующиеся при отщеплении воды от кислот.
- 35. Муравьиная кислота (метановая) НСООН - Содержится в выделениях муравьёв, в щетинках крапивы, в яде пчёл. Спиртовые
- 36. Модель молекулы муравьиной кислоты:
- 37. 1. Окисление муравьиной кислоты (эта реакция свойственна только для данной кислоты): 2KMnO4 + 5HCOOH + 3H2SO4
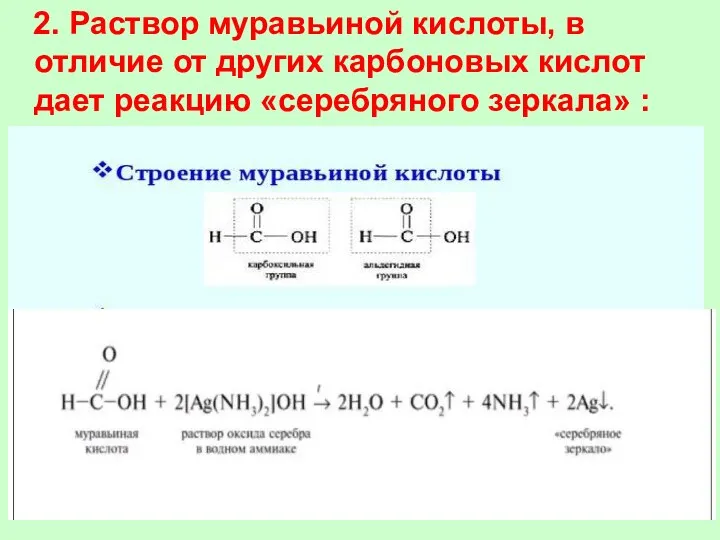
- 38. 2. Раствор муравьиной кислоты, в отличие от других карбоновых кислот дает реакцию «серебряного зеркала» :
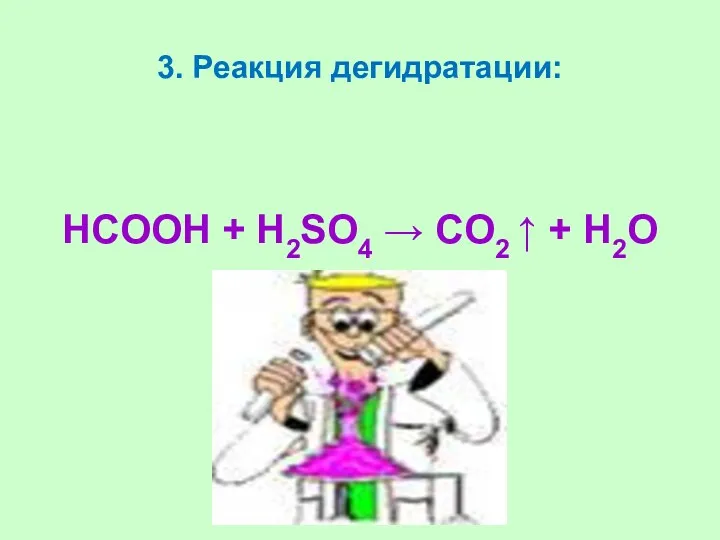
- 40. 3. Реакция дегидратации: HCOOH + Н2SO4 → CO2 ↑ + H2O
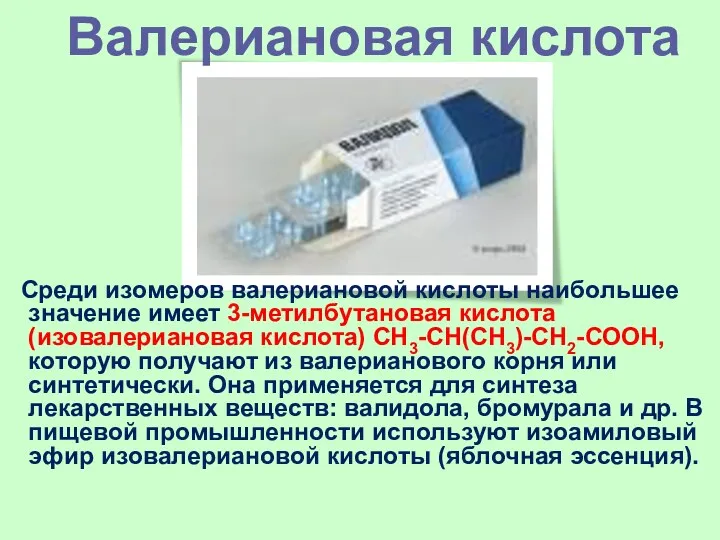
- 41. Среди изомеров валериановой кислоты наибольшее значение имеет 3-метилбутановая кислота (изовалериановая кислота) СН3-СH(СН3)-СН2-СООН, которую получают из валерианового
- 42. В промышленных масштабах бензойную кислоту получают окислением толуола. Применяют в медицине при кожных заболеваниях как наружное
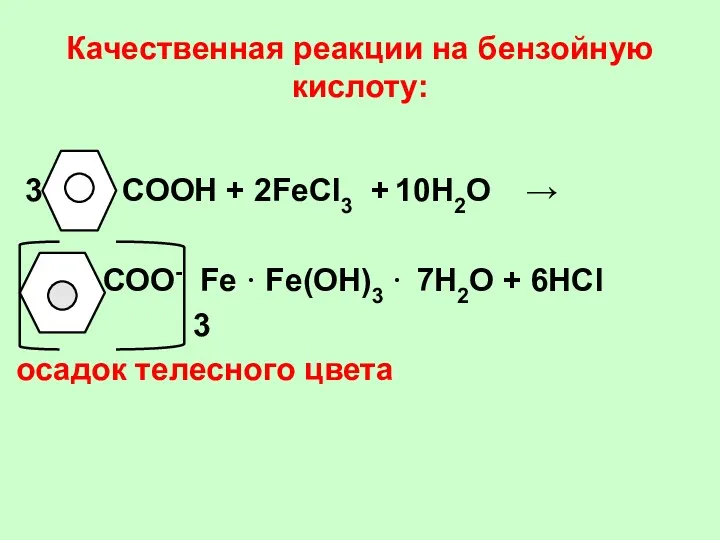
- 43. Качественная реакции на бензойную кислоту: 3 СООН + 2FeCl3 + 10Н2О → СОО- Fe · Fe(ОН)3
- 44. салициловая кислота Получают из коры ивового дерева. На ее основе готовят многие лекарства: например аспирин.
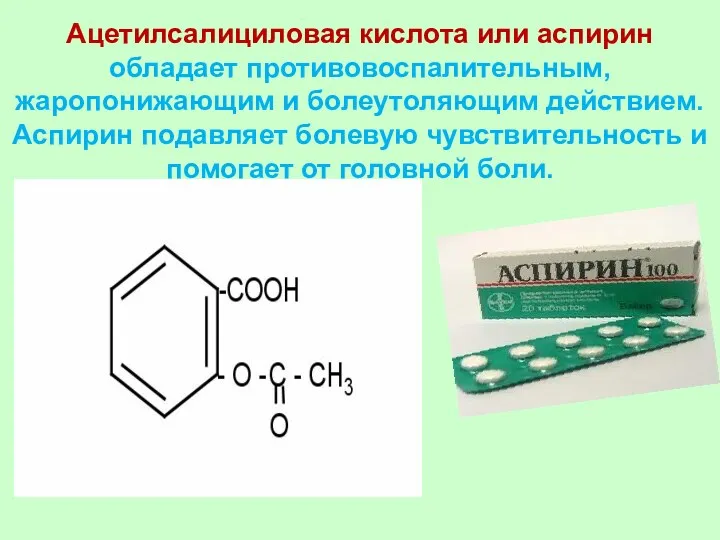
- 45. Ацетилсалициловая кислота или аспирин обладает противовоспалительным, жаропонижающим и болеутоляющим действием. Аспирин подавляет болевую чувствительность и помогает
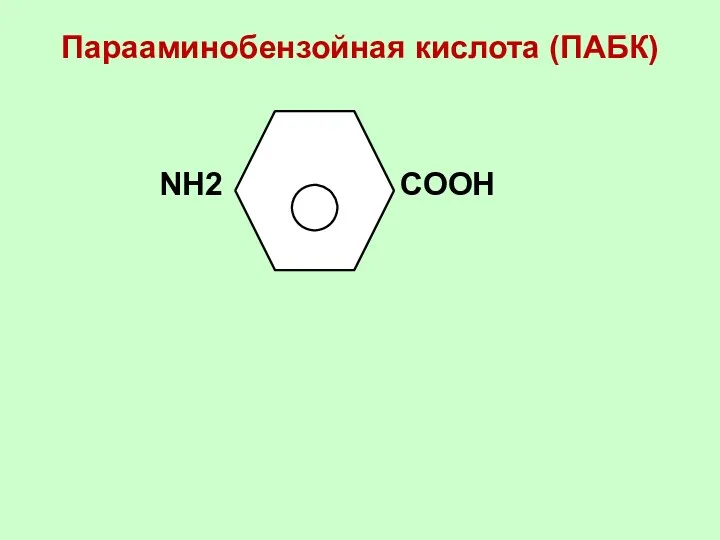
- 46. Парааминобензойная кислота (ПАБК) NН2 СООН
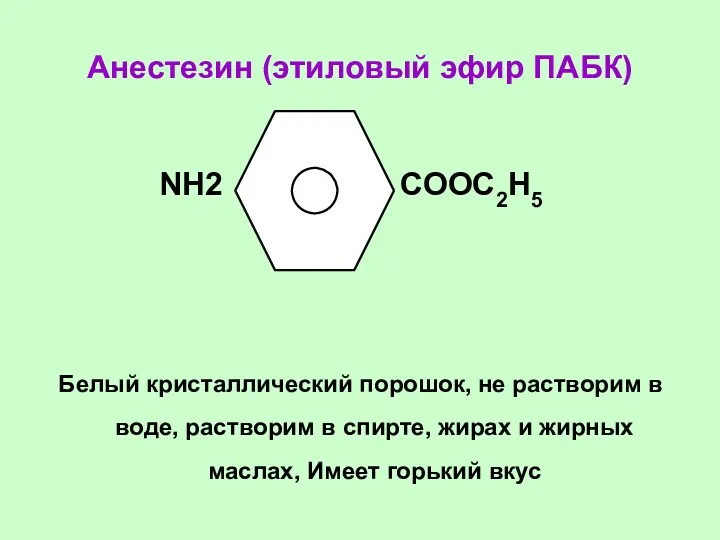
- 47. Анестезин (этиловый эфир ПАБК) NН2 СООС2Н5 Белый кристаллический порошок, не растворим в воде, растворим в спирте,
- 48. Стеариновая кислота относится к высшим карбоновым кислотам и имеет формулу С17Н35СООН. Она является одной из наиболее
- 49. Соли стеариновой кислоты называются стеаратами. Стеараты кальция, магния или железа, так же как сама стеариновая кислота,
- 50. пальмитиновая кислота Насыщенная карбоновая кислота. Наиболее распространённая в природе жирная предельная кислота: в виде сложных эфиров
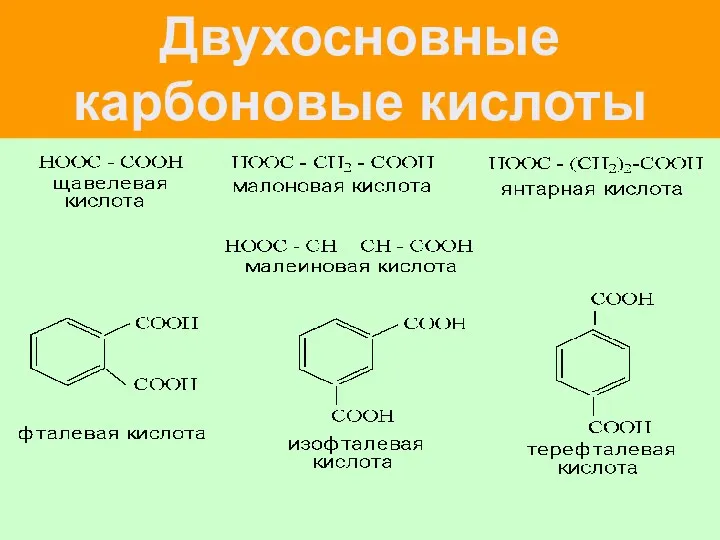
- 51. Двухосновные карбоновые кислоты
- 52. Номенклатура Систематическая номенклатура непредельных карбоновых кислот (ИЮПАК): Выбирают в молекуле наиболее длинную углеродную цепь с двумя
- 53. Пример:
- 54. Изомерия Изомерия строения углеродного скелета (структурная): а) строение углеводородного радикала 2. Положение карбоксильной группы
- 55. б)структурная изомерия связанная с положением ненасыщенных связей:
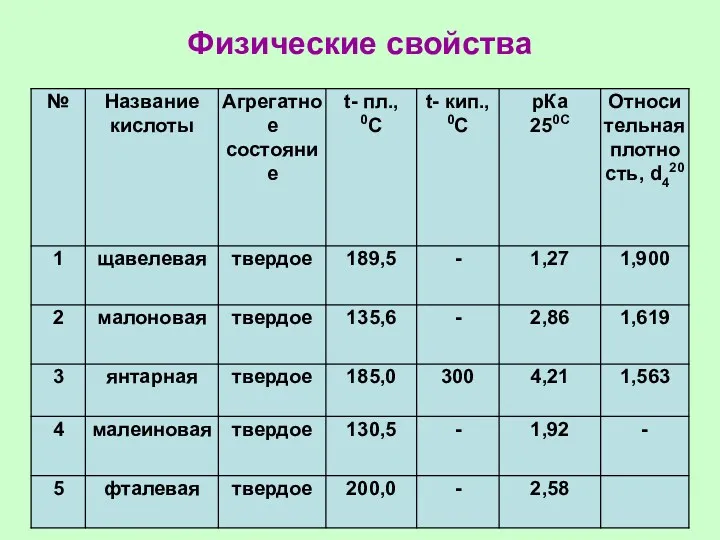
- 56. Физические свойства
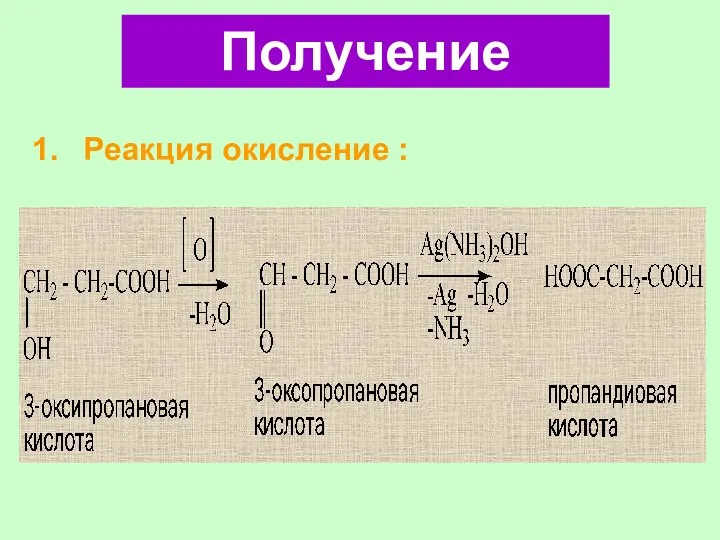
- 57. Реакция окисление : Получение
- 58. 2. Реакция окисления двухатомного спирта: СН2-СООН [О] С-ОН Аg(NН3)2ОН СН2-СООН С-ОН диальдегид -Аg,- NН3,-Н2О СООН СООН
- 59. 3. Из дигалогенпроизводных углеводородов:
- 60. 4. Промышленный способ получения щавелевой кислоты: НСООNа- НСООNа → СООNа- СООNа +Н2 2) СООNа- СООNа +
- 61. Благодаря наличию в молекуле двухосновных карбоновых кислот двух функциональных групп СООН, увеличиваются кислотные свойства соединения по
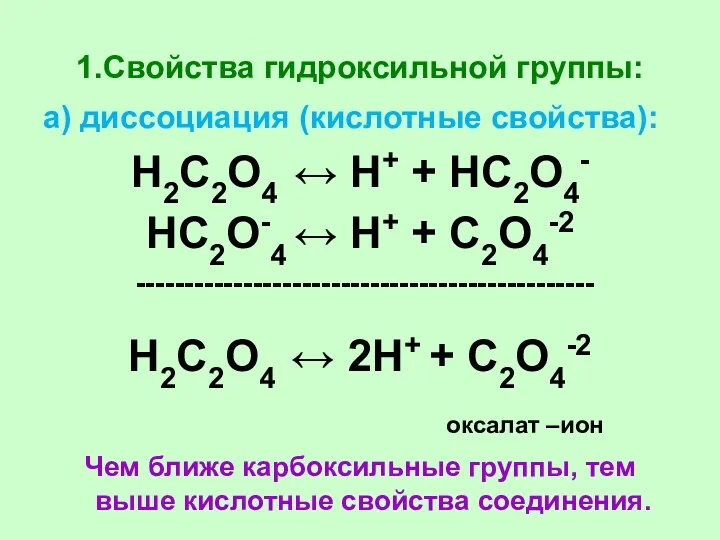
- 62. 1.Свойства гидроксильной группы: а) диссоциация (кислотные свойства): Н2С2О4 ↔ Н+ + НС2О4- НС2О-4 ↔ Н+ +
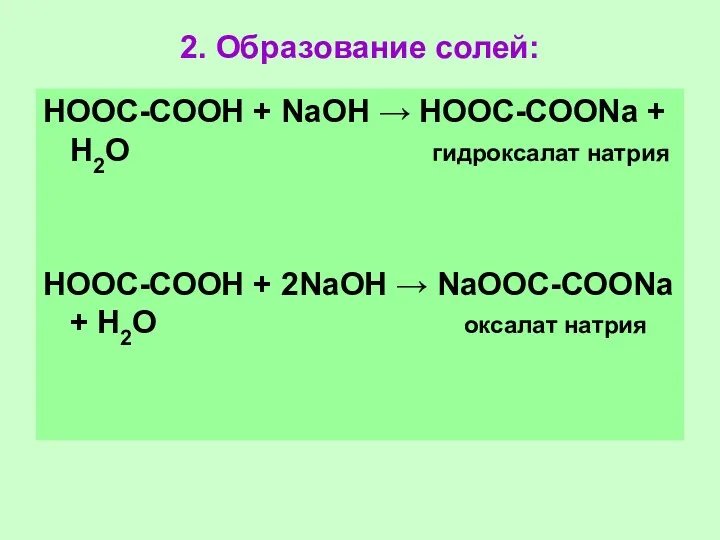
- 63. 2. Образование солей: НООС-СООН + NаОН → НООС-СООNа + Н2О гидроксалат натрия НООС-СООН + 2NаОН →
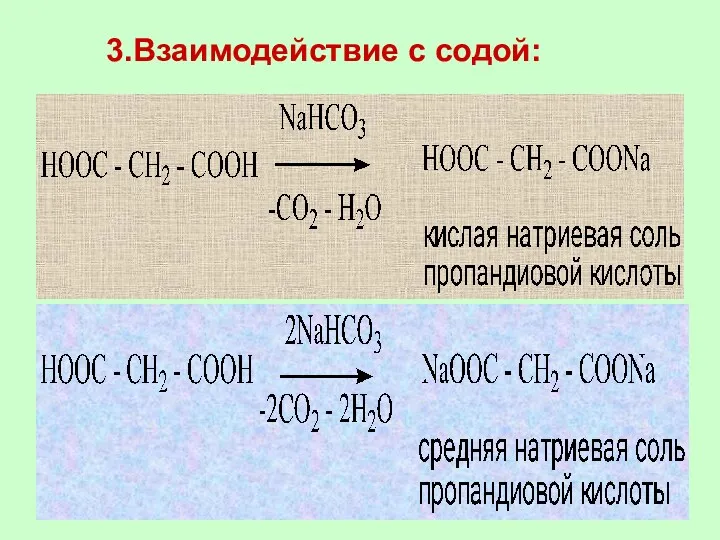
- 64. 3.Взаимодействие с содой:
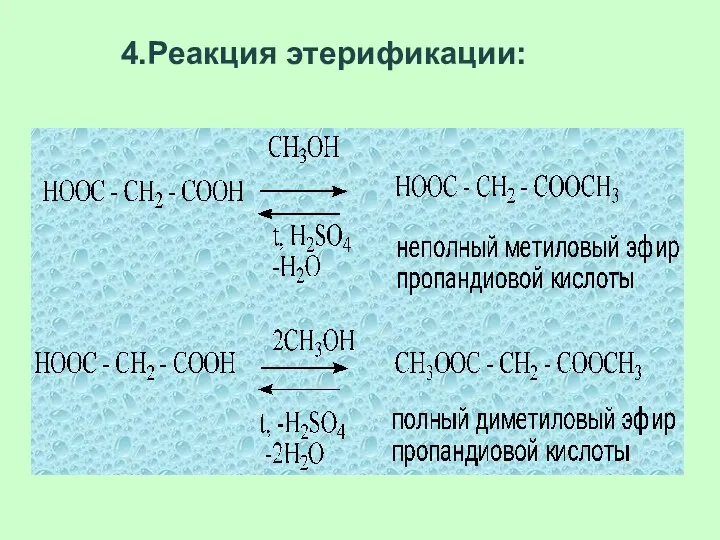
- 65. 4.Реакция этерификации:
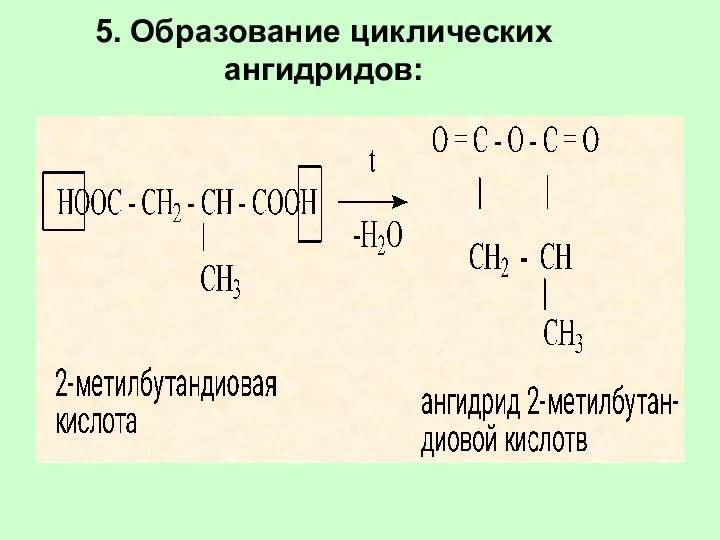
- 66. 5. Образование циклических ангидридов:
- 67. 6.Образование хлорангидридов: НООС-СООН + РСl5 → НООС-СОСl + Н2О неполный хлорангидрид щавелевой кислоты НООС-СООН + 2РСl5
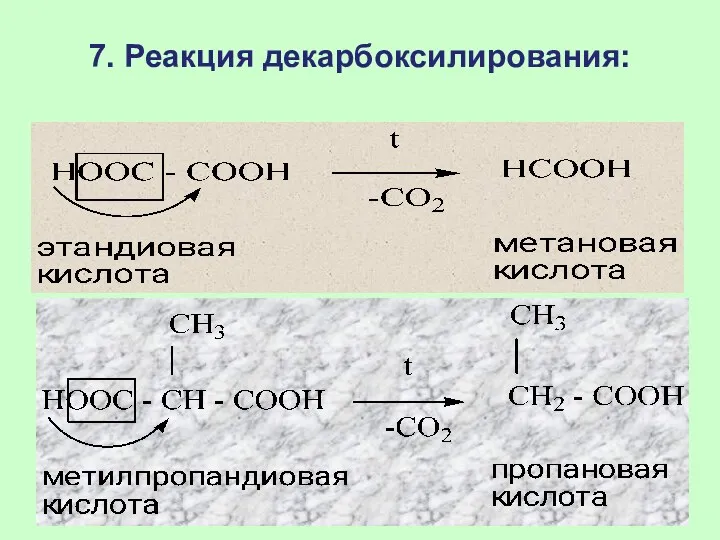
- 68. 7. Реакция декарбоксилирования:
- 69. 8. Реакция окисления: [О] НООС-СООН СО2↑ + Н2О [О] – КМnО4 + Н2SО4
- 70. 9. Качественная реакция на щавелевую кислоту: НООС-СООН + СаСl2 → ООС-СОО↓ +2НСl Са оксалат кальция белый
- 71. Щавелевая кислота Бесцветное вещество в виде кристаллов. Содержится в щавеле, ревене, шпинате, клевере и помидорах. Применяется
- 72. Впервые получена в XVII веке перегонкой янтаря. Содержится недозрелых фруктах и буром угле. Используется, как лекарст-
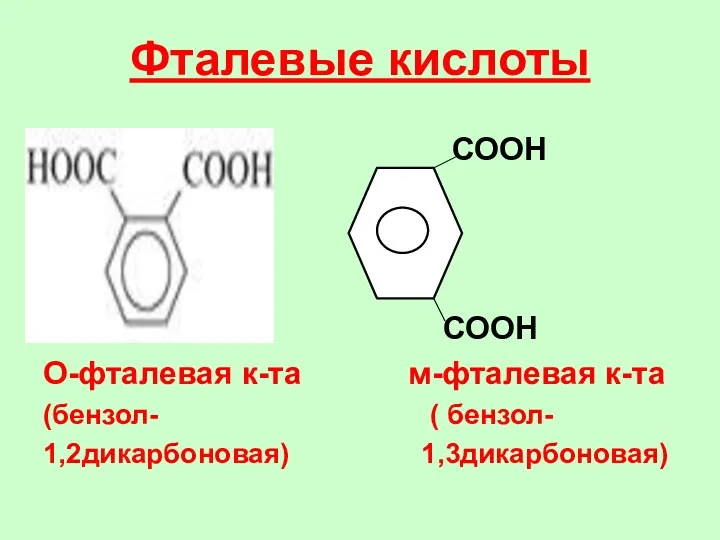
- 73. Фталевые кислоты СООН СООН О-фталевая к-та м-фталевая к-та (бензол- ( бензол- 1,2дикарбоновая) 1,3дикарбоновая)
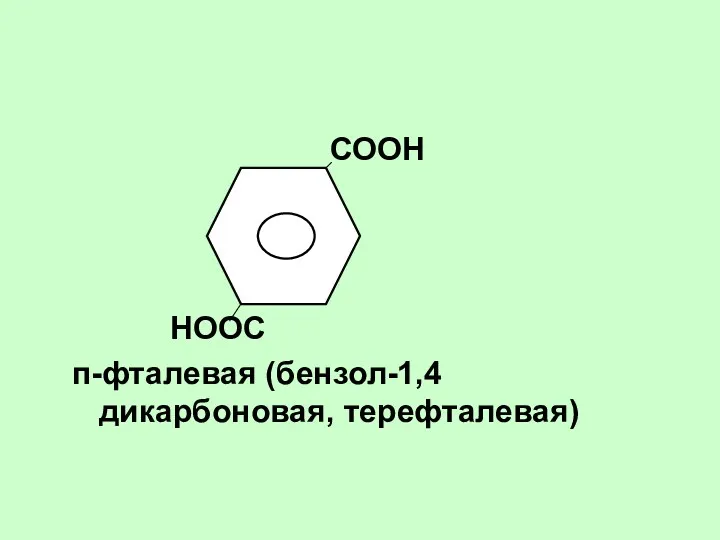
- 74. СООН НООС п-фталевая (бензол-1,4дикарбоновая, терефталевая)
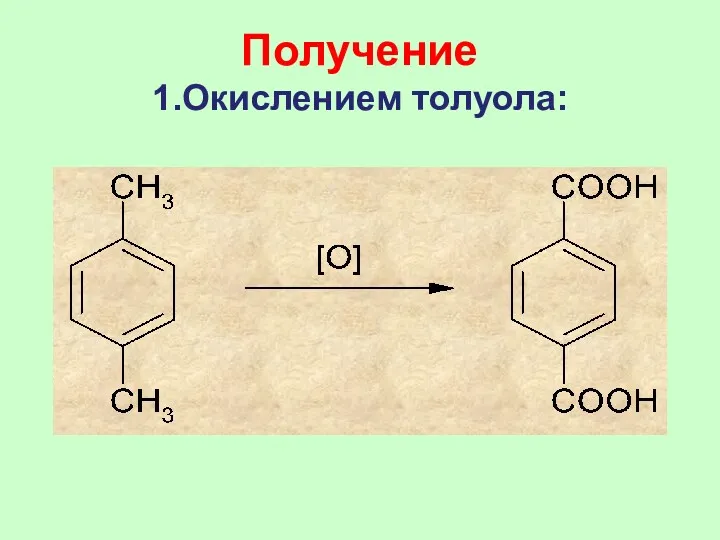
- 75. Получение 1.Окислением толуола:
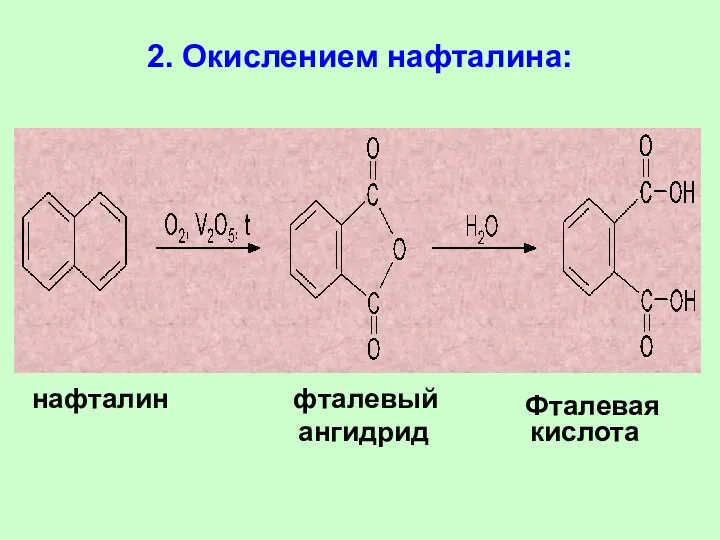
- 76. 2. Окислением нафталина: нафталин фталевый ангидрид кислота Фталевая
- 77. Реакция дегидратации:
- 78. Применение При конденсации фталевого ангидрида с фенолом в присутствии безводного хлорида цинка образуется фенолфталеин, который применяется
- 79. 4. Вопросы и задания. Что называется карбоновыми кислотами? Напишите молекулярную и структурную формулу карбоксильной функциональной группы.
- 81. Скачать презентацию






























![2. Реакция окисления двухатомного спирта: СН2-СООН [О] С-ОН Аg(NН3)2ОН СН2-СООН](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/403122/slide-57.jpg)




![8. Реакция окисления: [О] НООС-СООН СО2↑ + Н2О [О] – КМnО4 + Н2SО4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/403122/slide-68.jpg)





 Общая характеристика халькогенов. Кислород
Общая характеристика халькогенов. Кислород Нанохимия
Нанохимия Фосфор и его соединения. Электронные формулы атома фосфора
Фосфор и его соединения. Электронные формулы атома фосфора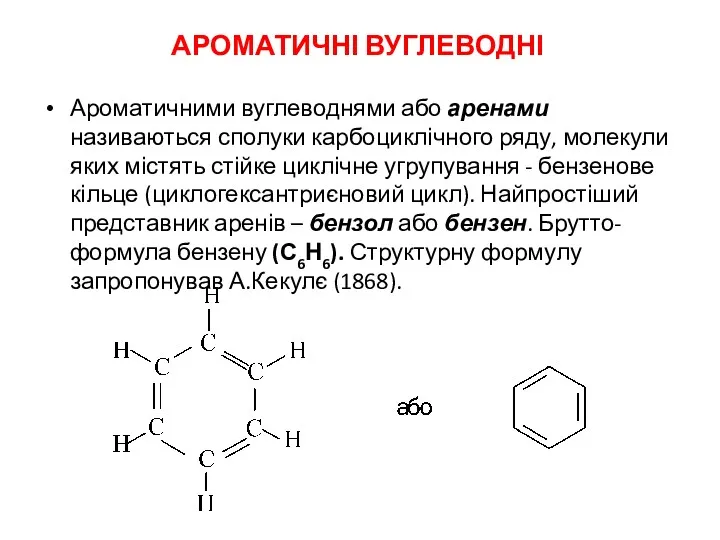 Ароматичні вуглеводні
Ароматичні вуглеводні Гидродинамические свойства полимеров. Полиэлектролиты
Гидродинамические свойства полимеров. Полиэлектролиты Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу
Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу Озон. Значение Озона
Озон. Значение Озона Обзор электродных процессов
Обзор электродных процессов Особенности химического состава клетки
Особенности химического состава клетки Хром. Элемент под № 24
Хром. Элемент под № 24 Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Аминокислоты. Белки
Аминокислоты. Белки Металлические стёкла
Металлические стёкла Бета-лактамиды (природные и полусинтетические пенициллины и цефалоспорины)
Бета-лактамиды (природные и полусинтетические пенициллины и цефалоспорины) Кислоты, основания, соли в свете ТЭД
Кислоты, основания, соли в свете ТЭД Практическая работа по разделению смесей
Практическая работа по разделению смесей Свинец
Свинец Кислородные соединения азота
Кислородные соединения азота Буферные растворы
Буферные растворы Основные классы неорганических веществ. Соединения химических элементов
Основные классы неорганических веществ. Соединения химических элементов Резина. Состав и применение резины
Резина. Состав и применение резины Аминокислоты. Понятие аминокислот
Аминокислоты. Понятие аминокислот АЛКАНЫ Строение молекулы метана.
АЛКАНЫ Строение молекулы метана. Растворы. Классификация, способы выражения концентрации, свойства растворов
Растворы. Классификация, способы выражения концентрации, свойства растворов 20230205_okislitelno-vosstanovitelnye_reaktsii
20230205_okislitelno-vosstanovitelnye_reaktsii Хімічні властивості оксидів
Хімічні властивості оксидів Электролиз. Электролизеры
Электролиз. Электролизеры Моделирование структуры биомакромолекул
Моделирование структуры биомакромолекул