Содержание
- 2. Понятие о окислительно –восстановительных реакциях Это реакции в ходе которых происходит изменение степеней окисления атомов ,
- 3. Степень окисления Условный заряд атомов химического элемента в соединении , вычисленный из предположения, что соединение состоит
- 4. Расчет степени окисления для неорганических веществ 1. Степень окисления атомов в простом веществе равна нулю. Простое
- 5. Расчет степени окисления для неорганических веществ 2. в бинарных соединениях отрицательную степень окисления проявляет атом более
- 6. Расчет степени окисления для неорганических веществ 3.сумма степеней окисления всех атомов в молекуле (формульной единице) равна
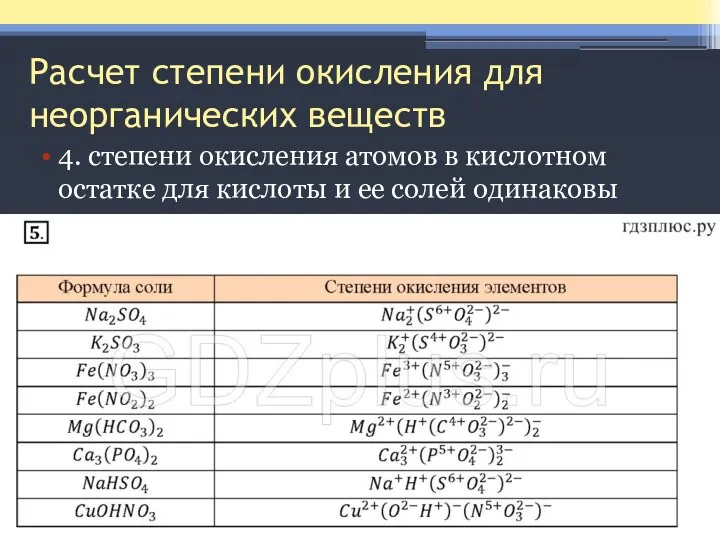
- 7. Расчет степени окисления для неорганических веществ 4. степени окисления атомов в кислотном остатке для кислоты и
- 8. Расчет степени окисления для неорганических веществ 5. для простых ионов их заряд совпадает со степенью окисления
- 10. Процессы окисления и восстановления Процесс когда один атом или ион химического элемента отдает электроны называется окислением,
- 11. Прямая помогает какое количество электронов теряет или принимает электрон
- 13. Дуализм Многие вещества способны проявлять в зависимости от условий как восстановительные так и окислите6льные свойства. ПРИЧИНЫ:
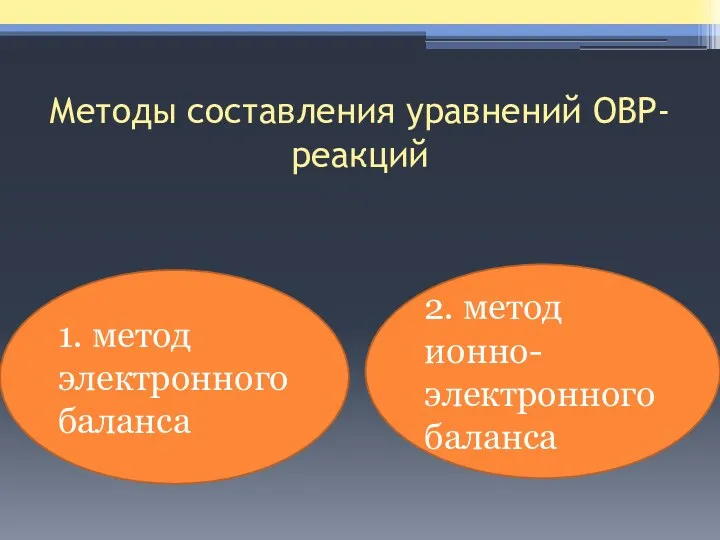
- 14. Методы составления уравнений ОВР- реакций 1. метод электронного баланса 2. метод ионно-электронного баланса
- 15. Метод электронного баланса
- 18. Недостатки метода электронного баланса 1. условная запись отдельных атомов в различных степенях окисления, хотя к самостоятельному
- 19. Метод электронно-ионного баланса Метод электронно-ионного баланса или метод полуреакций имеет отличие в том, что составляют два
- 20. Преимущество метода ионно-электронного баланса состоит также в том, что с его помощью легко можно расставить все
- 21. В методе полуреакций при составлении уравнений ОВР следует придерживаться той же формы записи, что и для
- 22. В кислых средах избыток кислорода в исходных веществах по сравнению с продуктами связывается ионами водорода с
- 23. 1) Составить схему реакции: Записать исходные вещества и продукты реакции: Na2SO3 + KMnO4 + H2SO4 =
- 24. Восстановитель SO32- — окисляется до SO42-, отдав 2 электрона. Как видно образовавшийся ион SO42- содержит больше
- 25. 5) Просуммировать обе полуреакции Предварительно умножая на найденные коэффициенты, получаем: 2MnO4— + 16H+ + 5SO32- +
- 26. Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде. Na2SO3
- 27. Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде. Na2SO3 + KMnO4 +
- 29. Скачать презентацию
























 Вирощування кристалів в додомашніх умовах
Вирощування кристалів в додомашніх умовах Чистые вещества и смеси
Чистые вещества и смеси Кристалічні та аморфні тіла. Рідкі кристали та їх властивості
Кристалічні та аморфні тіла. Рідкі кристали та їх властивості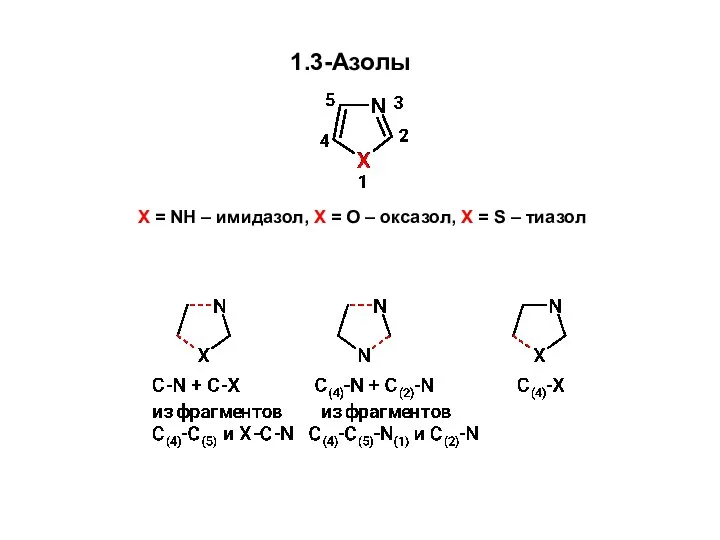 Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N
Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N Аммиак. Соли аммония
Аммиак. Соли аммония Выращивание кристаллов медного купороса в домашних условиях
Выращивание кристаллов медного купороса в домашних условиях Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Автомобильные масла. Классификация и применение автомобильных масел
Автомобильные масла. Классификация и применение автомобильных масел Нітрати – токсичні речовини
Нітрати – токсичні речовини Исследование модифицирования на структуру и жидкотекучесть сплава АК12
Исследование модифицирования на структуру и жидкотекучесть сплава АК12 Распространение пламени в газах
Распространение пламени в газах Химические свойства металлов
Химические свойства металлов Виды химической связи
Виды химической связи Сплавы, растворы и смеси. Задачи на концентрвцию
Сплавы, растворы и смеси. Задачи на концентрвцию Stirring in liquid media
Stirring in liquid media Строение атома
Строение атома Бензол. Чикишев С. (2)
Бензол. Чикишев С. (2) Непредельные углеводороды. Этиленовые углеводороды (алкены)
Непредельные углеводороды. Этиленовые углеводороды (алкены) Изучение свойств горных пород, минералов и полезных ископаемых
Изучение свойств горных пород, минералов и полезных ископаемых Аминокислоты, их строение, изомерия, свойства, применение
Аминокислоты, их строение, изомерия, свойства, применение Углерод и его оксиды
Углерод и его оксиды Гидроксиды. Основания: способы получения
Гидроксиды. Основания: способы получения Многообразие карбоновых кислот
Многообразие карбоновых кислот Механизмы органических реакций
Механизмы органических реакций Изменения, происходящие с липидами в процессах технологической переработки сырья и параметры, характеризующие их
Изменения, происходящие с липидами в процессах технологической переработки сырья и параметры, характеризующие их Азот и его соединения
Азот и его соединения Введение в общеобразовательную научную дисциплину Химия
Введение в общеобразовательную научную дисциплину Химия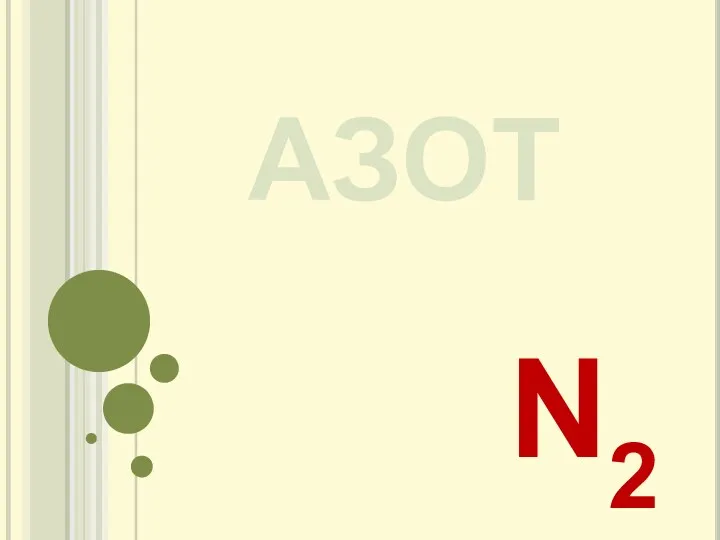 20230419_azot
20230419_azot