Содержание
- 2. ИСТОРИЯ ОТКРЫТИЯ К.Шееле и Г.Кавендиш получили азот 1772г. Д.Резерфорд описал получение и свойства 1787г. Лавуазье предложил
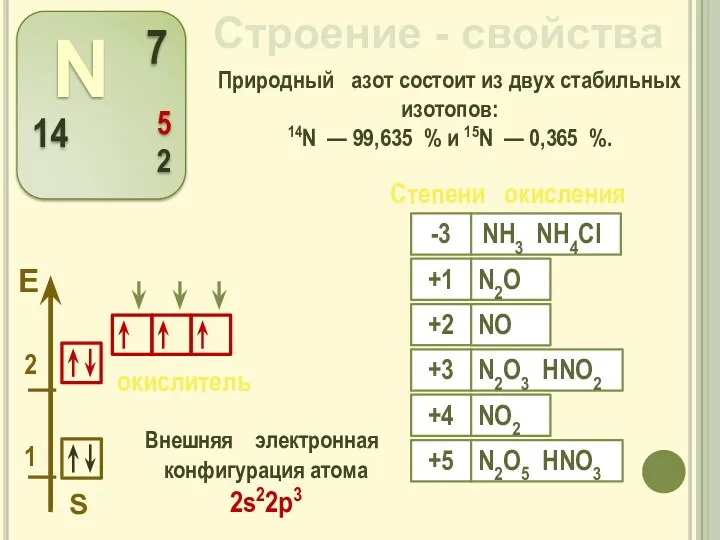
- 3. Строение - свойства Внешняя электронная конфигурация атома 2s22р3 S Природный азот состоит из двух стабильных изотопов:
- 4. Распространение в природе Азот в связанном виде входит в состав двух селитр: натриевой NaNO3 (чилийская) и
- 5. НАХОЖДЕНИЕ В ПРИРОДЕ: 1)в свободном состоянии в атмосфере (78%), 2)в связанном состоянии
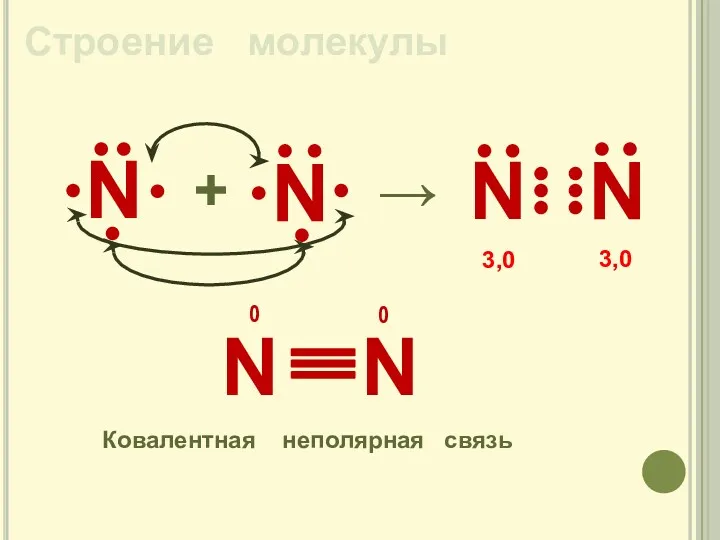
- 6. Строение молекулы N + → N Ковалентная неполярная связь 3,0 3,0 0 0
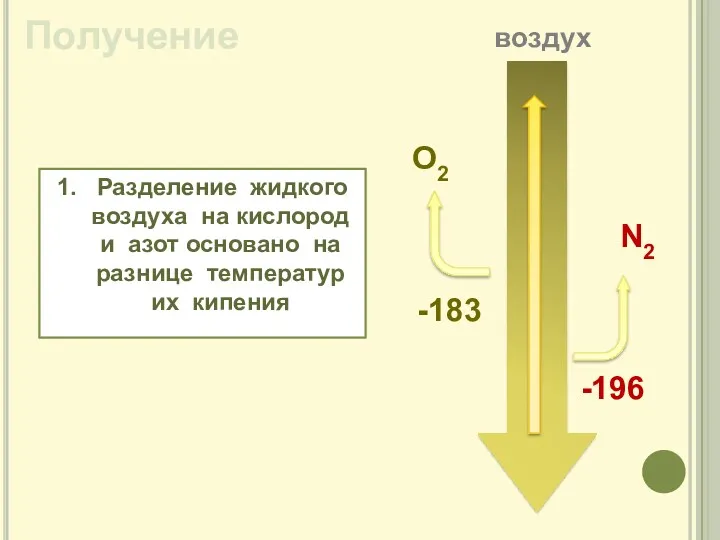
- 7. Получение 1. Разделение жидкого воздуха на кислород и азот основано на разнице температур их кипения O2
- 8. Получение в лаборатории 2. Разложение нитрита аммония NH4NO2 ⇒ N2 + H2O
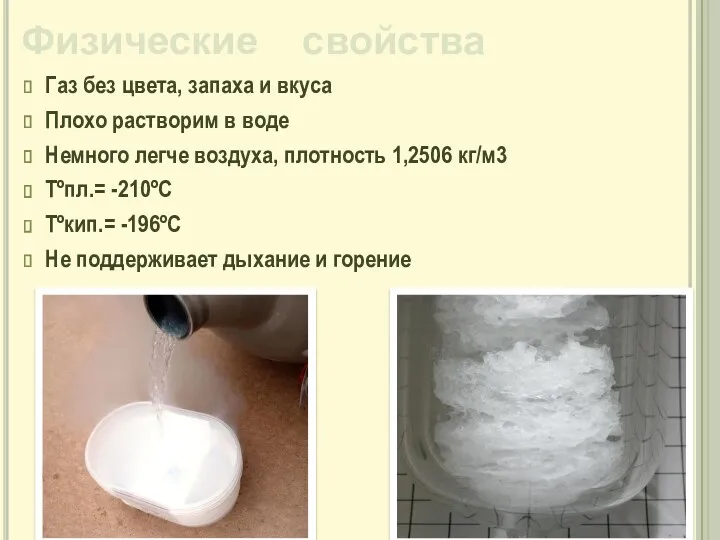
- 9. Физические свойства Газ без цвета, запаха и вкуса Плохо растворим в воде Немного легче воздуха, плотность
- 10. Химические свойства 1. Взаимодействие с металлами 6 Li + N2 ⇒ 2 Li3N (нитрид лития) 2
- 11. Химические свойства 2. Взаимодействие с кислородом N2 + О2⇒ 2 NO Температура электрической дуги 3000 -
- 12. ПРИМЕНЕНИЕ АЗОТА Применение Получение аммиака и азотной кислоты. Создание инертной атмосферы в металлургии. Производство азотных удобрений.
- 14. Скачать презентацию







 Угарный газ
Угарный газ Коррозия и защита строительных материалов
Коррозия и защита строительных материалов Простые вещества. Игра Счастливый случай
Простые вещества. Игра Счастливый случай Химия в повседневной жизни человека
Химия в повседневной жизни человека Жидкокристаллические композиты ЖКК. Керамические композиционные материалы (ККМ). Углерод-углеродные композиционные (УУКМ)
Жидкокристаллические композиты ЖКК. Керамические композиционные материалы (ККМ). Углерод-углеродные композиционные (УУКМ)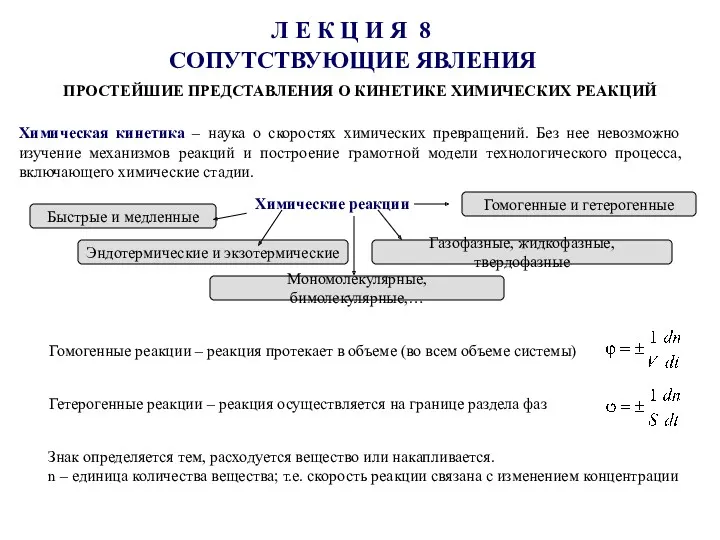 Простейшие представления о кинетике химических реакций
Простейшие представления о кинетике химических реакций Органическая химия
Органическая химия Кинетическое уравнение математическая запись закона действующих масс
Кинетическое уравнение математическая запись закона действующих масс Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Необоротні і оборотні хімічні процеси. Хімічна рівновага
Необоротні і оборотні хімічні процеси. Хімічна рівновага Химический элемент V группы: сурьма
Химический элемент V группы: сурьма Интоксикация ртутью
Интоксикация ртутью Качественные реакции на органические вещества
Качественные реакции на органические вещества Crystal Defects and Noncrystalline Structure–Imperfection
Crystal Defects and Noncrystalline Structure–Imperfection Аномальные свойства воды – основа жизни на Земле
Аномальные свойства воды – основа жизни на Земле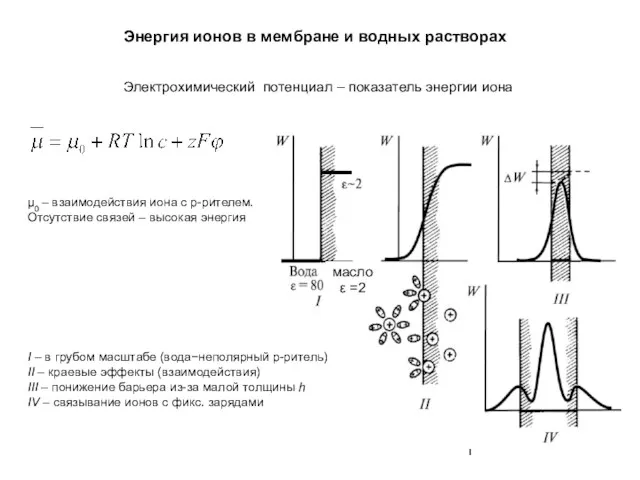 Энергия ионов в мембране и водных растворах
Энергия ионов в мембране и водных растворах Основные особенности композитов по сравнению с традиционными материалами
Основные особенности композитов по сравнению с традиционными материалами Карбонильные соединения
Карбонильные соединения Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Химическая связь
Химическая связь Металлы II группы главной подгруппы
Металлы II группы главной подгруппы Паровые зоны в гидротермальных системах
Паровые зоны в гидротермальных системах Алкадиены. Диеновые углеводороды
Алкадиены. Диеновые углеводороды Состояние атмосферного воздуха в Ярославской области
Состояние атмосферного воздуха в Ярославской области Теплота горения
Теплота горения Ionic polymerization
Ionic polymerization Химия. Изучение жиров
Химия. Изучение жиров Сутектік көрсеткіш ph. Тұздар гидролизі
Сутектік көрсеткіш ph. Тұздар гидролизі