Содержание
- 2. АМИНОКИСЛОТЫ (АК) органические соединения, в состав которых входят карбоксильная группа и аминогруппа
- 3. Классификация аминокислот По происхождению АК бывают: природные и синтетические. II. Природные АК можно условно разделить на:
- 4. Природные аминокислоты – мономеры пептидов и белков По взаимному расположению функциональ- ных групп они являются α-аминокислотами:
- 5. Все α-аминокислоты (кроме глицина) могут существовать в виде двух зеркальных изомеров (D и L) – энантиомеров.
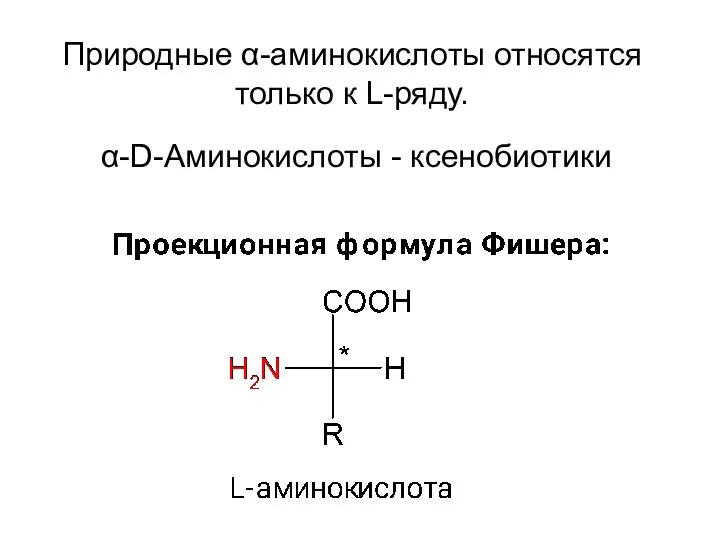
- 6. Природные α-аминокислоты относятся только к L-ряду. α-D-Аминокислоты - ксенобиотики
- 7. 20 L-аминокислот (по биологической ценности) заменимые незаменимые* валин изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан +
- 8. Кислотно-основные свойства АК В зависимости от числа кислотных и основных функциональных групп АК делятся на: -
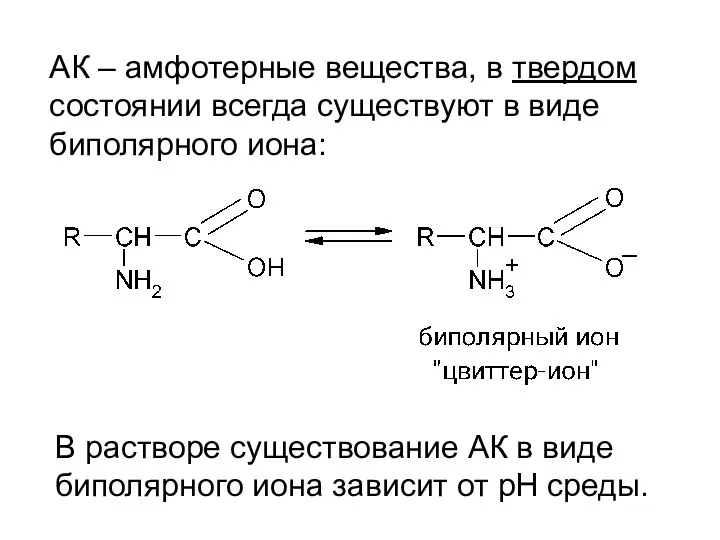
- 9. АК – амфотерные вещества, в твердом состоянии всегда существуют в виде биполярного иона: В растворе существование
- 10. Для каждой АК существует определенное значение рН, называемое изоэлектрической точкой (pI), при котором содержание в растворе
- 11. Поведение нейтральных АК в зависимости от рН среды +ОН - +Н+ -H2O В изоэлектрической точке суммарный
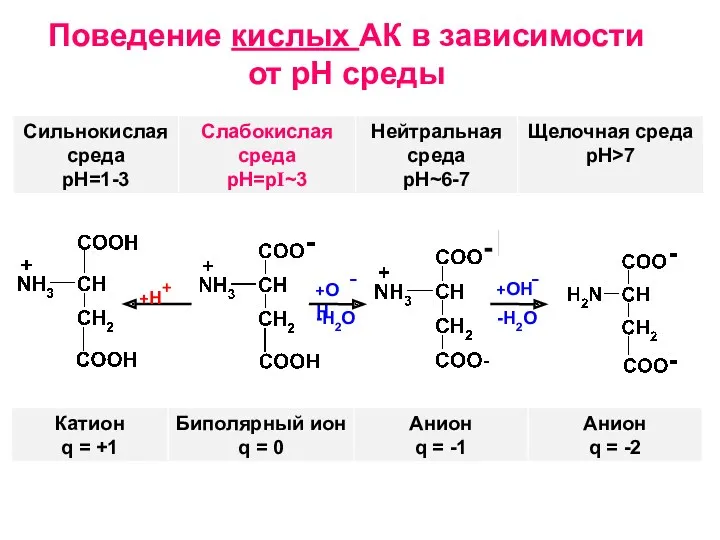
- 12. Поведение кислых АК в зависимости от рН среды +Н+ +ОН - +ОН - -H2O -H2O
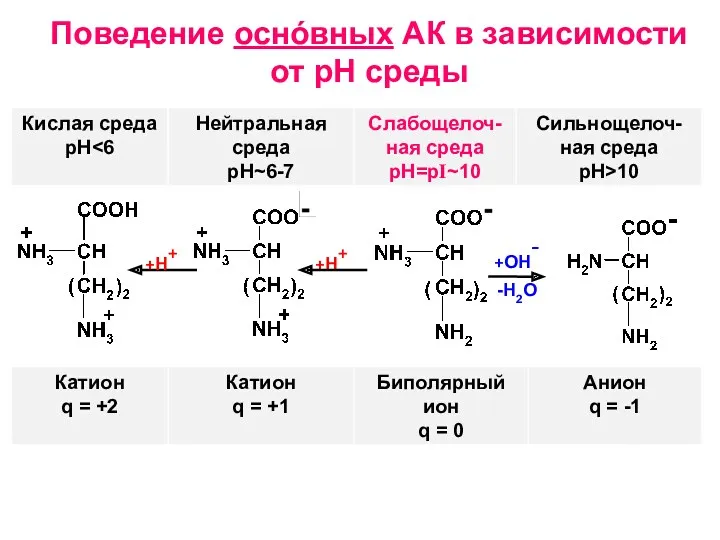
- 13. Поведение оснóвных АК в зависимости от рН среды +Н+ +ОН - +Н+ -H2O
- 14. Химические свойства АК 1. in vitro а) реакции по NH2-группе: с кислотами; с галогеналканами (алкилирование); с
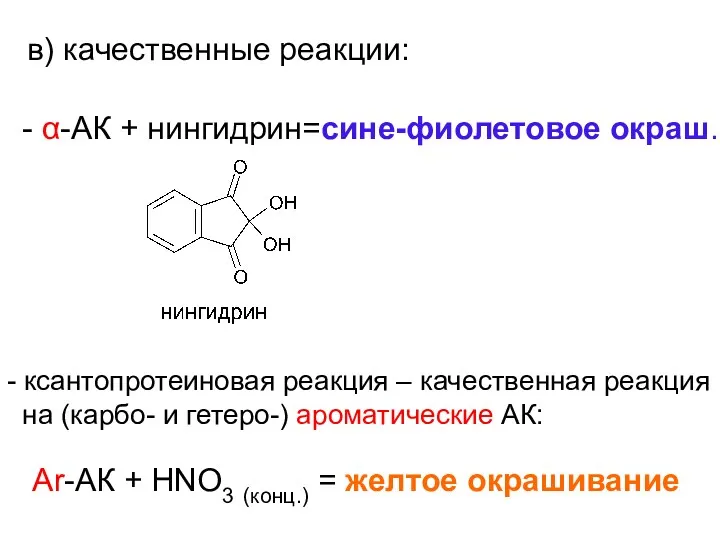
- 15. в) качественные реакции: - α-АК + нингидрин=сине-фиолетовое окраш. - ксантопротеиновая реакция – качественная реакция на (карбо-
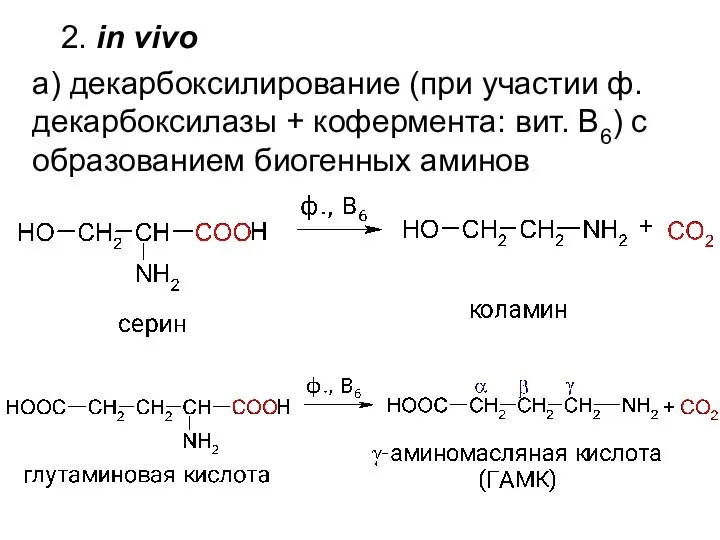
- 16. 2. in vivo а) декарбоксилирование (при участии ф. декарбоксилазы + кофермента: вит. В6) с образованием биогенных
- 17. б) трансаминирование (переаминирование) – взаимное превращение амино- и кетокислот. 1) аланин + ЩУК ↔ ПВК +
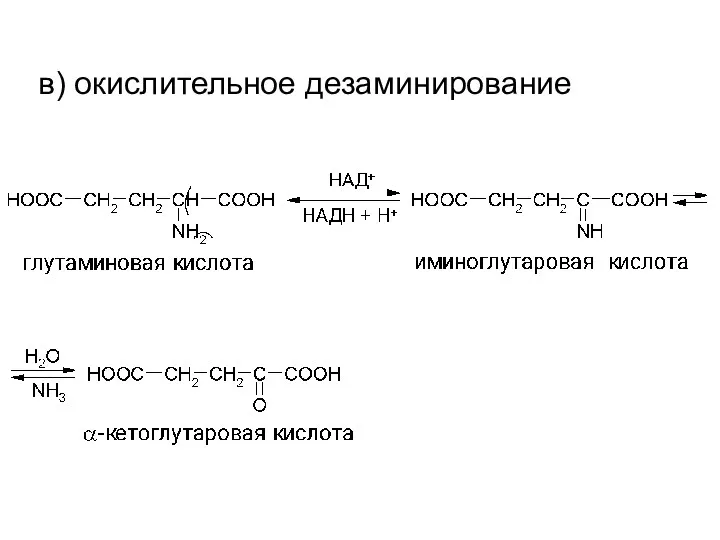
- 18. в) окислительное дезаминирование
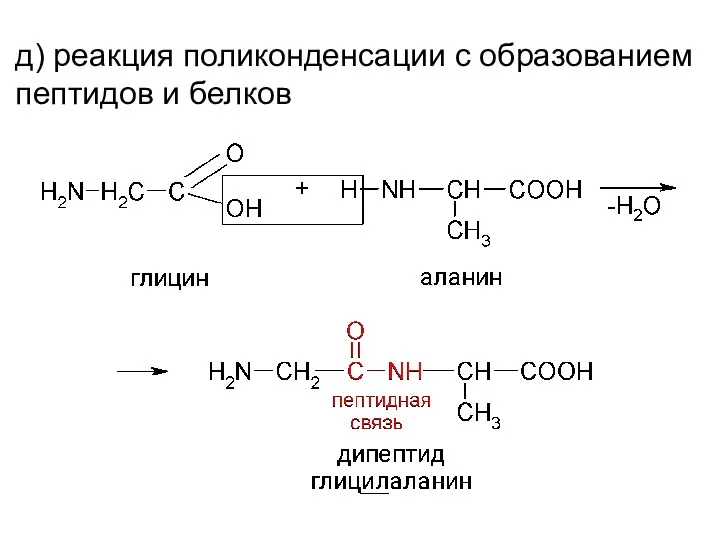
- 19. д) реакция поликонденсации с образованием пептидов и белков
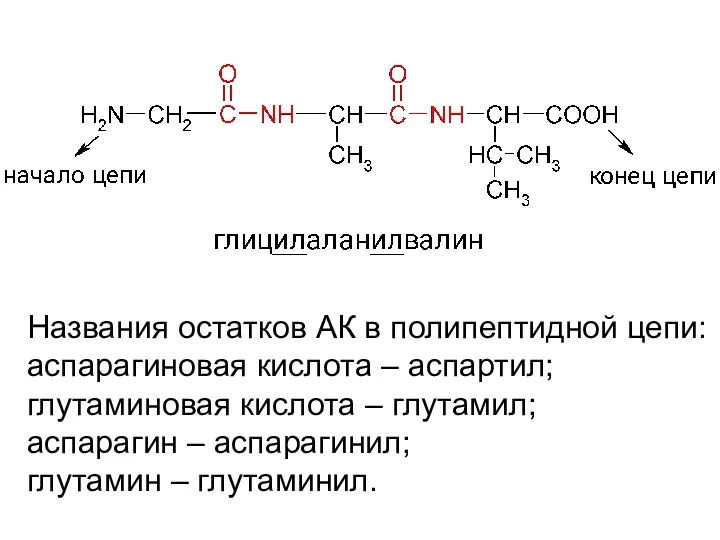
- 20. Названия остатков АК в полипептидной цепи: аспарагиновая кислота – аспартил; глутаминовая кислота – глутамил; аспарагин –
- 21. Биологическое значение АК -Участвуют в биосинтезе белков, гормонов (адреналина, тироксина), азотистых оснований НК, медиаторов, нейромедиаторов, глюкозы
- 22. ПЕПТИДЫ. БЕЛКИ - природные полимеры, состоящие из большого числа аминокислотных остатков. Пептиды, содержащие > 100 аминокислотных
- 23. Классификация белков В зависимости от химического состава: простые белки (только из остатков α-АК) и сложные белки
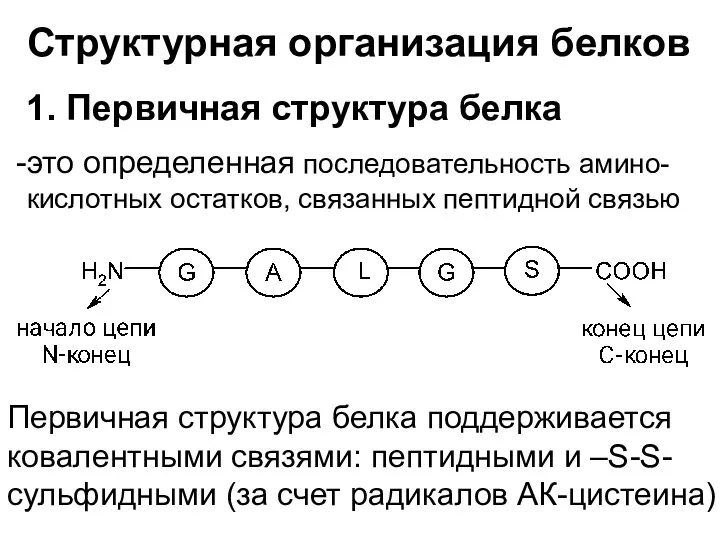
- 24. Структурная организация белков 1. Первичная структура белка это определенная последовательность амино- кислотных остатков, связанных пептидной связью
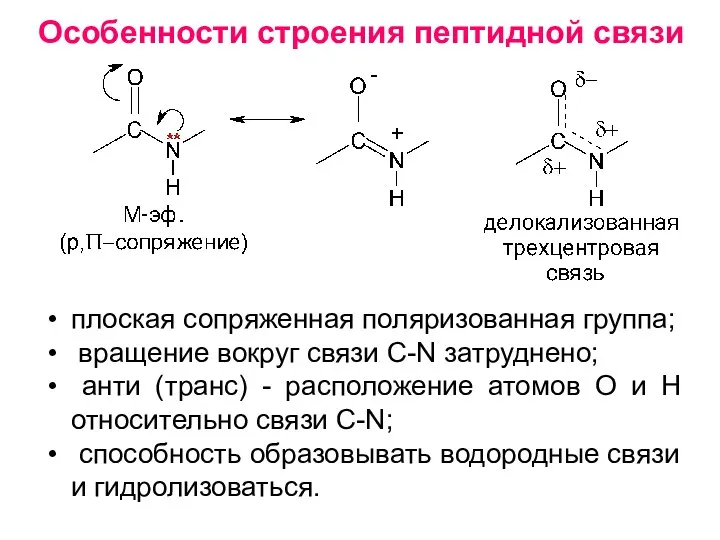
- 25. Особенности строения пептидной связи плоская сопряженная поляризованная группа; вращение вокруг связи C-N затруднено; анти (транс) -
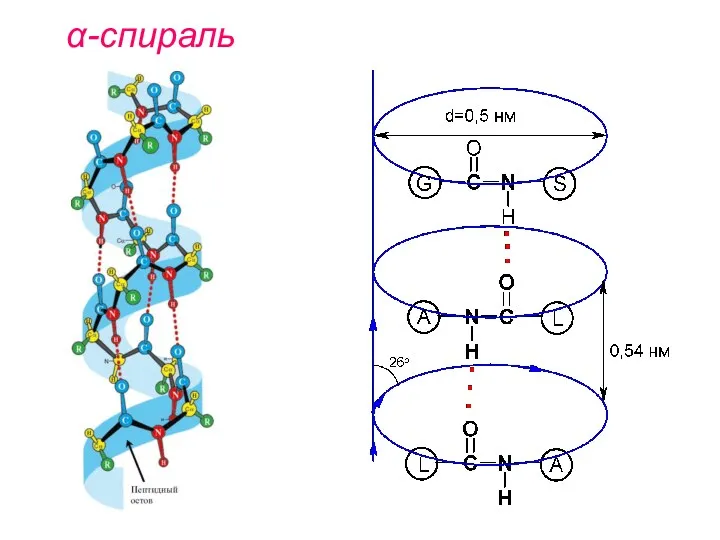
- 26. 2. Вторичная структура белка α-спираль это форма различных участков полипеп- тидной цепи в пространстве закручивание полипептидной
- 27. α-спираль
- 28. β-слои (β-складчатый лист) - полипептидные цепи, расположенные ǁ др. др. и связанные водородными связями между атомами
- 29. 3. Третичная структура белка определенное пространственное располо- жение элементов вторичной структуры белка. Глобулярная третичная структура –
- 30. В формировании третичной структуры белка участвуют следующие связи: водородные (между функциональными группами боковых R или между
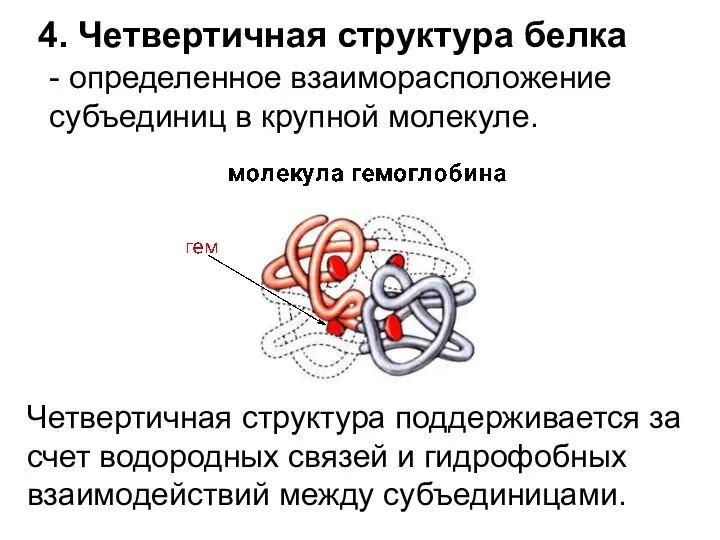
- 31. 4. Четвертичная структура белка - определенное взаиморасположение субъединиц в крупной молекуле. Четвертичная структура поддерживается за счет
- 32. Кислотно-основные свойства белков Белки – амфотерные соединения Белки можно разделить на: - нейтральные (-NH2 = -COOH)
- 33. При pH в катионной форме и под действием постоянного эл. тока будет двигаться к катоду. При
- 34. На этом свойстве белков основан метод электрофореза. Электрофорез – направленное движение белков от одного электрода к
- 35. Химические свойства белков 1. Денатурация – разрушение четв., трет., вторич. структуры белка с сохранением первичной. Происходит
- 36. 2. Качественные реакции белков а) Биуретовая реакция – на обнаружение пептидных связей Белок + СuSO4 +
- 38. Скачать презентацию






















 Вирощування кристалів в додомашніх умовах
Вирощування кристалів в додомашніх умовах Чистые вещества и смеси
Чистые вещества и смеси Кристалічні та аморфні тіла. Рідкі кристали та їх властивості
Кристалічні та аморфні тіла. Рідкі кристали та їх властивості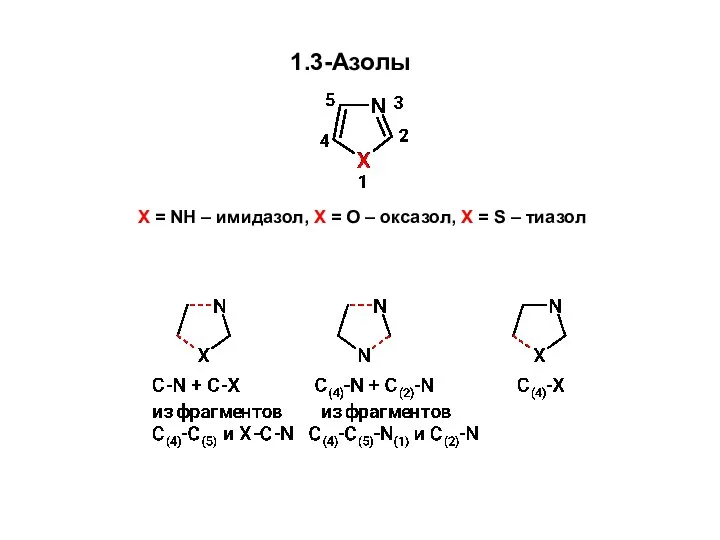 Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N
Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N Аммиак. Соли аммония
Аммиак. Соли аммония Выращивание кристаллов медного купороса в домашних условиях
Выращивание кристаллов медного купороса в домашних условиях Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Автомобильные масла. Классификация и применение автомобильных масел
Автомобильные масла. Классификация и применение автомобильных масел Нітрати – токсичні речовини
Нітрати – токсичні речовини Исследование модифицирования на структуру и жидкотекучесть сплава АК12
Исследование модифицирования на структуру и жидкотекучесть сплава АК12 Распространение пламени в газах
Распространение пламени в газах Химические свойства металлов
Химические свойства металлов Виды химической связи
Виды химической связи Сплавы, растворы и смеси. Задачи на концентрвцию
Сплавы, растворы и смеси. Задачи на концентрвцию Stirring in liquid media
Stirring in liquid media Строение атома
Строение атома Бензол. Чикишев С. (2)
Бензол. Чикишев С. (2) Непредельные углеводороды. Этиленовые углеводороды (алкены)
Непредельные углеводороды. Этиленовые углеводороды (алкены) Изучение свойств горных пород, минералов и полезных ископаемых
Изучение свойств горных пород, минералов и полезных ископаемых Аминокислоты, их строение, изомерия, свойства, применение
Аминокислоты, их строение, изомерия, свойства, применение Углерод и его оксиды
Углерод и его оксиды Гидроксиды. Основания: способы получения
Гидроксиды. Основания: способы получения Многообразие карбоновых кислот
Многообразие карбоновых кислот Механизмы органических реакций
Механизмы органических реакций Изменения, происходящие с липидами в процессах технологической переработки сырья и параметры, характеризующие их
Изменения, происходящие с липидами в процессах технологической переработки сырья и параметры, характеризующие их Азот и его соединения
Азот и его соединения Введение в общеобразовательную научную дисциплину Химия
Введение в общеобразовательную научную дисциплину Химия 20230419_azot
20230419_azot