Содержание
- 2. Предмет и значимость изучаемой темы Термодинамика — наука, изучающая связи между превращениями вещества и превращениями энергии.
- 3. Предмет и значимость изучаемой темы Термодинамика — наука, изучающая связи между превращениями вещества и превращениями энергии.
- 4. Знание химической термодинамики позволяет: - предсказать условия устойчивости веществ в заданных условиях и возможность их взаимодействия;
- 5. ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Объект изучения - макроскопические системы, состоящие из очень большого числа
- 6. Функции состояния (т/д потенциалы) Т/д состояние системы описывается функциями состояния, которые определяются через параметры состояния P,Т,V.
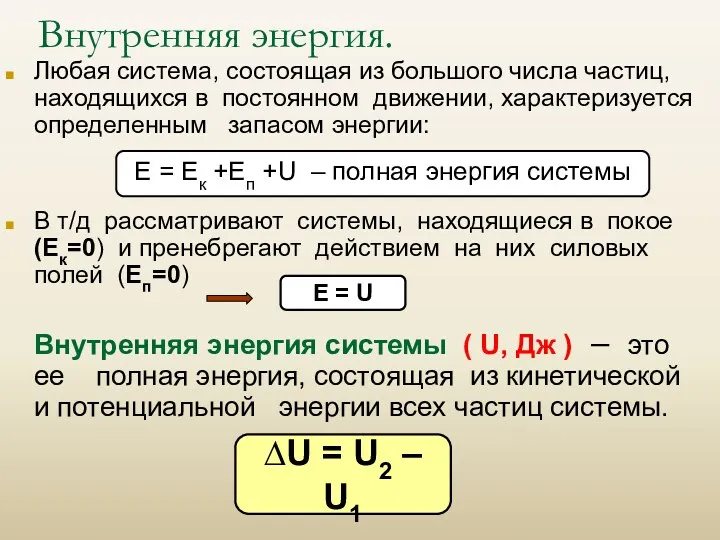
- 7. Внутренняя энергия. Любая система, состоящая из большого числа частиц, находящихся в постоянном движении, характеризуется определенным запасом
- 8. Теплота. Работа. Изменение внутренней энергии может происходить за счет обмена энергией между системами или системой и
- 9. Первый закон термодинамики Q = ∆U + A – Теплота, подведенная к системе, расходуется на увеличение
- 10. Q = ∆U + A, где A = p∆V + Amax, отсюда: Q = ∆U +
- 11. Применение I закона т/д к различным процессам 1. Изохорные процессы: V=const, Р∆V=0 Qv = ∆U (3)
- 12. Физический смысл энтальпии: полная энергия расширенной системы в изобарно-изотермических условиях: ∆Н = ∆U + Р∆V. *
- 13. * Стандартная энтальпия образования соединения (∆H°f,298) – энтальпия реакции образования 1 моля этого соединения в стандартных
- 14. ОСНОВНЫЕ ЗАКОНЫ ТЕРМОХИМИИ Для расчета ΔН химической реакции используются основные законы термохимии: Закон Лавуазье – Лапласа:
- 15. Расчет ΔН химической реакции * Закон Гесса: тепловой эффект реакции не зависит от пути процесса, а
- 16. АЛГОРИТМ РЕШЕНИЯ ЗАДАЧИ С ИСПОЛЬЗОВАНИЕМ ЗАКОНА ГЕССА При проведении расчетов на основании закона Гесса нужно поступать
- 17. *Для расчета теплового эффекта при любой заданной температуре используется уравнение Кирхгофа: (6) где C°p – молярная
- 18. II закон т/д — определяет направленность превращения энергии: Теплота не может самопроизвольно переходить от менее нагретого
- 19. Естественные процессы развиваются необратимо в направлении увеличения беспорядка (Больцман) – уравнение Больцмана (9) k – постоянная
- 20. III закон т/д Энтропия как характеристика индивидуальных веществ абсолютна. Для определения энтропии есть начало отсчета –
- 21. Стандартная энтропия вещества (S°298 ) – это энтропия 1 моля вещества в его стандартном состоянии при
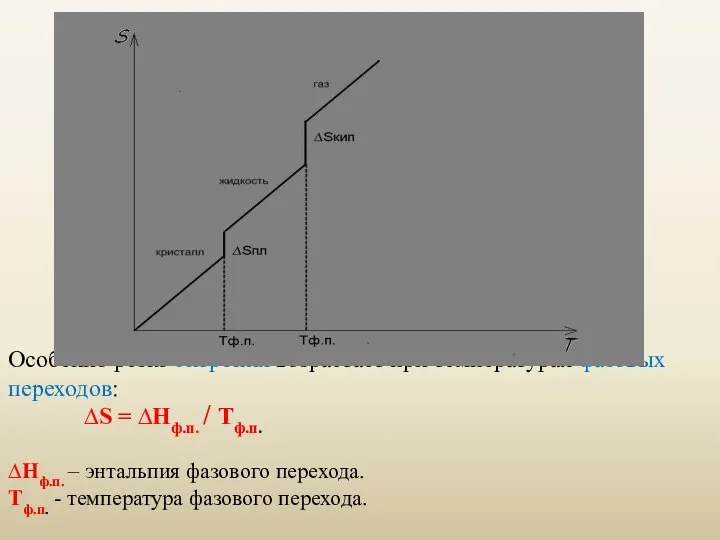
- 22. Особенно резко энтропия возрастает при температурах фазовых переходов: ∆S = ∆Hф.п. / Tф.п. ∆Hф.п. – энтальпия
- 23. Расчет ΔS химической реакции Стандартные условия: ∆S°298 = ∑n'S°298 (прод) - ∑n''S°298 (исх) (10) При заданной
- 24. Факторы, определяющие направленность процесса Направление, в котором самопроизвольно протекает хи-мическая реакция, определяется совместным действием 2-х факторов:
- 25. Джозайя Уиллард Гиббс - американский физик и математик. В 1874–1878 Гиббс опубликовал трактат «О равновесии гетерогенных
- 26. Вывод основного уравнения т/д: I з-н: Q=∆U+p∆V+Amax II з-н: Q = T∆S Функция ( H –
- 27. Критерий самопроизвольного проте-кания любого процесса ∆G или ∆H –T∆S Любая химическая реакция протекает самопроизвольно в направлении,
- 28. Направленность самопроизвольных процессов Неравенства ∆G Для реального осуществления необходимо выполнение не только т/д условий, но и
- 29. РАСЧЕТ ∆G В ХОДЕ РЕАКЦИИ 1. Стандартные условия: ◘ ∆G°298 = ∆H°298 – 298 ·∆S°298 (15)
- 30. Примечание: для ответа на вопрос о т/д возможности процесса и его направлении необходимо рассчитать численное значение
- 31. ТЕРМОДИНАМИЧЕСКОЕ УСЛОВИЕ РАВНОВЕСИЯ Пределом убыли свободной энергии Гиббса при само-произвольном протекании процесса является её мини-мальное значение,
- 32. Пренебрегая зависимостью ΔН и ΔS от температуры можно приближенно определить температуру наступления равновесия : (19)
- 33. СВЯЗЬ МЕЖДУ ∆G и KP Взаимосвязь между константой равновесия и изобарным потенциалом выражается уравнением изотермы химической
- 34. СВЯЗЬ МЕЖДУ ∆Н и KP Взаимосвязь этих величин устанавливает уравнение изобары: dlnKp / dТ = ∆H
- 35. УРАВНЕНИЕ ИЗОБАРЫ Чтобы определить изменение Kp при изменении температуры на конечную величину, уравнение (21) интегрируют в
- 38. Скачать презентацию

































 Металлы, их свойства и область применения
Металлы, их свойства и область применения Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Тяжелые металлы
Тяжелые металлы Гидрокси(окси) кислоты
Гидрокси(окси) кислоты Значение пищи и ее состав
Значение пищи и ее состав Коррозия металлов
Коррозия металлов Изучение процесса коррозии железа (домашний эксперимент)
Изучение процесса коррозии железа (домашний эксперимент) Борьба с биологической коррозией
Борьба с биологической коррозией Реакции ионного обмена
Реакции ионного обмена Спирты
Спирты Газовые смеси
Газовые смеси Химический элемент, минерал, горная порода. (Лекция 6)
Химический элемент, минерал, горная порода. (Лекция 6) Титриметрический анализ. Кривые титрования
Титриметрический анализ. Кривые титрования Адсорбция
Адсорбция Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Химические реакции или химические явления
Химические реакции или химические явления Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение
Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение Хром, марганец
Хром, марганец Химическая кинетика и катализ
Химическая кинетика и катализ Свойства фосфора
Свойства фосфора Общие сведения о полезных ископаемых. (Лекция 2)
Общие сведения о полезных ископаемых. (Лекция 2) Тұндыру әдістері
Тұндыру әдістері Термодинамика химических процессов
Термодинамика химических процессов Чистые вещества и смеси. Химия. 8 кл
Чистые вещества и смеси. Химия. 8 кл Обед под микроскопом. Минеральные вещества
Обед под микроскопом. Минеральные вещества Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды Реакции солей в растворе. Гидролиз солей. Водородный показатель рН
Реакции солей в растворе. Гидролиз солей. Водородный показатель рН