Содержание
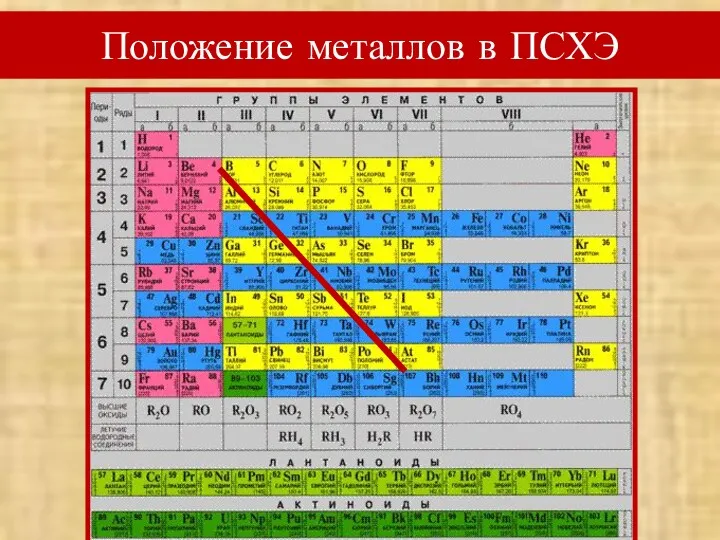
- 2. Положение металлов в ПСХЭ
- 3. Электрохимический ряд напряжений металлов Атомы металлов – ……………. электроны с внешнего энергетического уровня, поэтому являются ………………………..
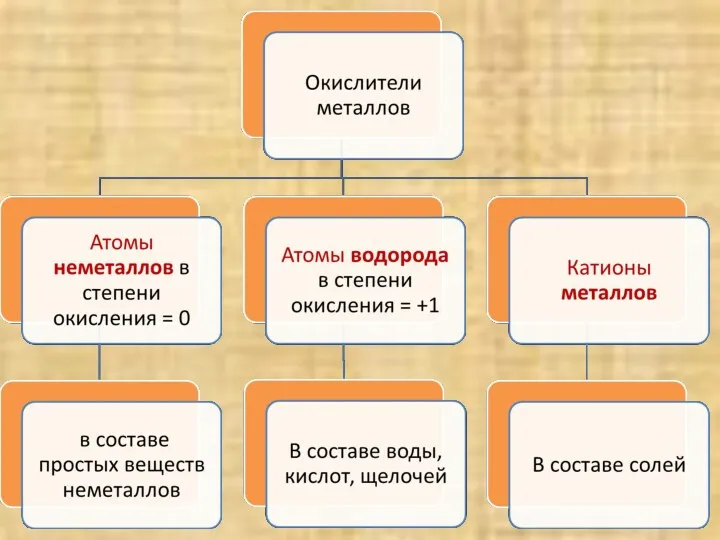
- 4. Атомы металлов – восстановители, а катионы металлов? Катионы металлов принимают электроны, и являются окислителями
- 6. Металлы взаимодействуют С неметаллами с образованием бинарных соединений (оксидов, гидридов, сульфидов, галогенидов и др.) С водой
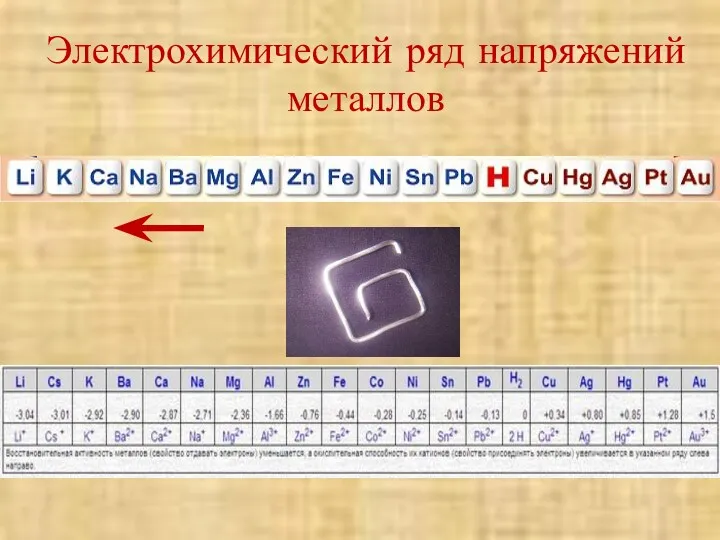
- 7. Электрохимический ряд напряжений металлов
- 8. 4 правила ЭХРНМ 1. Чем левее стоит металл в ЭХРНМ тем более сильным восстановителем он является
- 9. Металлы после водорода… Взаимодействие с концентрированной серной кислотой при нагревании Cu + 2H2SO4 = CuSO4 +
- 10. Металлы после водорода… Взаимодействие с концентрированной и разбавленной азотной кислотой. Опыт - 4 Cu + 4HNO3
- 11. Металлы после водорода… 3. Взаимодействие золота с «царской водкой» Au + HNO3 + 4HCl = H[AuCl4]
- 12. Подведем черту… Металл + кислород = оксид металла Металл + хлор = хлорид металла Металл +
- 14. Скачать презентацию








 Методы анализа. Классификация методов анализа
Методы анализа. Классификация методов анализа Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов
Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов Азотсодержащие соединения
Азотсодержащие соединения Химическая связь
Химическая связь Основания и их свойства
Основания и их свойства Степень окисления химических элементов
Степень окисления химических элементов Теории происхождения нефти
Теории происхождения нефти Металлы применяемые в строительстве
Металлы применяемые в строительстве Защита металлов от коррозии
Защита металлов от коррозии Номенклатура органических соединений. Алканы
Номенклатура органических соединений. Алканы Протолитические равновесия в растворах электролитах
Протолитические равновесия в растворах электролитах 20230410_prilozhenie_1
20230410_prilozhenie_1 Типичные реакции органических соединений
Типичные реакции органических соединений Аминокислоты
Аминокислоты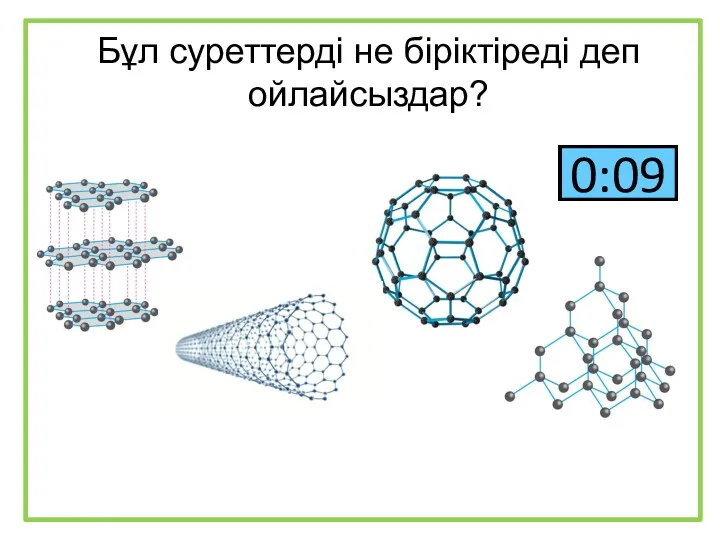 Бұл суреттерді не біріктіреді деп ойлайсыздар?
Бұл суреттерді не біріктіреді деп ойлайсыздар? Важнейшие оксиды в природе и жизни человека
Важнейшие оксиды в природе и жизни человека Классификация веществ в зависимости от типа химической связи
Классификация веществ в зависимости от типа химической связи Фенолы
Фенолы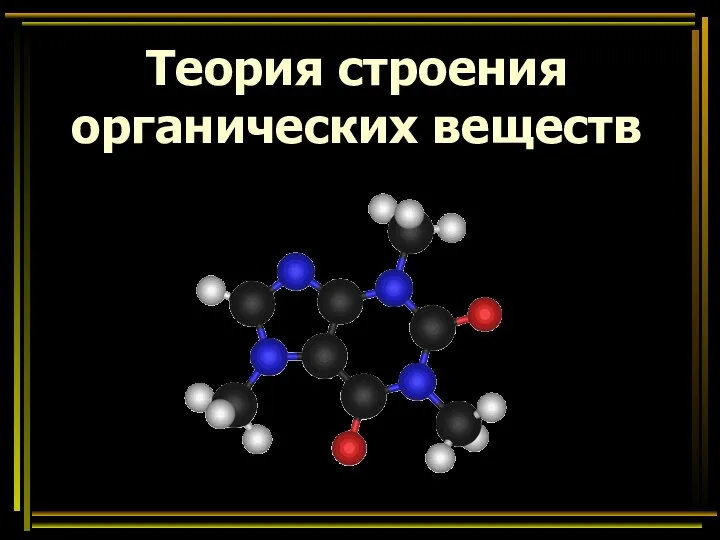 Теория строения органических веществ. Предельные углеводороды. 9 класс
Теория строения органических веществ. Предельные углеводороды. 9 класс Введение в аналитическую химию. Введение в качественный анализ
Введение в аналитическую химию. Введение в качественный анализ Чистые вещества и смеси. Растворы
Чистые вещества и смеси. Растворы Методы определения физико-химических условий минерало-и рудообразования
Методы определения физико-химических условий минерало-и рудообразования Ароматические соединения
Ароматические соединения Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Физико-химические свойства органических веществ. Номенклатура, изомерия, задачи
Физико-химические свойства органических веществ. Номенклатура, изомерия, задачи Алкины. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция №4
Алкины. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция №4 Основні класи неорганічних сполук
Основні класи неорганічних сполук Генетическая связь между классами веществ
Генетическая связь между классами веществ