Содержание
- 2. Основания это сложные вещества, состоящие из ионов металлов и гидроксильных групп (-ОН). Me(OH)n n - число
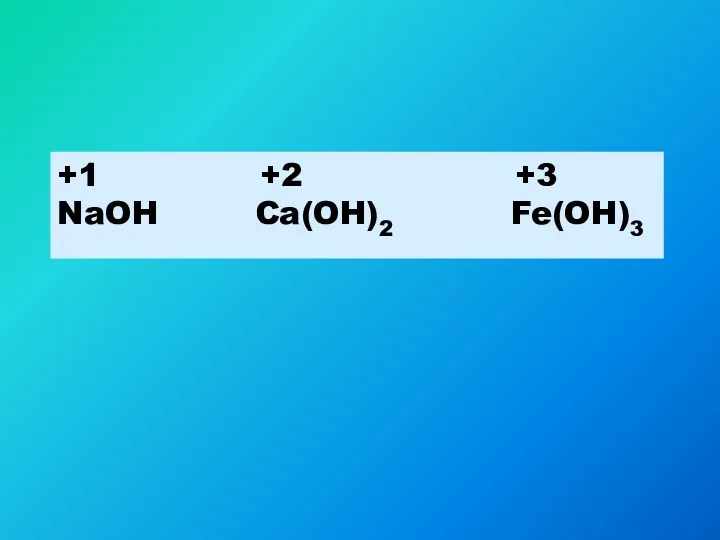
- 3. +1 +2 +3 NaOH Ca(OH)2 Fe(OH)3
- 4. Названия оснований NaОН Ca(OH)2 Fe(OH)3 гидроксид гидроксид гидроксид натрия кальция железа (III)
- 5. Тривиальные названия КОН NaOH Ca(OH)2 едкое кали едкий натр гашеная известь, в растворе - известковая вода
- 6. Основаниям соответствуют оксиды металлов в той же степени окисления. Например: NaOH – Na2O Ca(OH)2 – CaO
- 7. Классификация оснований
- 8. Физические свойства оснований Ba(OH)2 Co(OH)2 NaOH Ca(OH)2 LiOH Cu(OH)2 Основания - твердые вещества, различной растворимости в
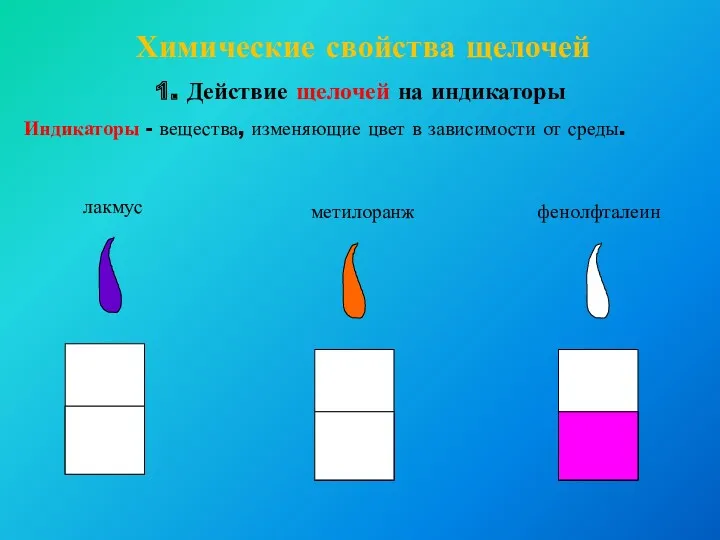
- 9. Химические свойства щелочей 1. Действие щелочей на индикаторы лакмус метилоранж фенолфталеин Индикаторы - вещества, изменяющие цвет
- 10. Диссоциация оснований. NaOH ↔ Na+ + OH- 2) Ba(OH)2 ↔ Ba2+ + 2OH- OH- определяют щелочную
- 11. 2. Взаимодействие с кислотами. NaOH + HCl = NaCl + H2O реакция нейтрализации - взаимодействие щелочей
- 12. 3. Взаимодействие щелочей с кислотными оксидами. 2NaOH + SO3 = Na2SO4 + H2O Ca(OH)2 + CO2
- 13. 3. Разложение нерастворимых оснований при нагревании. Cu(OH)2 = CuO + H2O t
- 14. Качественная реакция на СО2 - известковая вода мутнеет при пропускании углекислого газа: Са(ОН)2 + СО2 =
- 16. Скачать презентацию











 Металдардыњ механикалыќ ќасиеттері-алюминий
Металдардыњ механикалыќ ќасиеттері-алюминий Алкины. Химические свойства и способы получения алкинов
Алкины. Химические свойства и способы получения алкинов Гидролиз неорганических солей
Гидролиз неорганических солей Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов
Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов Классификация химических реакций по различным основаниям. 9 класс
Классификация химических реакций по различным основаниям. 9 класс Тұндыру әдістері
Тұндыру әдістері Алюминий и его соединения
Алюминий и его соединения Валентные состояния атома углерода
Валентные состояния атома углерода Моющие средства
Моющие средства Способи очищення води
Способи очищення води Кислород как элемент
Кислород как элемент Реакционная способность твердых тел и способы ее регулирования
Реакционная способность твердых тел и способы ее регулирования Карбоновые кислоты. Строение
Карбоновые кислоты. Строение Химический элемент. Электронное строение атома
Химический элемент. Электронное строение атома Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Химия в строительстве
Химия в строительстве Муравьиная кислота
Муравьиная кислота Взаимное влияние атомов в молекулах. Шкалы электроотрицательности
Взаимное влияние атомов в молекулах. Шкалы электроотрицательности Технологии получения полимерных нанокомпозитов
Технологии получения полимерных нанокомпозитов Ферменттер. Зерттелу тарихы
Ферменттер. Зерттелу тарихы Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы
Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы Электрохимическая коррозия
Электрохимическая коррозия Лекция как один из методов обучения химии на старшей ступени общего образования. Методика ее подготовки и чтения
Лекция как один из методов обучения химии на старшей ступени общего образования. Методика ее подготовки и чтения Радиогеохимия метаморфических процессов
Радиогеохимия метаморфических процессов Сучасні каталізатори у процесах нафтопереробки та нафтохімії
Сучасні каталізатори у процесах нафтопереробки та нафтохімії Биологически важные вещества жиры
Биологически важные вещества жиры Периодический закон и периодическая система Д.И. Менделеева. 9 класс
Периодический закон и периодическая система Д.И. Менделеева. 9 класс Коррозия и защита полимерных строительных материалов
Коррозия и защита полимерных строительных материалов