Содержание
- 2. Строение Карбоновые кислоты – это вещества, содержащие в молекуле одну или несколько карбоксильных групп. Карбоксильная группа
- 3. Органические кислоты, содержащие в молекуле одну карбоксильную группу, являются одноосновными. Общая формула этих кислот RCOOH. Карбоновые
- 4. В зависимости от природы углеводородного радикала карбоновые кислоты делятся на предельные, непредельные, ароматические. Предельные (или насыщенные)
- 5. Номенклатура и изомерия Название карбоновой кислоты образуется от названия соответствующего алкана с добавлением суффикса –ов, окончания
- 6. Физические свойства предельных одноосновных карбоновых кислот Низшие кислоты, содержащие в молекуле до 4 атомов углерода –
- 7. Молекулы предельных одноосновных карбоновых кислот содержат полярную группу атомов – карбоксил и практически неполярный углеводородный радикал.
- 8. Химические свойства Диссоциация с образованием катионов водорода и анионов кислотного остатка: CH3 – COOH CH3 –
- 9. Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров – реакция этерификации: CH3 – C –
- 10. Взаимодействие с основными оксидами: 2RCOOH + СаО = (RCOO)2Ca + Н2О Окисление муравьиной кислоты (эта реакция
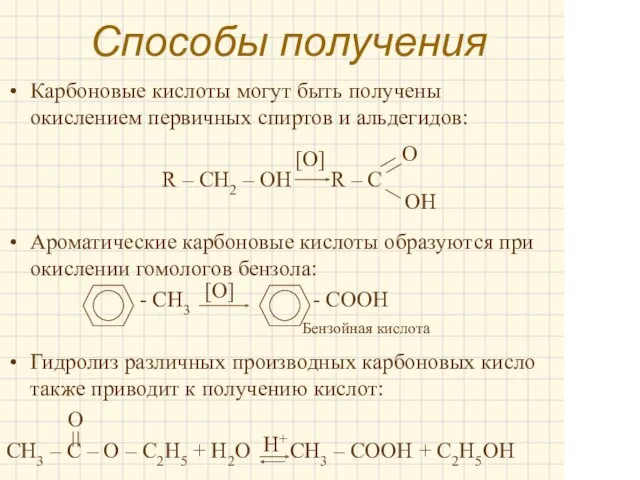
- 11. Способы получения Карбоновые кислоты могут быть получены окислением первичных спиртов и альдегидов: R – CH2 –
- 12. Применение Муравьиная кислота обладает дезинфицирующим свойством и поэтому находит свое применение в пищевой, кожевенной и фармацевтической
- 13. Уксусная кислота – хороший растворитель многих органических веществ. Используется при крашении, в кожевенном производстве, в лакокрасочной
- 15. Скачать презентацию











 Теория сильных и слабых электролитов
Теория сильных и слабых электролитов Соединения серы
Соединения серы Установление точной концентрации раствора щелочи по титрованному раствору соляной кислоты. (Лабораторная работа 1)
Установление точной концентрации раствора щелочи по титрованному раствору соляной кислоты. (Лабораторная работа 1) Практична робота 3 Самедова Софія (1)
Практична робота 3 Самедова Софія (1) Летучие яды
Летучие яды Природный каучук
Природный каучук Простые вещества - неметаллы. 8 класс
Простые вещества - неметаллы. 8 класс Полімери. Природні полімери
Полімери. Природні полімери Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ Полиамидные волокна
Полиамидные волокна Синтетические органические вещества
Синтетические органические вещества Теория электролитической диссоциации
Теория электролитической диссоциации Приборы и методы исследования в химической технологии
Приборы и методы исследования в химической технологии Степень диссоциации. 9 класс
Степень диссоциации. 9 класс Классы неорганических соединений
Классы неорганических соединений Углеводородное топливо, его виды и назначения
Углеводородное топливо, его виды и назначения Предмет органической химии
Предмет органической химии Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г
Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г Алкены. Химические свойства алкенов
Алкены. Химические свойства алкенов Хімічні властивості кислот
Хімічні властивості кислот Состав, свойства, виды и способы получения дегтей
Состав, свойства, виды и способы получения дегтей Анализ и синтез химических веществ
Анализ и синтез химических веществ Химическая технология ситаллов и композитов. Прессование
Химическая технология ситаллов и композитов. Прессование Общая характеристика физико-химических методов анализа лекарственных веществ
Общая характеристика физико-химических методов анализа лекарственных веществ Коллигативные свойства растворов неэлектролитов
Коллигативные свойства растворов неэлектролитов Алкены. Пропилен C₃H₆
Алкены. Пропилен C₃H₆ Металлы и их свойства. Способы получения
Металлы и их свойства. Способы получения Химическая термодинамика
Химическая термодинамика