Содержание
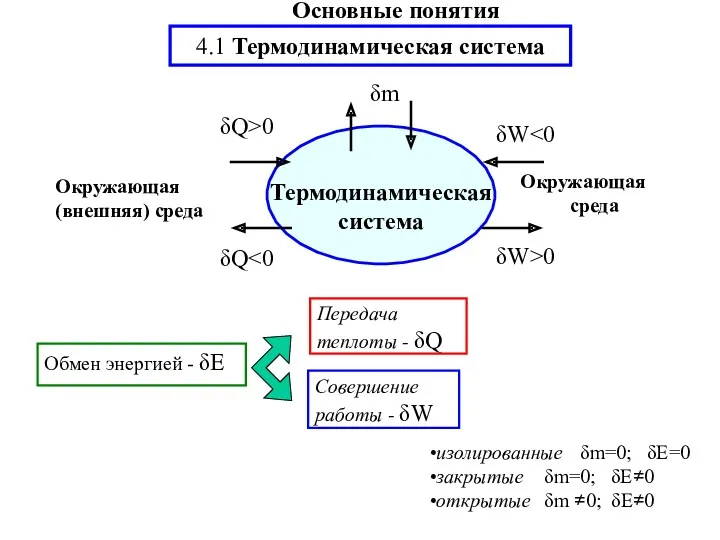
- 2. Передача теплоты - δQ Совершение работы - δW изолированные δm=0; δE=0 закрытые δm=0; δE≠0 открытые δm
- 3. Фаза: совокупность частей системы с одинаковыми физико- химическими свойствами. Отделена от другой фазы поверхностью раздела(граница раздела
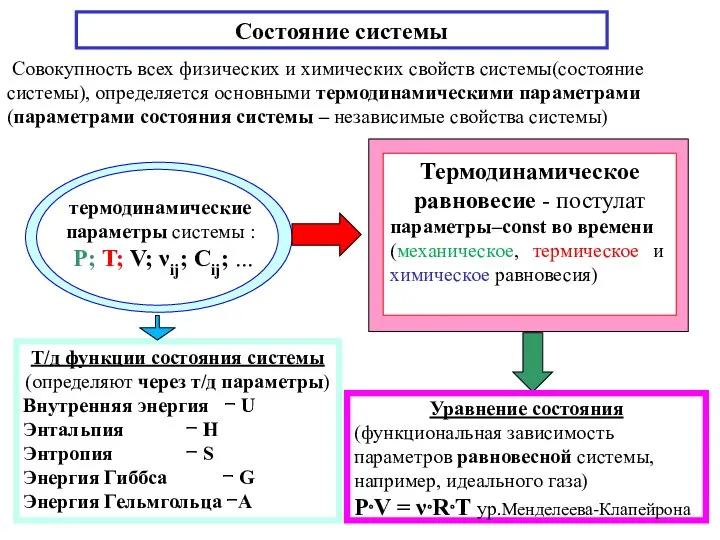
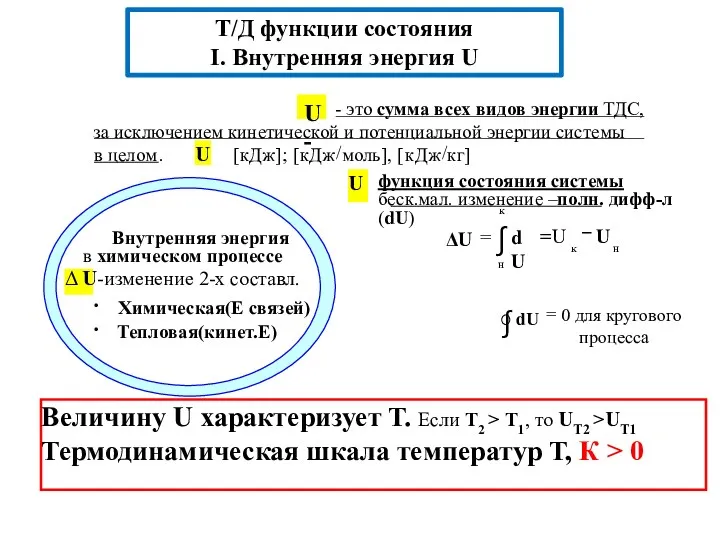
- 4. Т/д функции состояния системы (определяют через т/д параметры) Внутренняя энергия − U Энтальпия − H Энтропия
- 5. 4.2 Термодинамический процесс (изменяется хотя бы один из параметров равновесной системы)
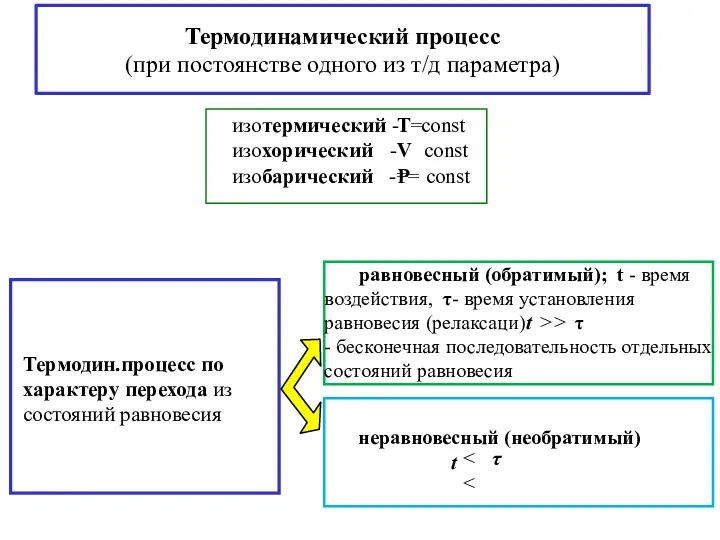
- 6. Термодинамический процесс (при постоянстве одного из т/д параметра)
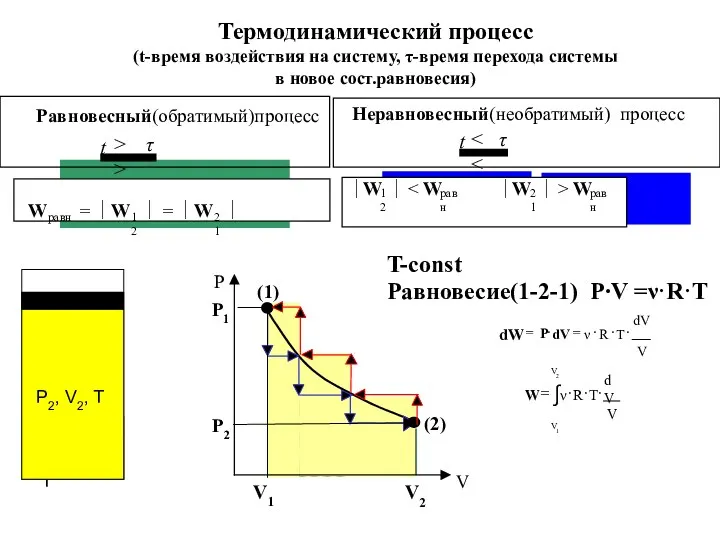
- 7. T-const Термодинамический процесс (t-время воздействия на систему, τ-время перехода системы в новое сост.равновесия) Равновесие(1-2-1) P∙V =ν·R·T
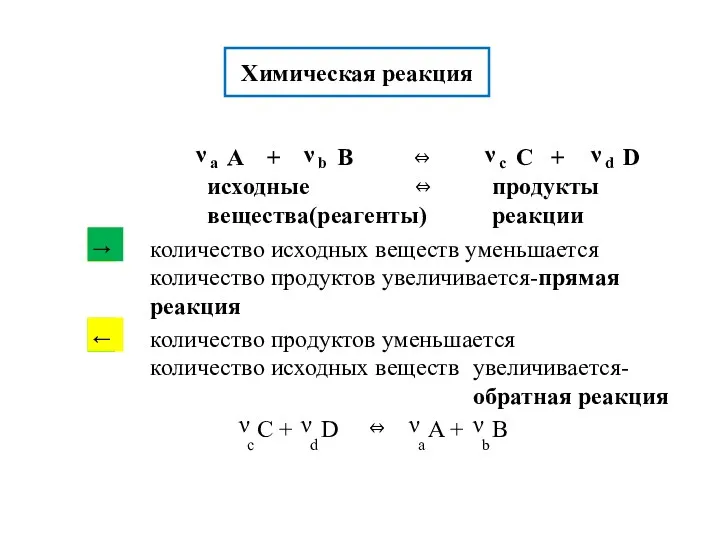
- 8. Химическая реакция
- 9. Теплота (Δ Q), сообщенная термодинамической системе, идет на увеличение внутренней энергии (Δ U) системы и на
- 10. Величину U характеризует Т. Если Т2 > Т1, то UТ2 >UТ1 Термодинамическая шкала температур Т, К
- 11. II. Энтальпия (теплосодержание системы)
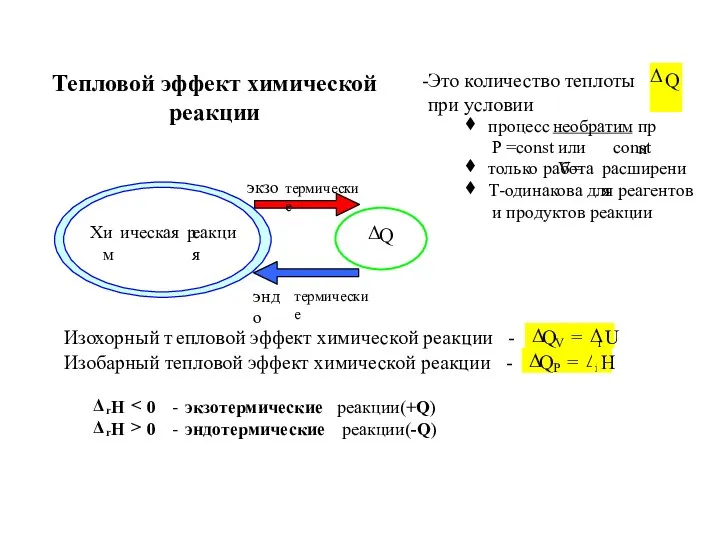
- 12. Тепловой эффект химической реакции
- 13. Закон Гесса «тепловой эффект реакции зависит только от вида и состояния исходных веществ и конечных продуктов
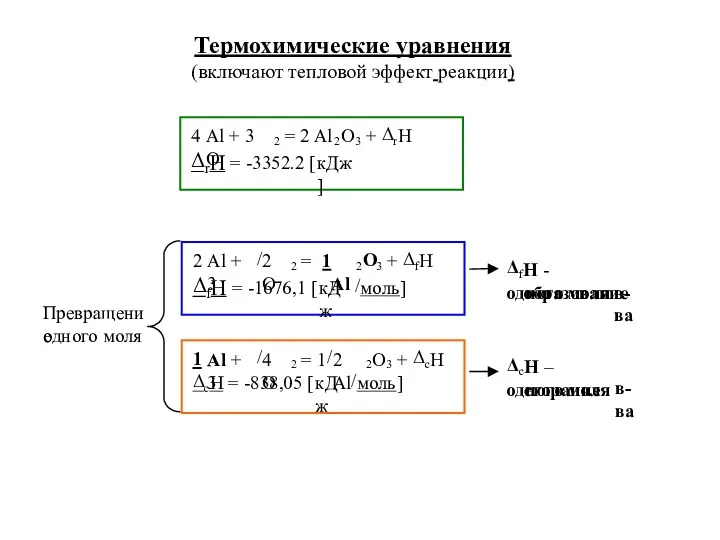
- 14. Термохимические уравнения (включают тепловой эффект реакции)
- 15. Стандартные условия: Р0 = 1,013⋅105 Па Т0 = 298,15 К С0 = 1моль/л ΔrН0298 стандартная энтальпия(тепловой
- 16. Следствие из закона Гесса: ΔrН0298 = (∑ νiΔfН0i)продукты – (∑ νiΔfН0i)исходные вещества Пример. реакция : CH4
- 17. Зависимость теплового эффекта реакции от температуры
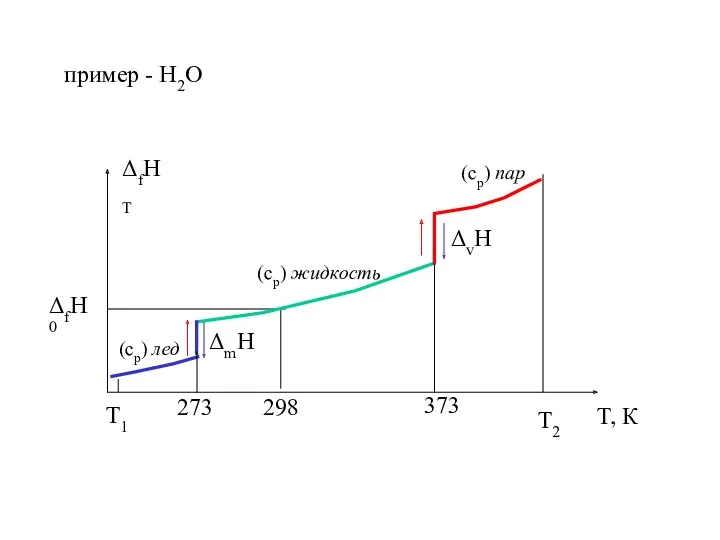
- 18. пример - Н2О T2 T1
- 19. Второе начало термодинамики dU + p⋅dV -T⋅dS ≤ 0 - 1-ое начало, dU=dV=0 → TdS≥0 →
- 20. III. Энтропия и т/д вероятность W1= 1 W2= 4 W3= 6 W4= 4 W5= 1 I
- 21. S = k⋅lnW k = 1,38⋅10-23Дж/К – константа Больцмана (k = R/NА) W – термодинамическая вероятность
- 22. В изолированной системе самопроизвольно будут протекать процессы с увеличением термодинамической вероятности, а состояние равновесия соответствует состоянию
- 23. S [Дж/К] стандартная - S0298 [Дж/моль⋅К] Факторы влияющие на величину энтропии
- 24. IV. Энергия Гиббса. Направление химического процесса
- 25. Энергия Гиббса реакции Стандартная энергия Гиббса (образования) вещества ΔG0298 ΔrG0298 = (∑ νi⋅ΔfG0i)продукты – (∑ νi⋅ΔfG0i)исходные
- 26. Температурная зависимость ΔrG Направление протекания химической реакции
- 27. Энергия Гиббса реакции в нестандартных условиях С ≠С0 ΔrGi =ΔrG0i + R⋅T⋅lnCi ΔrG = (νc⋅ΔfG0C+ νd⋅ΔfG0D
- 28. 4.7 Равновесие
- 30. Скачать презентацию












![S [Дж/К] стандартная - S0298 [Дж/моль⋅К] Факторы влияющие на величину энтропии](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/409302/slide-22.jpg)





 Химия в жизни общества
Химия в жизни общества Organic molecules
Organic molecules Первичная переработка нефти
Первичная переработка нефти Состав газированной воды
Состав газированной воды Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома
Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома Галогены (солеобразующие)
Галогены (солеобразующие) Склад та властивості основних класів неорганічних сполук
Склад та властивості основних класів неорганічних сполук Научно-исследовательская работа Вся правда о продуктах с сахарозаменителями
Научно-исследовательская работа Вся правда о продуктах с сахарозаменителями Катионы 1, 2 аналитических групп
Катионы 1, 2 аналитических групп Углекислый газ
Углекислый газ Неон. Получение
Неон. Получение Периодическая система Д. И. Менделеева
Периодическая система Д. И. Менделеева Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы
Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы
 Химическая связь
Химическая связь Углеводы Cn(H2O)m
Углеводы Cn(H2O)m Генетическая связь между классами органических веществ
Генетическая связь между классами органических веществ Типы химических реакций в органической химии
Типы химических реакций в органической химии СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ
СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Хімічні сполуки у побуті
Хімічні сполуки у побуті Основные классы неорганических веществ
Основные классы неорганических веществ Мир первозданной красоты. Природные уникумы Урала
Мир первозданной красоты. Природные уникумы Урала Химический элемент и вещество
Химический элемент и вещество Тема 1. Металлы и сплавы
Тема 1. Металлы и сплавы Влияние спирта на здоровье человека
Влияние спирта на здоровье человека Превращения веществ. Роль химии в жизни человека
Превращения веществ. Роль химии в жизни человека Топливо. Виды топлива. Химический состав топлива. Основные характеристики топлива. Марки топлива
Топливо. Виды топлива. Химический состав топлива. Основные характеристики топлива. Марки топлива