Содержание
- 2. Классификация методов анализа По характеру измеряемого свойства или по способу регистрации соответствующего сигнала методы анализа делят
- 3. В зависимости от способа использования реакции методы анализа можно разделить на три группы
- 4. 1. Измеряют количество образовавшегося продукта реакции Р. В гравиметрии измеряют массу образовавшегося осадка. В фотометрии –
- 5. 2. Измеряют количества реагента R, израсходованного на реакцию с определяемым веществом Х. В титриметрии измеряют объем
- 6. 3. Фиксируют изменения, происходящие с самим определяемым веществом Х в процессе взаимодействия с реагентом R. Определение
- 7. По типу химической реакции 1. Методы, основанные на кислотно-основных реакциях; 2. Методы, основанные на реакциях комплексообразования;
- 8. Гравиметрический метод анализа
- 9. Гравиметрическим анализом называют метод количественного химического анализа, основанный на точном измерении массы определяемого вещества или его
- 10. Методы отгонки Прямые методы – определяется масса отогнанного вещества СаСО3 + 2Н+ → Са2+ + СО2
- 11. Методы отгонки Косвенные методы – определяется масса остатка BaCl2·2H2O → BaCl2 + 2H2O ↑.
- 12. Этапы гравиметрического определения 2) Осаждение соединения, содержащего определяемое вещество
- 13. Условие полноты осаждения Чувствительность весов ± 0,1 мг s ≤ 0,0001 г/л Мr = 100 г/моль
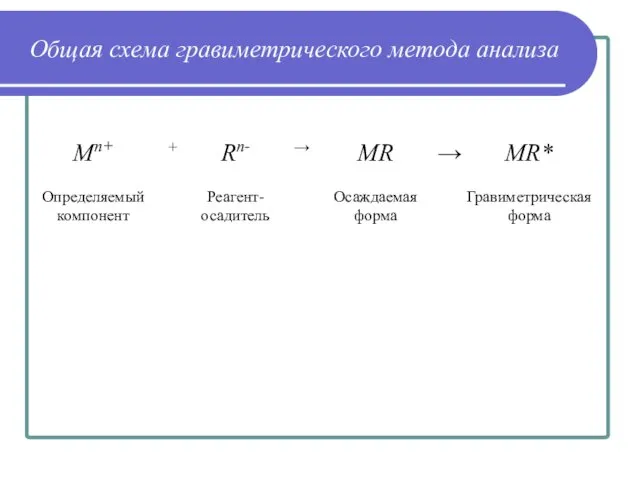
- 14. Общая схема гравиметрического метода анализа
- 15. Определение железа (III)
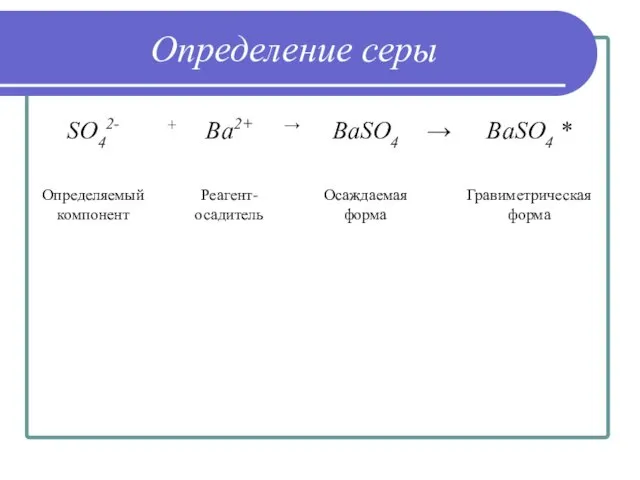
- 16. Определение серы
- 17. Требования к осаждаемой форме 1. Малая растворимость (s 2. В осадок должна выделяться только осаждаемая форма.
- 18. Требования к гравиметрической форме 1. Строгое соответствие состава химической формуле, т.к. только в этом случае по
- 19. Требования к осадителю 1. Осадитель должен селективно реагировать с определяемым компонентом с образованием наименее растворимого соединения.
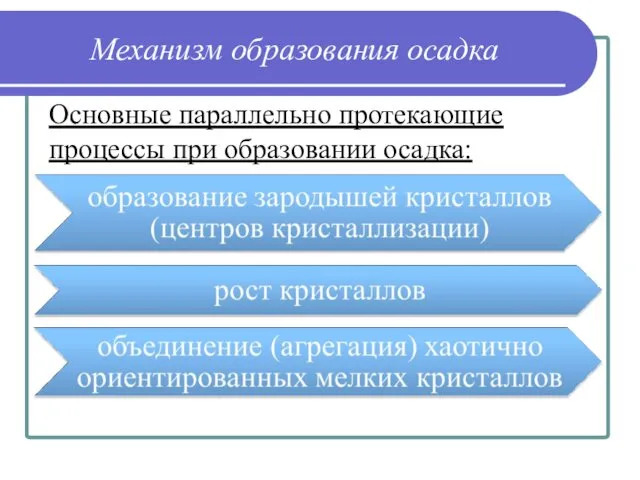
- 20. Механизм образования осадка Основные параллельно протекающие процессы при образовании осадка:
- 21. Степень пересыщения Q – концентрация кристаллизующегося вещества в растворе; S – растворимость; ΔS – относительное пересыщение.
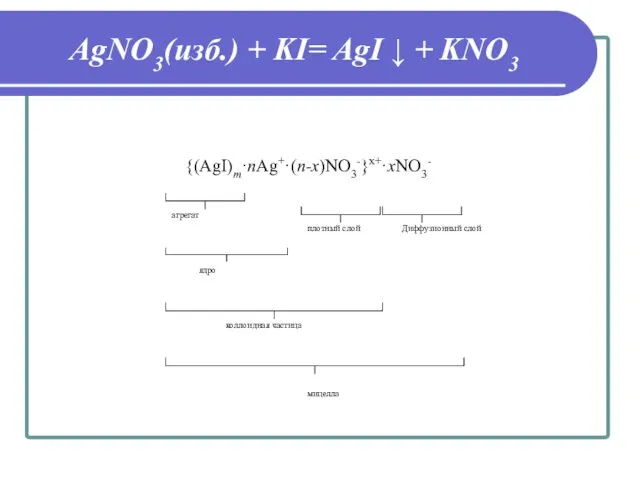
- 22. AgNO3(изб.) + KI= AgI ↓ + KNO3
- 23. Коагуляция Порог коагуляции Электролиты-коагуляторы Пептизация
- 24. Условия осаждения аморфных осадков 1. Осаждение ведут в присутствии подходящего электролита-коагулятора. 2. Осаждение ведут из нагретого
- 25. Условия осаждения кристаллических осадков 1. Осаждение ведут из достаточно разбавленного исследуемого раствора разбавленным раствором осадителя (концентрации
- 26. Адсорбция это соосаждение примесей на поверхности уже сформированного осадка, которое происходит из-за неравноценности электростатического поля ионов
- 27. Правила Панета-Фаянса-Гана а) при одинаковых концентрациях – многозарядные ионы; б) при одинаковых зарядах – ион, присутствующий
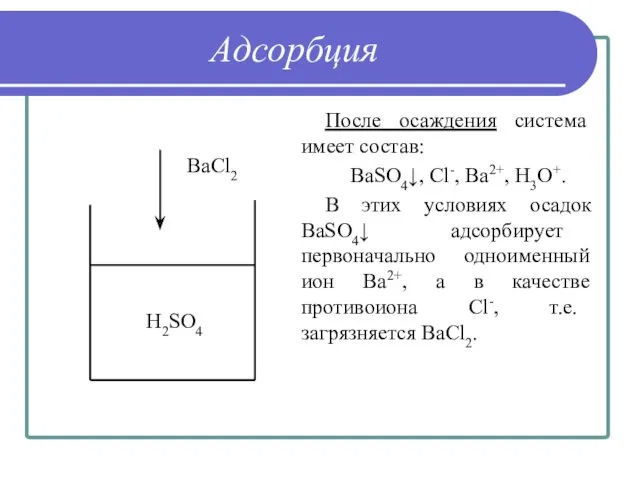
- 28. Адсорбция После осаждения система имеет состав: BaSO4↓, Cl-, Ba2+, H3O+. В этих условиях осадок BaSO4↓ адсорбирует
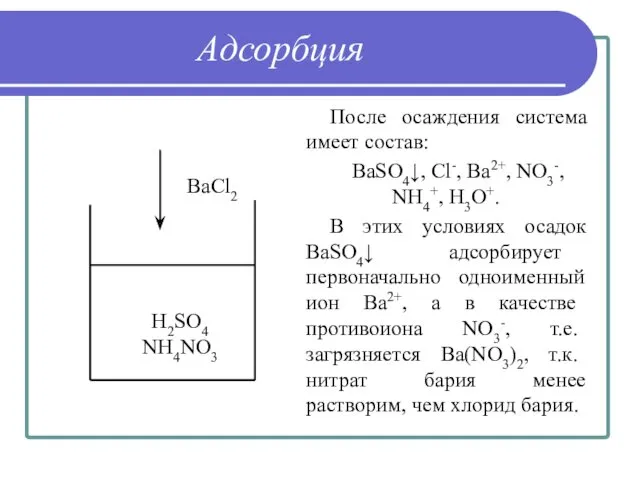
- 29. Адсорбция После осаждения система имеет состав: BaSO4↓, Cl-, Ba2+, NO3-, NH4+, H3O+. В этих условиях осадок
- 30. Окклюзия Загрязнение осадка в результате захвата примесей внутрь растущих кристаллов осадка основного компонента Причина окклюзии –
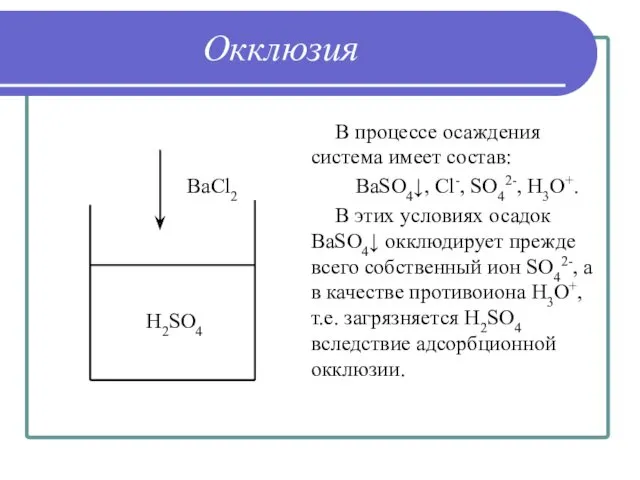
- 31. Окклюзия В процессе осаждения система имеет состав: BaSO4↓, Cl-, SO42-, H3O+. В этих условиях осадок BaSO4↓
- 32. Изоморфное соосаждение ZnCO3, MgCO3, FeCO3, MnCO3, CdCO3 и CaCO3; BaSO4, PbSO4, SrSO4 и RaSO4; MgNH4PO4 и
- 33. Этапы гравиметрического определения 3) Фильтрование полученной смеси для отделения осадка от надосадочной жидкости
- 34. Фильтрование
- 35. Фильтрование
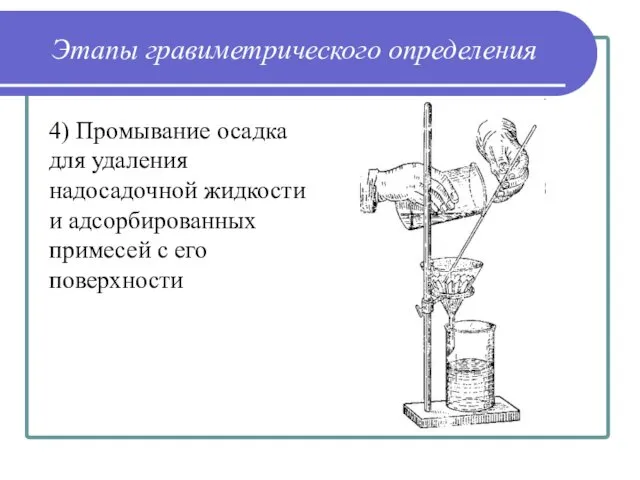
- 36. Этапы гравиметрического определения 4) Промывание осадка для удаления надосадочной жидкости и адсорбированных примесей с его поверхности
- 37. Этапы гравиметрического определения 5) Высушивание при относительно низкой температуре для удаления воды или прокаливание при высокой
- 38. Высушивание или прокаливание
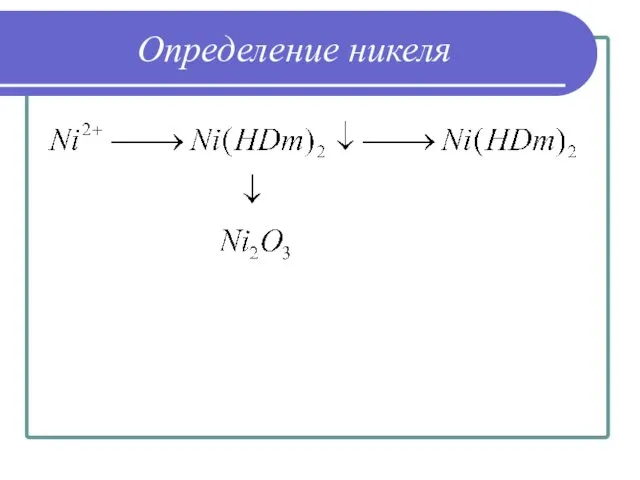
- 39. Определение никеля
- 40. Гравиметрический фактор
- 41. Определение магния 2Mg2+ → 2MgNH4PO4 → Mg2P2O7
- 42. Этапы гравиметрического определения 6) Взвешивание полученного осадка на аналитических весах
- 44. Скачать презентацию































 Бензин. Производство бензина
Бензин. Производство бензина Types of chemical reactions
Types of chemical reactions соединения VI группы продвинутая версия
соединения VI группы продвинутая версия Азотсодержащие органические соединения
Азотсодержащие органические соединения Органическая химия. Лекция 13
Органическая химия. Лекция 13 Химическое равновесие. Смещение химического равновесия
Химическое равновесие. Смещение химического равновесия Современные положения теории А.М. Бутлерова
Современные положения теории А.М. Бутлерова Химические формулы. Относительная молекулярная масса
Химические формулы. Относительная молекулярная масса Изотопный обмен
Изотопный обмен Растворы. Вычисление массовой доли растворенного вещества в растворе. Урок для 8-го класса
Растворы. Вычисление массовой доли растворенного вещества в растворе. Урок для 8-го класса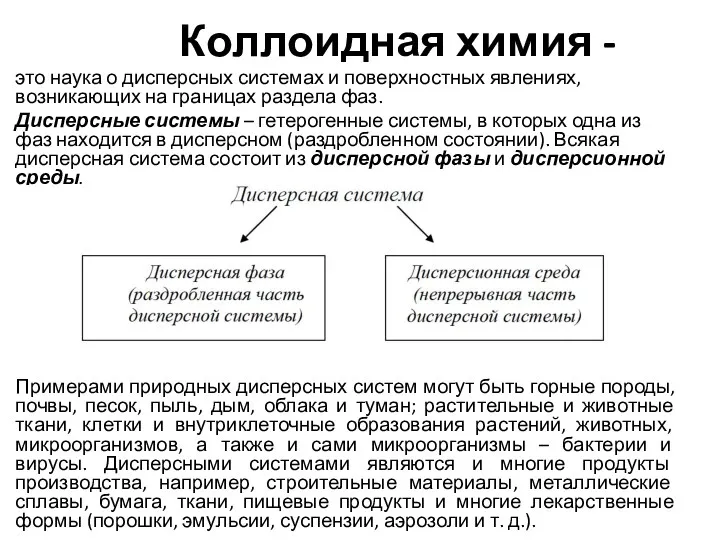 Коллоидная химия
Коллоидная химия Алкены. Этиленовые углеводороды, олефины
Алкены. Этиленовые углеводороды, олефины Nucleic acids
Nucleic acids Общая и медицинская химия
Общая и медицинская химия Создание косметических средств
Создание косметических средств Лекарственные средства из группы карбоновых кислот и их производных калия ацетат, кальция лактат, натрия цитрат
Лекарственные средства из группы карбоновых кислот и их производных калия ацетат, кальция лактат, натрия цитрат Алюминий и бор
Алюминий и бор Получение галогенов. Биологическое значение и применение галогенов и их соединений
Получение галогенов. Биологическое значение и применение галогенов и их соединений Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) проект по биологииНаучно-исследовательская работа
проект по биологииНаучно-исследовательская работа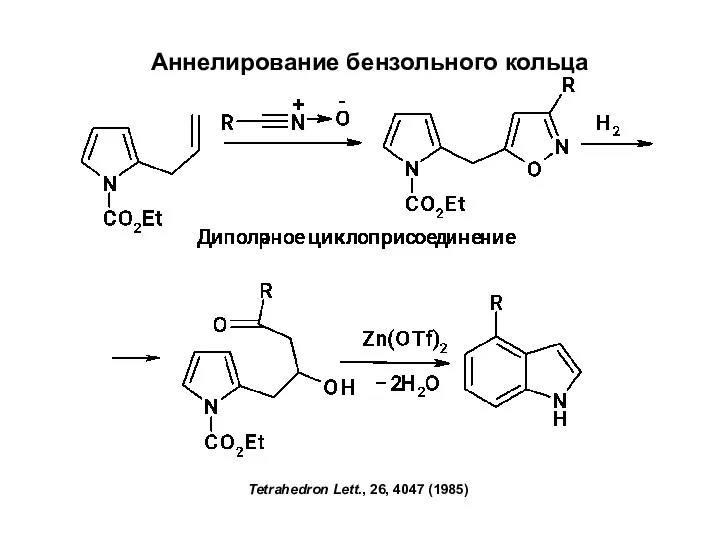 Аннелирование бензольного кольца
Аннелирование бензольного кольца Строение атома. Теории строения атома
Строение атома. Теории строения атома Анализ начальных участков изотерм адсорбции
Анализ начальных участков изотерм адсорбции Многоатомные спирты
Многоатомные спирты Щелочноземельные металлы. Химические свойства
Щелочноземельные металлы. Химические свойства Азот и его свойства
Азот и его свойства Нефть. Способы её переработки. Фракции нефти
Нефть. Способы её переработки. Фракции нефти Процесс электролиза
Процесс электролиза