Содержание
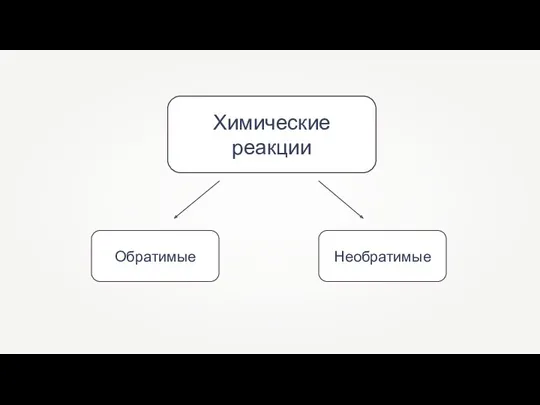
- 2. Химические реакции
- 3. Необратимые химические реакции — это реакции, которые протекают только в одном направлении («слева направо»), в результате
- 4. Обратимые химические реакции — это реакции, которые одновременно протекают в двух противоположных направлениях (прямая «слева направо»
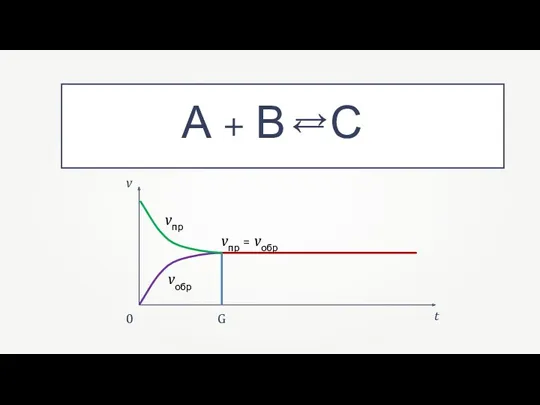
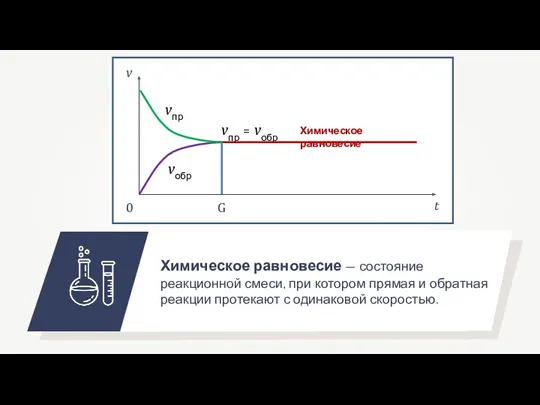
- 5. v t vпр vобр vпр = vобр 0 G
- 6. Химическое равновесие — состояние реакционной смеси, при котором прямая и обратная реакции протекают с одинаковой скоростью.
- 7. Анри Ле Шателье 1850–1936 гг. Закон смещения химического равновесия в зависимости от внешних факторов в 1885
- 8. Принцип Ле Шателье Если изменить одно из условий (температуру, давление или концентрацию одного из веществ), при
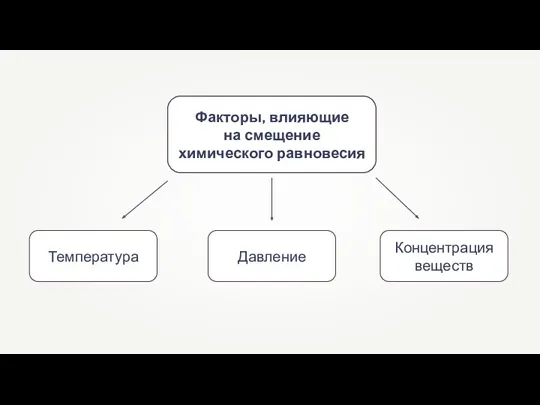
- 9. Факторы, влияющие на смещение химического равновесия
- 10. При повышении температуры система противодействует, т.е. охлаждает себя, что происходит за счёт смещения равновесия в сторону
- 11. При понижении температуры система отвечает нагреванием, т.е. смещением равновесия в сторону экзотермической реакции соединения NO и
- 12. Чтобы увеличить скорость прямой реакции, нужно понизить давление в сосуде. Чтобы сместить равновесие в сторону обратной
- 13. При увеличении концентрации NO2 скорость прямой реакции увеличится. Если увеличить концентрацию NO или O2, или их
- 15. Задача Реакция протекает по уравнению 2SO2 (г) + O2 (г) = 2SO3 (г) + Q Укажите,
- 17. Скачать презентацию










 Александр Евгеньевич Ферсман
Александр Евгеньевич Ферсман Кислород и озон
Кислород и озон Алкандар. Метан және оның құрылысы
Алкандар. Метан және оның құрылысы Соли аммония
Соли аммония Химические свойства алканов
Химические свойства алканов Свободное окисление и токсические формы кислорода
Свободное окисление и токсические формы кислорода Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы”
Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы” Углерод. Оксиды углерода
Углерод. Оксиды углерода Применение соляной кислоты и её солей
Применение соляной кислоты и её солей Антибиотики как ЛС
Антибиотики как ЛС Соли. CaSO4 - Сульфат кальция
Соли. CaSO4 - Сульфат кальция Class micro and macro elements
Class micro and macro elements Строение атома. Периодический закон Менделеева
Строение атома. Периодический закон Менделеева Простые вещества – неметаллы
Простые вещества – неметаллы Вычисление массовой доли растворенного вещества. 8 класс
Вычисление массовой доли растворенного вещества. 8 класс Цинк в функциональных пищевых и кормовых продуктах
Цинк в функциональных пищевых и кормовых продуктах Ювелирное дело. Империя самоцветов
Ювелирное дело. Империя самоцветов Ферменты в биотехнологии
Ферменты в биотехнологии Строение вещества и агрегатные состояния вещества
Строение вещества и агрегатные состояния вещества Мило та миловаріння
Мило та миловаріння Почему мыло пенится
Почему мыло пенится Основные классы неорганических соединений
Основные классы неорганических соединений Тренувальні вправи. Задачі
Тренувальні вправи. Задачі Період як особлива синтаксична конструкція
Період як особлива синтаксична конструкція Кислородсодержащие органические соединения. Лабораторная работа
Кислородсодержащие органические соединения. Лабораторная работа Химия элементов. Общая характеристика элементов
Химия элементов. Общая характеристика элементов Вклад М.В. Ломоносова в развитие химии
Вклад М.В. Ломоносова в развитие химии Узагальнення знань з теми Вуглеводні
Узагальнення знань з теми Вуглеводні