Содержание
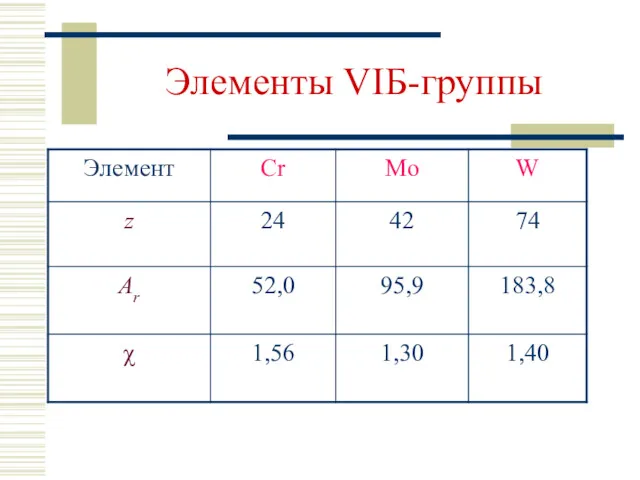
- 2. Элементы VIБ-группы
- 3. Электронное строение Cr: […] 4s1 3d 5 4p0 Mo: […] 5s1 4d 55p0 W: […] 6s
- 4. Простые вещества
- 5. Простые вещества Cr + 2H3O+ + 4H2O = [Cr(H2O)6]2+ + H2↑ Mo(W) + H3O+ ≠
- 6. Простые вещества Кислоты-окислители (пассивация на холоду): ЭVIБ + HNO3(конц), H2SO4(конц) ≠ Э (Mo,W) + 2HNO3 +
- 7. Металлы
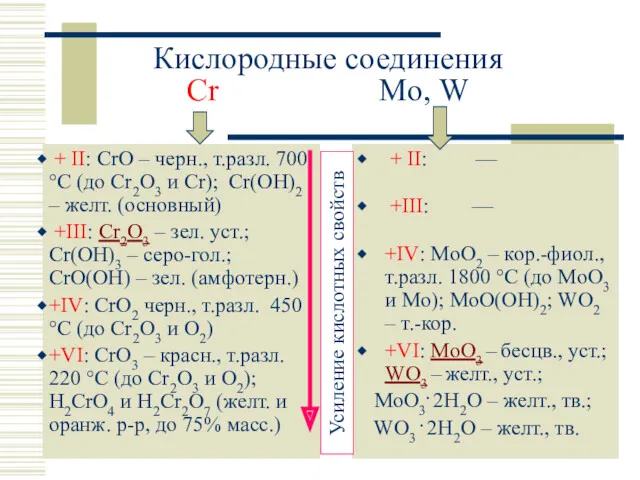
- 8. Кислородные соединения Cr Mo, W + II: CrO – черн., т.разл. 700 °C (до Cr2O3 и
- 9. Э+VI: CrO3 MoO3 WO3 т. пл., °С: 197 795 1473 красный, летуч., яд. бесцв. желт. (ЭO3)3
- 10. Комплексные соединения Ст. ок. 0: [Э0(CO)6] [Cr0(CO)6] – гексакарбонилхром: диамагнитный d 2sp3, октаэдр [Cr+δ (CO–δ/6)6] |
- 11. Комплексные соединения CrIII [Cr(H2O)4Cl2]Cl · 2H2O зеленый [Cr(H2O)6]Cl3 фиолетовый CrCl3 · 6H2O [Cr(H2O)4Cl2]+ + 2 H2O
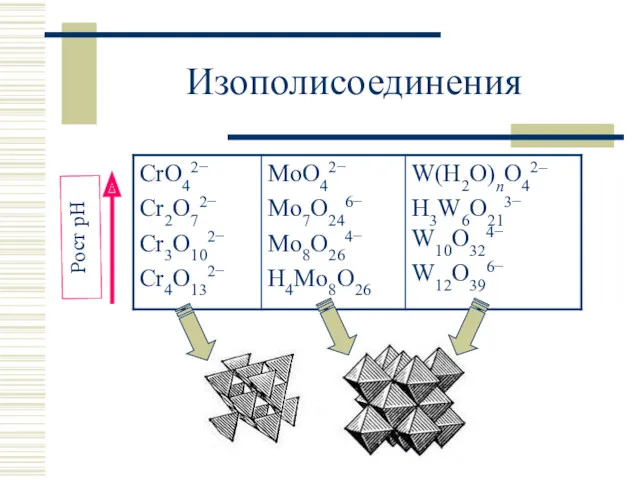
- 12. Изополисоединения (ст.ок. +VI) 2CrO42− + 2H3O+ ⮀ Cr2O72− + 3H2O; KcI ≈1014 3Cr2O72− + 2H3O+ ⮀
- 13. Изополисоединения
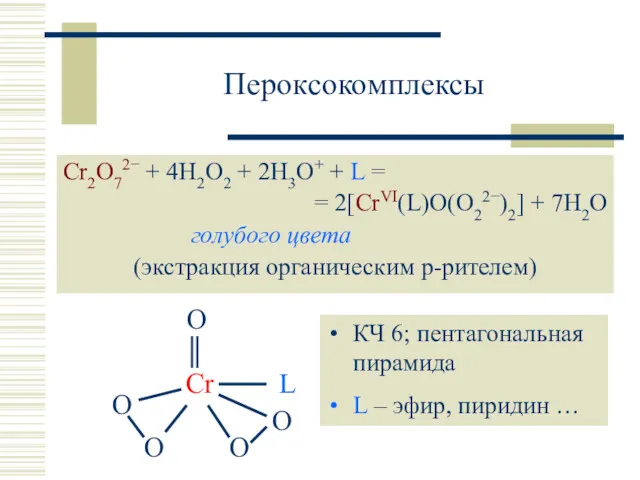
- 14. Пероксокомплексы Cr2O72− + 4H2O2 + 2H3O+ + L = = 2[CrVI(L)O(O22−)2] + 7H2O голубого цвета (экстракция
- 15. Распространение в природе и важнейшие минералы 21. Cr 0,019% масс. 39. Mo 1·10–3% 27. W 7·10–3%
- 16. Минералы гюбнерит MnWO4 повеллит CaMoO4 молибдошеелит Ca(W,Mo)O4 ферберит FeWO4 Хром входит в состав минералов: александрит, рубин,
- 17. Получение Cr2O3 + 2Al = 2Cr + Al2O3 (t°) (Cr2IIIFeII)O4 + 4C = Fe + 2Cr
- 18. Химия хрома. Cr(II) Cr(OH)2 – основный гидроксид, восстановитель CrII(OH)2(т) + O2 → Cr2IIIO3 · nH2O(т) Cr(OH)2(т)
- 19. Аквакатион хрома(II) Сильнейший восст-ль: ϕ° (Cr3+/Cr2+) = –0,41 В 4[CrII(H2O)6]2+ + O2 + 4H3O+ = =
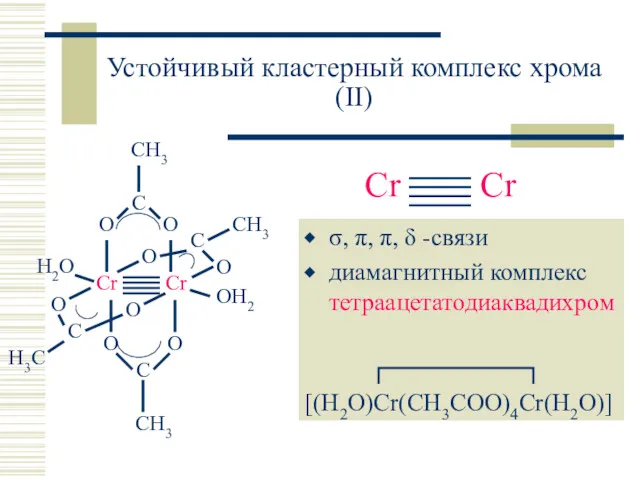
- 20. Устойчивый кластерный комплекс хрома(II) σ, π, π, δ -связи диамагнитный комплекс тетраацетатодиаквадихром
- 21. Оксид хрома(III) Cr2O3 Cr2O3 - пигмент (зелен.), амфотерн., уст. в ОВР Получение: (NH4)2Cr2O7 = Cr2O3 +
- 22. [Cr(H2O)6]3+ + 3NH3·H2O → Cr2O3·nH2O(т) + … серо-зеленый гель [Cr(H2O)6]3+ + H2O ⮀ [Cr(H2O)5OH]2+ + H3O+;
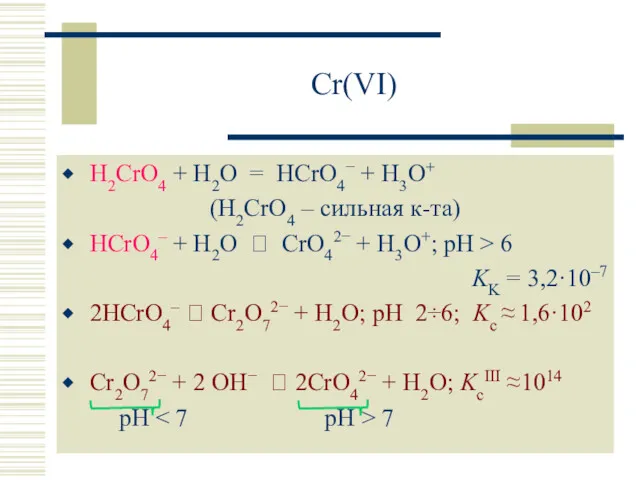
- 23. Cr(VI) H2CrO4 + H2O = HCrO4− + H3O+ (H2CrO4 – сильная к-та) HCrO4– + H2O ⮀
- 24. Окислительно-восстановительные свойства рН Cr2O72− + 14H3O+ + 6e− = 2[Cr(H2O)6]3+ + 9H2O; ϕ° = +1,33 В
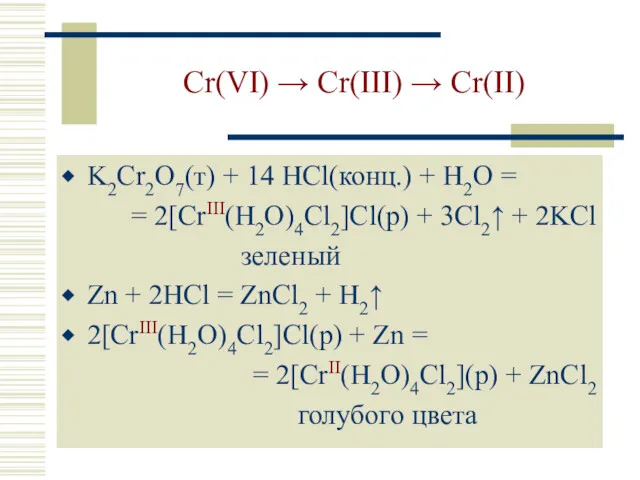
- 25. Cr(VI) → Cr(III) → Cr(II) K2Cr2O7(т) + 14 HCl(конц.) + H2O = = 2[CrIII(H2O)4Cl2]Cl(р) + 3Cl2↑
- 26. Разложение дихромата аммония (NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O «Дихроматный вулкан» (видеофрагмент)
- 28. Скачать презентацию
![Электронное строение Cr: […] 4s1 3d 5 4p0 Mo: […]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/165772/slide-2.jpg)

![Простые вещества Cr + 2H3O+ + 4H2O = [Cr(H2O)6]2+ + H2↑ Mo(W) + H3O+ ≠](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/165772/slide-4.jpg)



![Комплексные соединения Ст. ок. 0: [Э0(CO)6] [Cr0(CO)6] – гексакарбонилхром: диамагнитный](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/165772/slide-9.jpg)
![Комплексные соединения CrIII [Cr(H2O)4Cl2]Cl · 2H2O зеленый [Cr(H2O)6]Cl3 фиолетовый CrCl3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/165772/slide-10.jpg)





![Аквакатион хрома(II) Сильнейший восст-ль: ϕ° (Cr3+/Cr2+) = –0,41 В 4[CrII(H2O)6]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/165772/slide-18.jpg)

![[Cr(H2O)6]3+ + 3NH3·H2O → Cr2O3·nH2O(т) + … серо-зеленый гель [Cr(H2O)6]3+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/165772/slide-21.jpg)
![Окислительно-восстановительные свойства рН Cr2O72− + 14H3O+ + 6e− = 2[Cr(H2O)6]3+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/165772/slide-23.jpg)

 20230419_alkiny_uglub
20230419_alkiny_uglub Металлические стёкла
Металлические стёкла Возникновение и развитие научной химии
Возникновение и развитие научной химии Галогены VII группы. Биологическая роль и применение в медицине
Галогены VII группы. Биологическая роль и применение в медицине Анализ пищевых добавок (маркировка Е) используемых в продуктовой линейке Витамакс
Анализ пищевых добавок (маркировка Е) используемых в продуктовой линейке Витамакс Химический элемент Алюминий
Химический элемент Алюминий Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Залізо. Фізичні та хімічні властивості
Залізо. Фізичні та хімічні властивості Синтетичні високомолекулярні речовини і полімерні матеріали на їх основі
Синтетичні високомолекулярні речовини і полімерні матеріали на їх основі Валентность химического элемента. Определение валентности по химической формуле
Валентность химического элемента. Определение валентности по химической формуле Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Вирощування кристалів солей
Вирощування кристалів солей Строение атома (лекция 3)
Строение атома (лекция 3) Спирттер мен фенолдар
Спирттер мен фенолдар Скорость химических реакций
Скорость химических реакций Массовая доля вещества в растворе
Массовая доля вещества в растворе Непредельные, ненасыщенные, ацетиленовые алкины
Непредельные, ненасыщенные, ацетиленовые алкины Алкены (этиленовые углеводороды)
Алкены (этиленовые углеводороды) Торий. Алынуы
Торий. Алынуы Химия и проблемы охраны окружающей среды
Химия и проблемы охраны окружающей среды Вывод формул веществ по массовым долям элементов. 10 класс
Вывод формул веществ по массовым долям элементов. 10 класс Types of chemical reactions
Types of chemical reactions Кислород. Характеристика и применение
Кислород. Характеристика и применение Хімічні формули речовин
Хімічні формули речовин Коллигативные свойства растворов
Коллигативные свойства растворов АМИНОКИСЛОТЫ. ИСТОРИЯ ИХ ОТКРЫТИЯ.
АМИНОКИСЛОТЫ. ИСТОРИЯ ИХ ОТКРЫТИЯ. Генетическая связь между основными классами неорганических соединений
Генетическая связь между основными классами неорганических соединений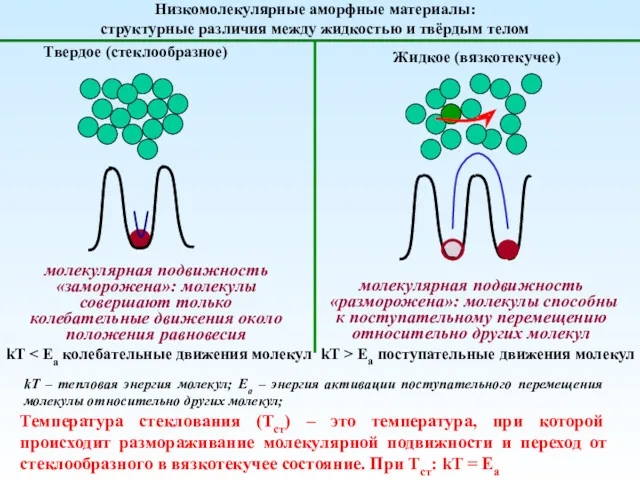 Механика полимеров
Механика полимеров