Содержание
- 2. Al 13 Алюминий (лат. (лат. Aluminium(лат. Aluminium) 3 8 2 26,9815 3s2 3p1 Порядковый номер. Химический
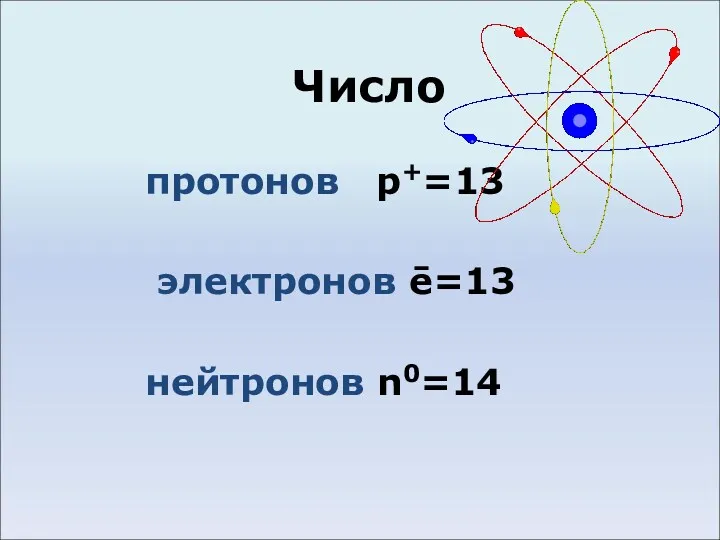
- 3. Число протонов p+=13 электронов ē=13 нейтронов n0=14
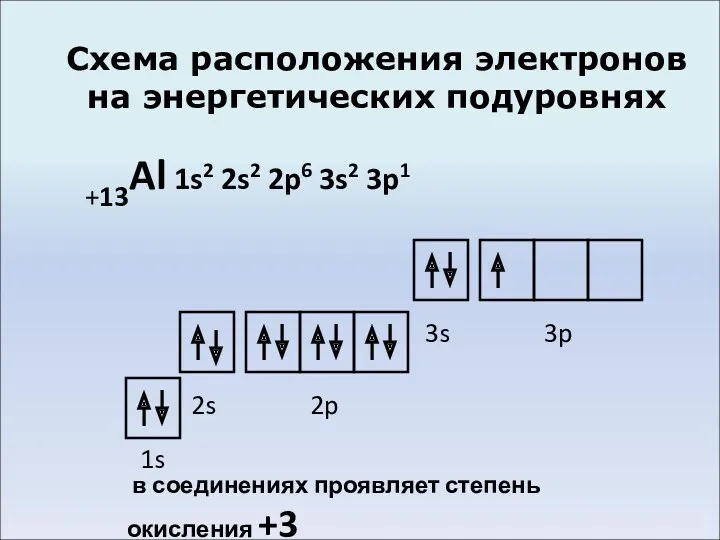
- 4. Схема расположения электронов на энергетических подуровнях +13Al 1s2 2s2 2p6 3s2 3p1 1s 2s 2p 3s
- 5. Al – типичный металл Восстановительные свойства Al 0- 3ē Al+3 Тип химической связи -металлическая Тип кристаллической
- 6. Физические свойства вещества Al – серебристо-белый металл, пластичный, легкий, хорошо проводит тепло и электрический ток, обладает
- 7. Особенности физических и химических свойств алюминия, его нахождения в природе и применения: Алюминий – самый распространенный
- 8. Алюминий реагирует с простыми веществами - неметаллами 4Al+3O2 = 2Al2O3 Поверхность покрывается пленкой оксида, в мелкораздробленном
- 9. Алюминий реагирует со сложными веществами: Алюминий растворяется в растворах кислот 2Al + 6HCl = 2AlCl3 +
- 10. Алюминий реагирует со сложными веществами: 3. Алюминий при высокой температуре реагирует с оксидами менее активных металлов
- 11. Алюминий реагирует со сложными веществами: 4.Так как алюминий – амфотерный металл, он реагирует с растворами щелочей.
- 12. Получение алюминия Алюминий получают электролизом раствора глинозема в расплавленном криолите (Na3AIF6) и электролизом расплава AlCl3
- 13. Применение Al
- 14. Соединения алюминия В природе алюминий встречается только в виде соединений и по распространенности в земной коре
- 15. Оксид алюминия Al2О3: Очень твердый (корунд, рубин)в кристаллическом состоянии, порошок белого цвета, тугоплавкий - 20500С. Не
- 16. Белый нерастворимый в воде порошок. Проявляет амфотерные свойства, взаимодействует: а) с кислотами Al (OH)3 + 3HCl
- 17. Домашнее задание: Параграф 13 (учить в тет.) №4, 6 , 7 2. Задачи №1,2 из Таблицы
- 19. Скачать презентацию













 Карбоновые кислоты – союз двух групп (урок-исследование химических свойств карбоновых кислот)
Карбоновые кислоты – союз двух групп (урок-исследование химических свойств карбоновых кислот) Аллотропные модификации алмаза
Аллотропные модификации алмаза Вещества и тела. Состояния веществ. Смеси
Вещества и тела. Состояния веществ. Смеси Хром. Свойства
Хром. Свойства Кремний и его соединения
Кремний и его соединения D-элементы: хром, молибден, вольфрам
D-элементы: хром, молибден, вольфрам Реакционная способность твердых тел и способы ее регулирования
Реакционная способность твердых тел и способы ее регулирования Гибкость цепи полимеров
Гибкость цепи полимеров Общая характеристика неметаллов
Общая характеристика неметаллов Реакция Бэйлиса Хиллмана-Мориты
Реакция Бэйлиса Хиллмана-Мориты Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Коррозия металлов
Коррозия металлов Коррозия металлов
Коррозия металлов Preparation for COP
Preparation for COP Экспериментальные методы измерения изотерм адсорбции. Лекция 4
Экспериментальные методы измерения изотерм адсорбции. Лекция 4 Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Титан және оның қорытпалары. Титаннан жасалған құралдар
Титан және оның қорытпалары. Титаннан жасалған құралдар Озон
Озон Соединения азота. Оксиды азота
Соединения азота. Оксиды азота Водород. Общая характеристика по плану
Водород. Общая характеристика по плану Исследовательский проект определение качества питьевой воды в домашних условиях
Исследовательский проект определение качества питьевой воды в домашних условиях Классификация конструкционных материалов. Особенности атомно-кристаллического строения металлов. Лекции №1
Классификация конструкционных материалов. Особенности атомно-кристаллического строения металлов. Лекции №1 Разделение углеводородных газов
Разделение углеводородных газов Химические реакции
Химические реакции Каменный уголь. Переработка и применение угля
Каменный уголь. Переработка и применение угля Гидролиз неорганических соединений
Гидролиз неорганических соединений Водород. Химический элемент
Водород. Химический элемент Металдар мен бейметалдардың салыстырмалы сипаттамасы
Металдар мен бейметалдардың салыстырмалы сипаттамасы