Содержание
- 2. 1. Химический элемент Порядковый номер 1 Группа – I Период – 1 Электронная формула 1s1 Степени
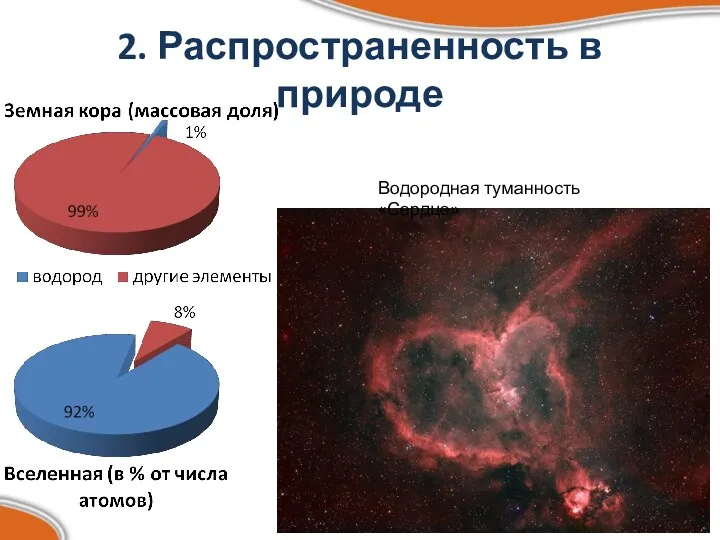
- 3. 2. Распространенность в природе Водородная туманность «Сердце»
- 4. 3. Историческая справка 1766 г. – водород открыл Г. Кавендиш 1784 г. – А. Лавуазье назвал
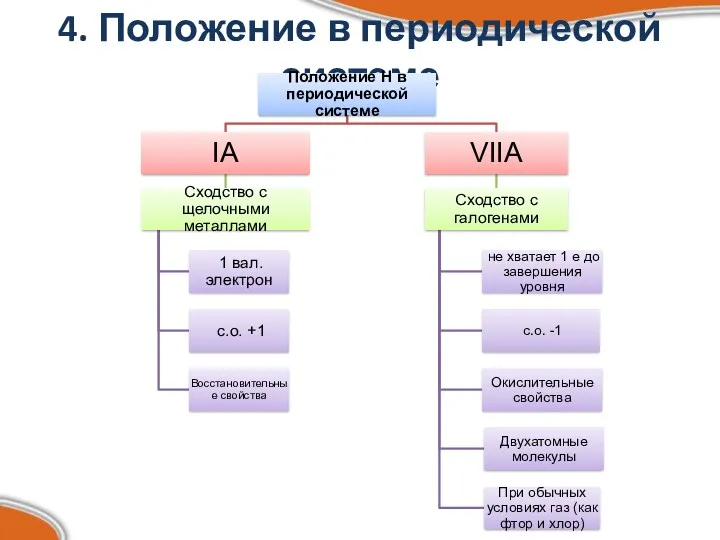
- 5. 4. Положение в периодической системе
- 6. 5. Физические свойства Газ без цвета, вкуса и запаха. Легче воздуха в 14,5 раз. Плохо растворим
- 7. 6. Химические свойства Взаимодействие с металлами: Ca + H2 = CaH2 CaH2 + 2H2O = Ca(OH)2
- 8. 7. Получение В промышленности – конверсией водяных паров с углем или метаном: С + H2O =
- 9. 7. Получение II. В лаборатории: 1) действием разбавленных кислот (кроме HNO3) на металлы: Zn + HCl
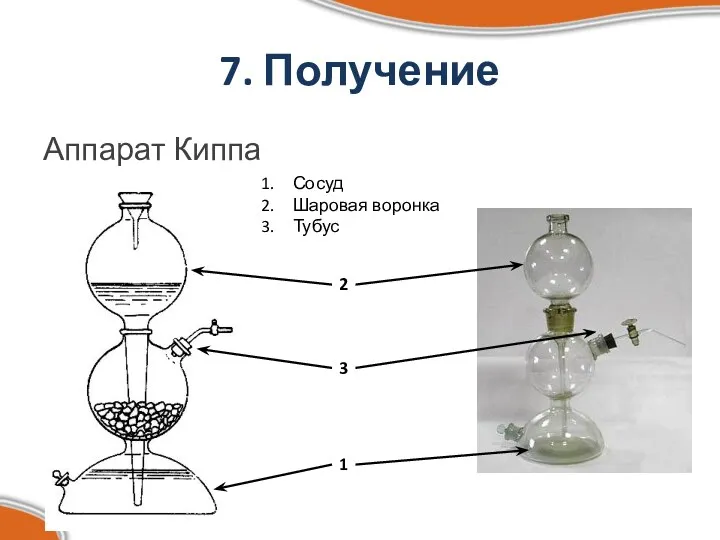
- 10. 7. Получение Аппарат Киппа Сосуд Шаровая воронка Тубус 1 2 3
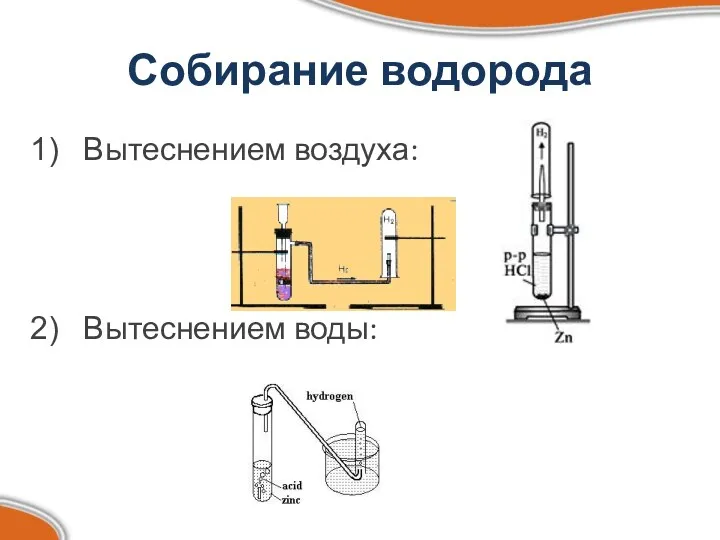
- 11. Собирание водорода Вытеснением воздуха: Вытеснением воды:
- 12. 8. Применение 1) Химическая промышленность: получение аммиака, метанола, мыла, пластмасс и др.
- 13. 9. Применение 2) Пищевая промышленность: а) производство маргарина б) пищевая добавка Е949 (упаковочный газ)
- 14. 8. Применение 3) Топливо (ракетное, машинное)
- 15. 8. Применение 4) Военная промышленность (производство водородных бомб)
- 16. 8. Применение 5) Резка и сварка металлов Пламенем водородной горелки можно резать и сваривать металлы
- 18. Скачать презентацию











 Явления, происходящие с веществами
Явления, происходящие с веществами Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Общая и неорганическая химия. Классы неорганических соединений. Способы выражения состава растворов
Общая и неорганическая химия. Классы неорганических соединений. Способы выражения состава растворов Степень окисления
Степень окисления Галогены. Физические свойства галогенов
Галогены. Физические свойства галогенов Валентные возможности атомов химических элементов
Валентные возможности атомов химических элементов Фунгициды. Достоинства и недостати
Фунгициды. Достоинства и недостати Застосування неметалів
Застосування неметалів Органическая химия. Ацетилен
Органическая химия. Ацетилен Дослідження якісного складу солей. Практична робота №1
Дослідження якісного складу солей. Практична робота №1 Термохимия. Термохимические уравнения
Термохимия. Термохимические уравнения Растворы. Лекция 1
Растворы. Лекция 1 Композиционные материалы
Композиционные материалы Химия. ОГЭ
Химия. ОГЭ Кристаллические решетки
Кристаллические решетки Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты
Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты Изомерия. Виды изомерии
Изомерия. Виды изомерии Понятие Химический элемент
Понятие Химический элемент Кристаллография и основы кристаллохимии
Кристаллография и основы кристаллохимии Гетероциклические соединения
Гетероциклические соединения Получение и установление состава кристаллогидрата фосфата цинка
Получение и установление состава кристаллогидрата фосфата цинка Основания. Химические свойства оснований. Сильные и слабые основания
Основания. Химические свойства оснований. Сильные и слабые основания Химиялық реакциялардың типтері
Химиялық реакциялардың типтері Дисперсные системы
Дисперсные системы Энергетика химических процессов. Энтропия и энергия Гиббса
Энергетика химических процессов. Энтропия и энергия Гиббса Крохмаль і целюлоза. Полімерна будова, властивості, застосування
Крохмаль і целюлоза. Полімерна будова, властивості, застосування Кремний и его соединения
Кремний и его соединения Способы разделения смесей
Способы разделения смесей