Общая и неорганическая химия. Классы неорганических соединений. Способы выражения состава растворов презентация
Содержание
- 3. Классы неорганических соединений. Перечислите основные классы сложных неорганических веществ. Только кислотные оксиды содержатся в ряду: А)
- 5. Способы выражения состава растворов Смешали 200 г раствора глюкозы с массовой долей растворённого вещества 20% и
- 10. 1. Массовая концентрация (Р) – это растворенное вещество, выраженное в граммах, содержащееся в 100 граммах раствора:
- 12. 2. Молярная концентрация (СВ) – это количество моль растворенного вещества, в 1дм3 раствора: Например, запись: 0,2М
- 13. Перевод молярной концентрации в массовую долю: ω = C Mr β 1000 Где ω – массовая
- 14. Под эквивалентом элемента понимают также его количество, которое соединяется с одним молем атомов водорода или замещает
- 15. Молярная масса эквивалента соли – это частное деления молярной массы соли на произведение валентности металла соли
- 16. 4. Моляльная концентрация (СM) – это количество моль растворенного вещества в кг растворителя. 5. Титр раствора
- 18. Скачать презентацию














 Химический состав клетки. Неорганические вещества
Химический состав клетки. Неорганические вещества Химия в быту
Химия в быту Процессы и операции формообразования. Металлургия цветных металлов
Процессы и операции формообразования. Металлургия цветных металлов Native elements
Native elements Химические свойства алканов
Химические свойства алканов Органическая химия. Пособие
Органическая химия. Пособие Качественные реакции на функциональные группы
Качественные реакции на функциональные группы Технологии получения полимерных нанокомпозитов
Технологии получения полимерных нанокомпозитов Введение в общеобразовательную научную дисциплину Химия
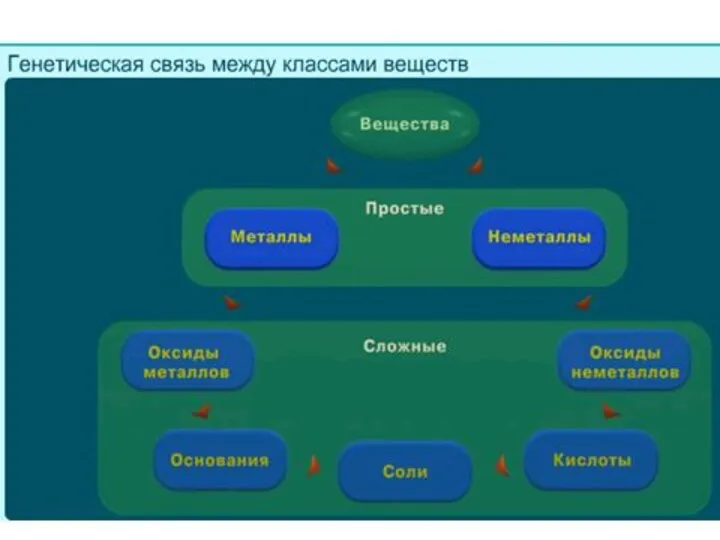
Введение в общеобразовательную научную дисциплину Химия Генетическая связь между классами неорганических соединений. Урок 1
Генетическая связь между классами неорганических соединений. Урок 1 Суды залалсыздандыру әдістері
Суды залалсыздандыру әдістері Практическая работа №1. Приготовление раствора с определенной массовой долей соли
Практическая работа №1. Приготовление раствора с определенной массовой долей соли Комплексные соединения
Комплексные соединения Механизм реакции
Механизм реакции 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023 Интеллектуальная игра Кто хочет стать отличником?. Химия. 11 класс
Интеллектуальная игра Кто хочет стать отличником?. Химия. 11 класс Повторение. Ионные уравнения реакции
Повторение. Ионные уравнения реакции Класифікація, будова та номенклатура органічних сполук
Класифікація, будова та номенклатура органічних сполук Производство ацетальдегида
Производство ацетальдегида Классификация химических реакций
Классификация химических реакций Химия - Кормилица. 10 класс
Химия - Кормилица. 10 класс Crystallography. Part 4: Crystal Forms Twinning
Crystallography. Part 4: Crystal Forms Twinning Нуклеопротеины
Нуклеопротеины Тағамдық қоспалардың функционалдық жүктелуі және олардың сипаттамасы
Тағамдық қоспалардың функционалдық жүктелуі және олардың сипаттамасы Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння Ароматические углеводороды. 10 класс
Ароматические углеводороды. 10 класс Вещества. Чистые вещества. Смеси
Вещества. Чистые вещества. Смеси Водород. Общая характеристика, получение, свойства
Водород. Общая характеристика, получение, свойства