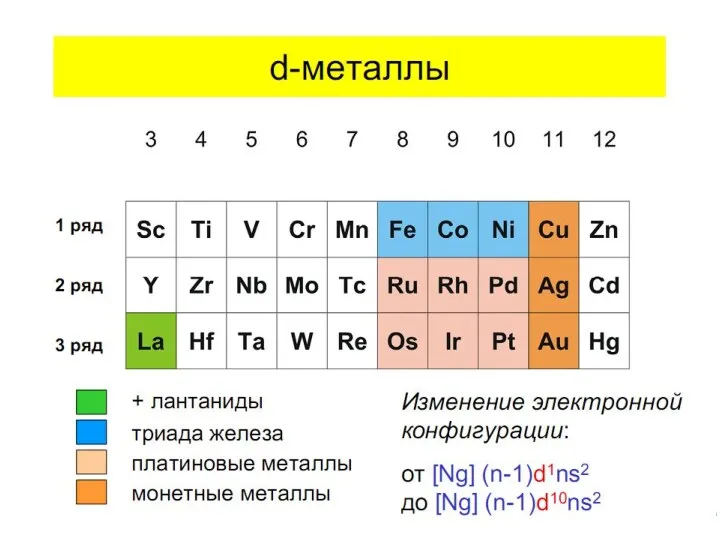
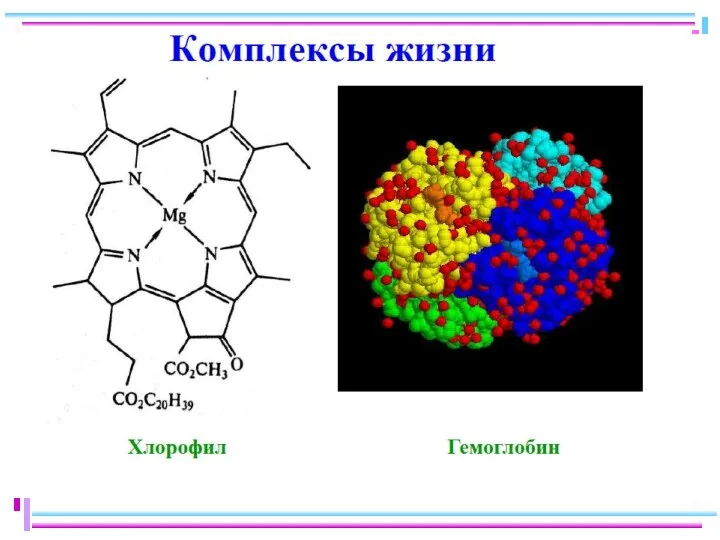
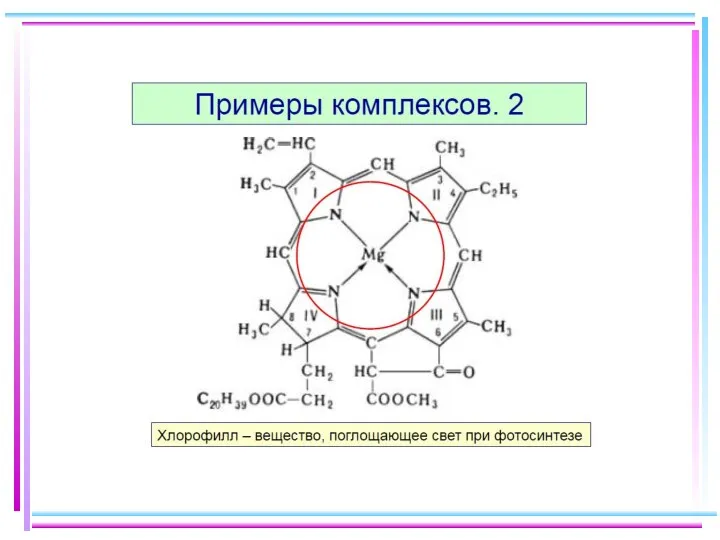
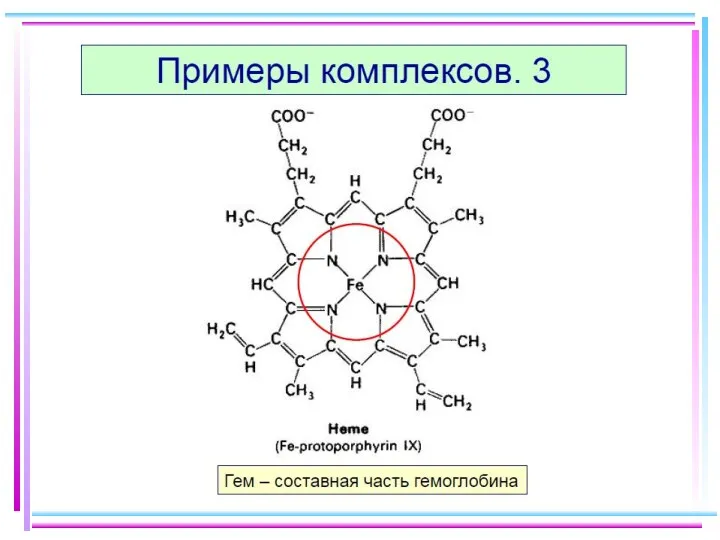
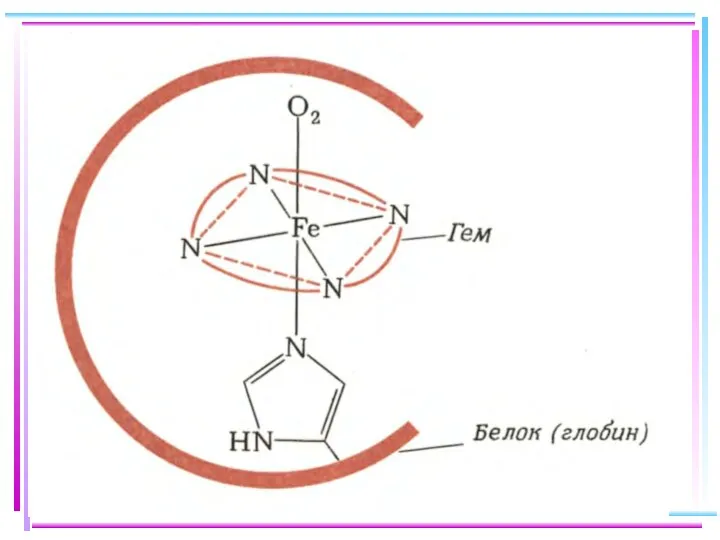
Содержание
- 5. СИДЖВИК (Sidgwick), Невилл Винсент 8 мая 1873 г. – 15 марта 1952 г. Английский химик Невилл
- 6. ПО́ЛИНГ (Паулинг) (Pauling) Лайнус Карл (1901—1994), американский физик и химик, кристаллограф, лауреат двух Нобелевских премий: по
- 7. Гилберт-Ньютон ЛЬЮИС (Lewis G.N.) (23.X. 1875 - 23.III. 1946) Гилберт-Ньютон Льюис - американский физикохимик, член Национальной
- 8. Коссель Вальтер (4.I.1888–22.V.1956) Немецкий физик. Основные исследования посвящены развитию электронных представлений в химии. Предложил (1916) статическую
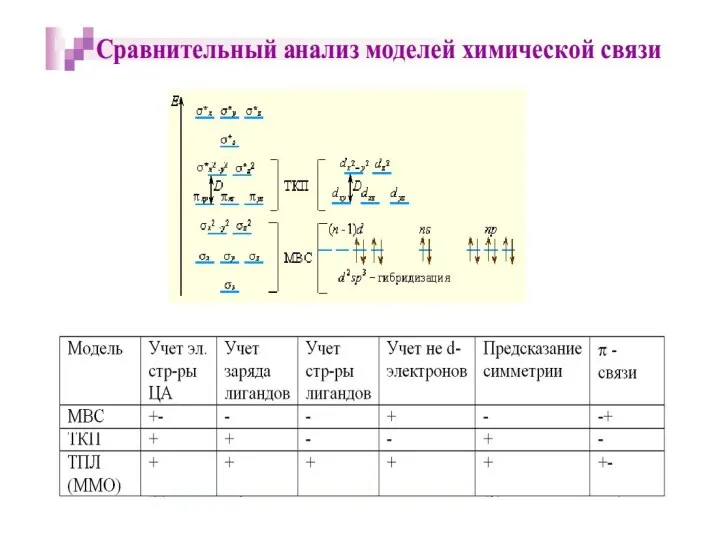
- 9. Квантовомеханические теории строения комплексных соединений Для объяснения строения комплексных соединений наиболее широко применяются теория валентных связей
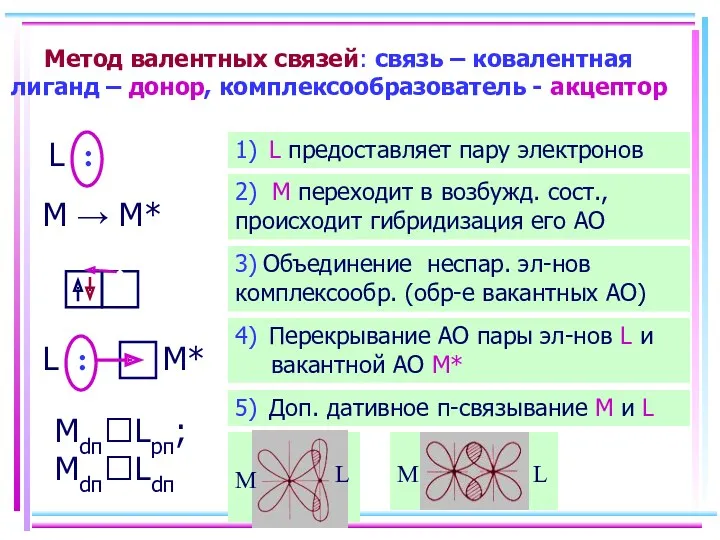
- 10. Метод валентных связей: связь – ковалентная лиганд – донор, комплексообразователь - акцептор L : M →
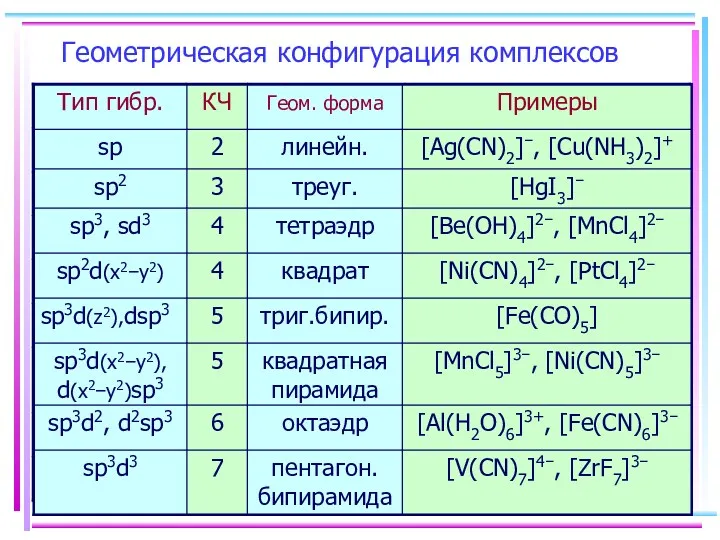
- 11. Геометрическая конфигурация комплексов
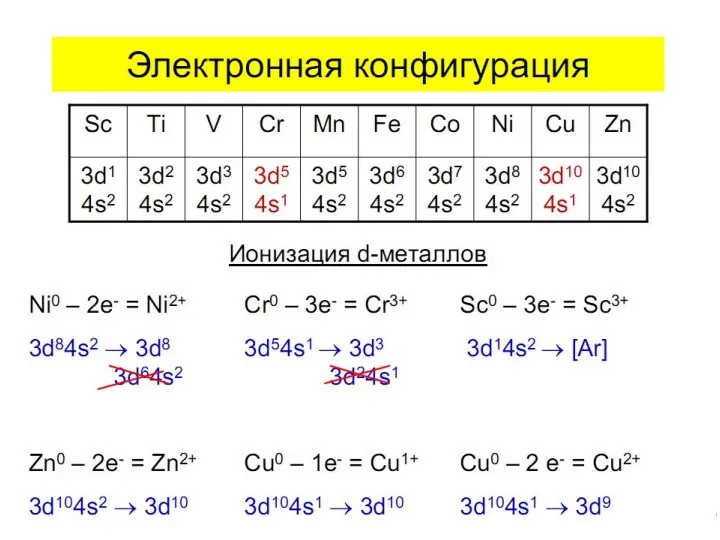
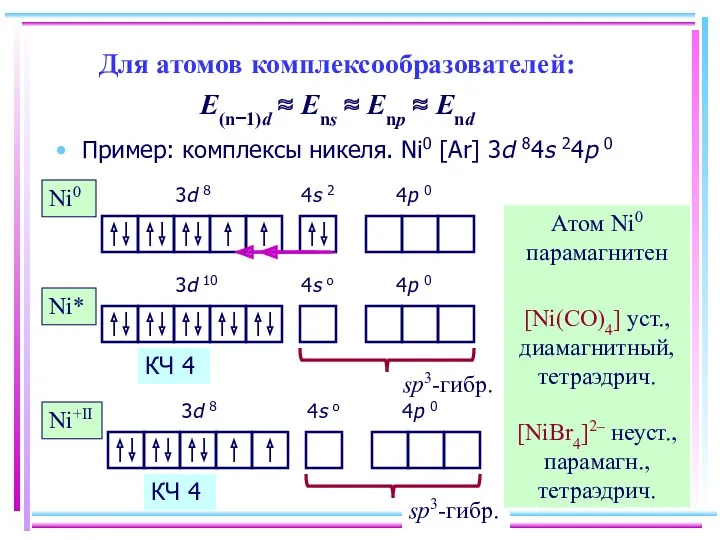
- 12. Для атомов комплексообразователей: E(n−1)d ≈ Ens ≈ Enp ≈ End Пример: комплексы никеля. Ni0 [Ar] 3d
- 13. Ni+II [Ni(CN)4]2– уст., диамагн., квадрат КЧ 4 [Ni(CN)5]3– уст., диамагн., квадратная пирамида КЧ 5 [Ni(H2O)6]2+, [Ni(NO2)6]4–
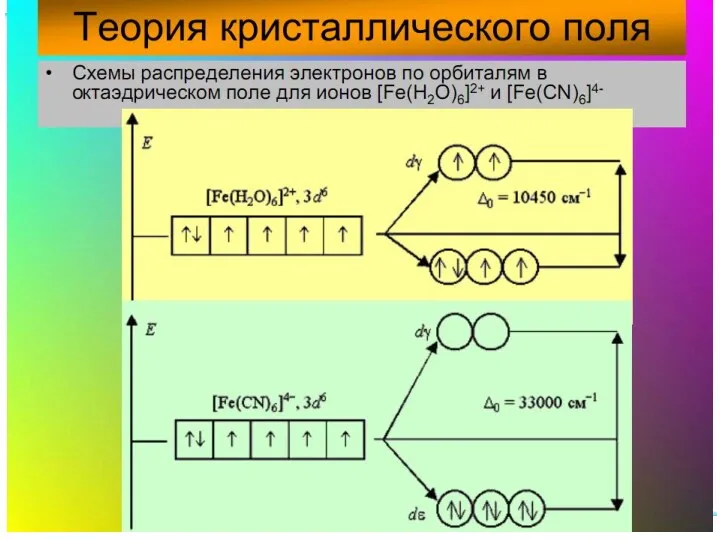
- 14. Fe+II [FeF6]4– уст., парамагн., октаэдр КЧ 6 Fe+II [Fe(CN)6]4– уст., диамагн., октаэдр КЧ 6
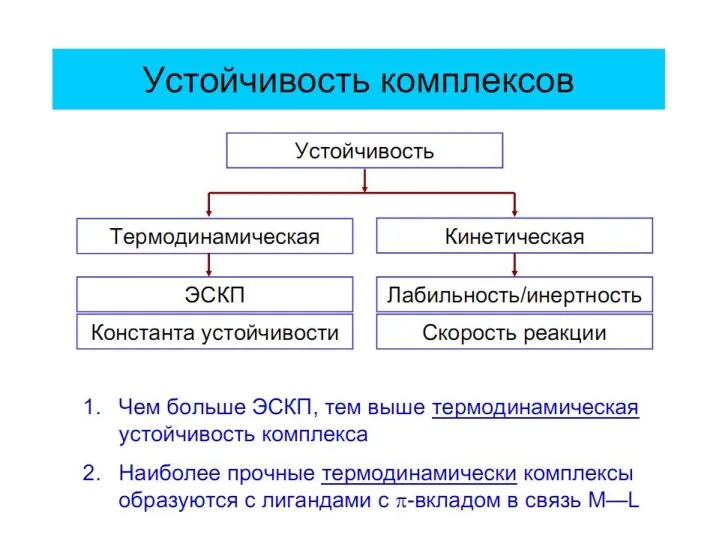
- 15. Ограничения МВС МВС объясняет геометрическое строение КС, но не дает ответа на вопрос, какой вид КС
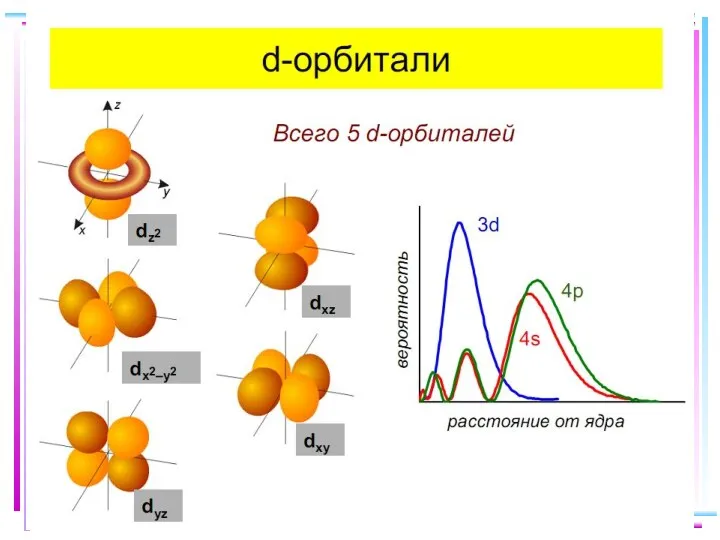
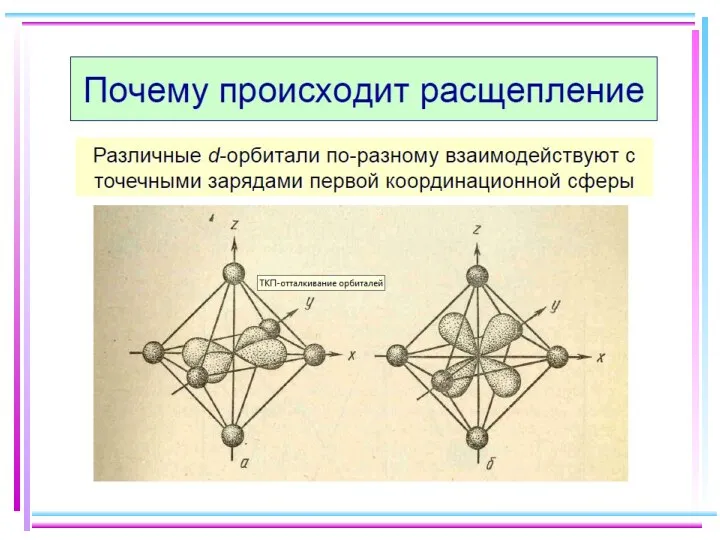
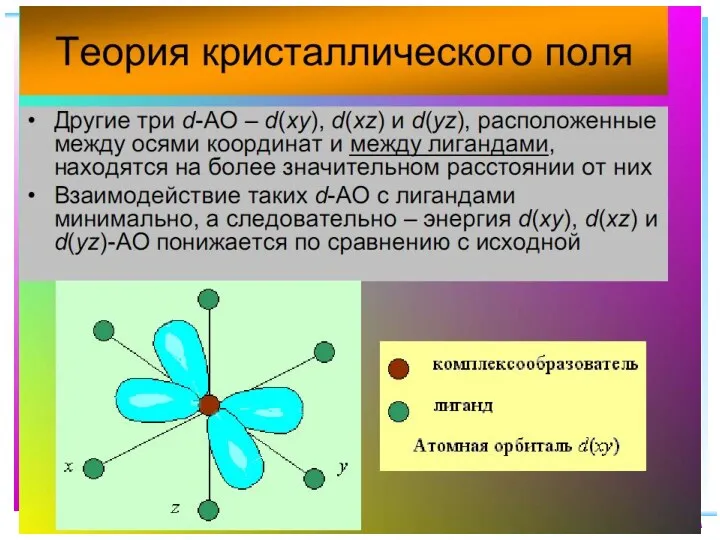
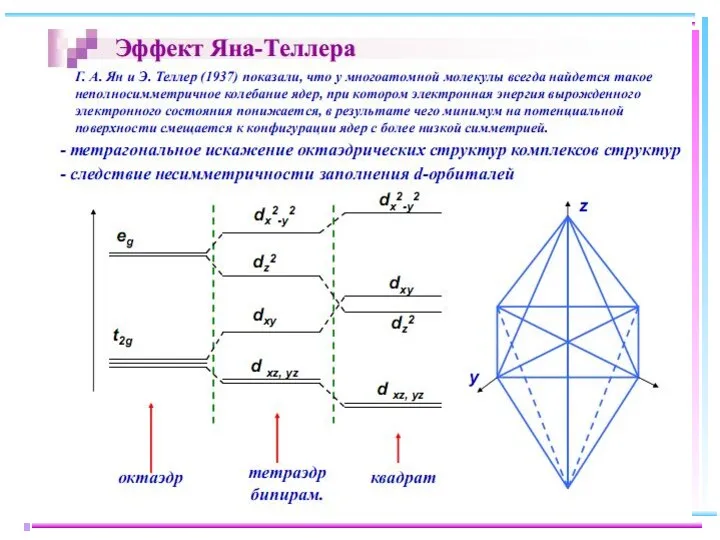
- 16. Основные положения теории кристаллического поля Связь Mе комплексообразователя (центр. атома) с лигандами L считается чисто ионной
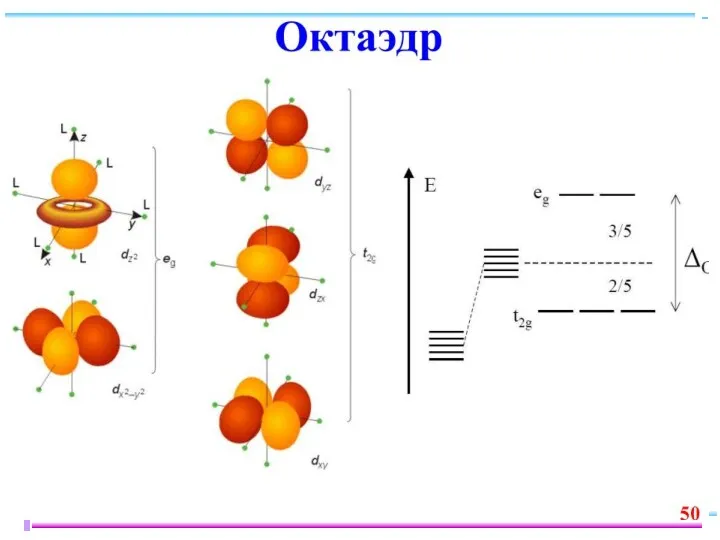
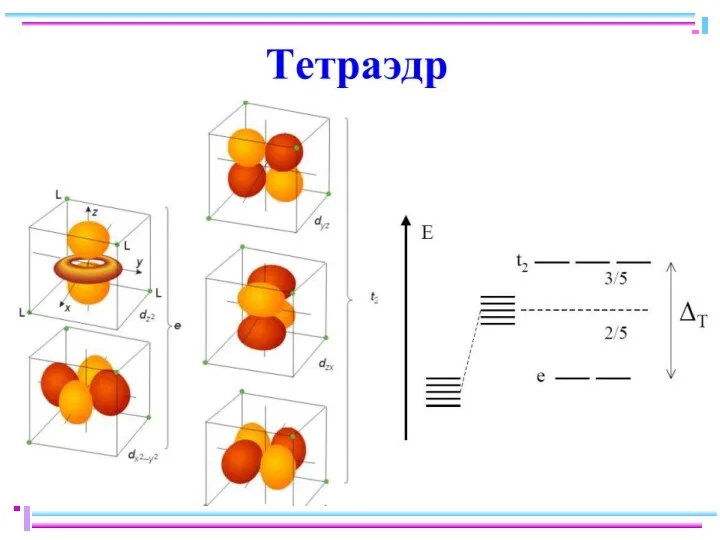
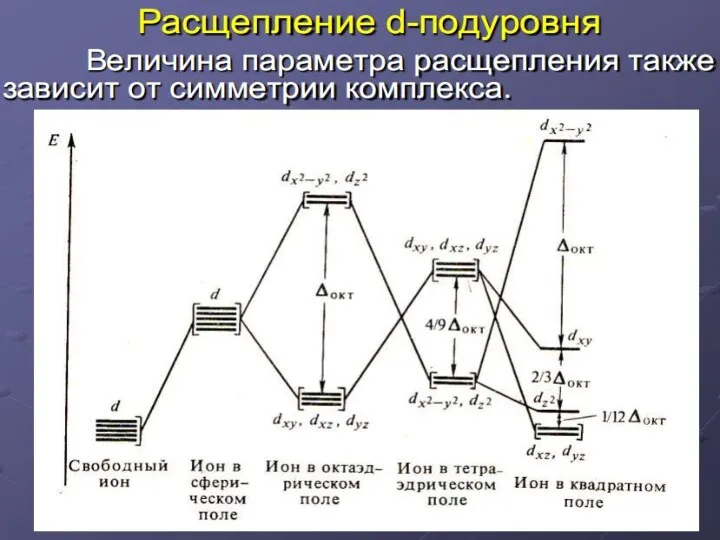
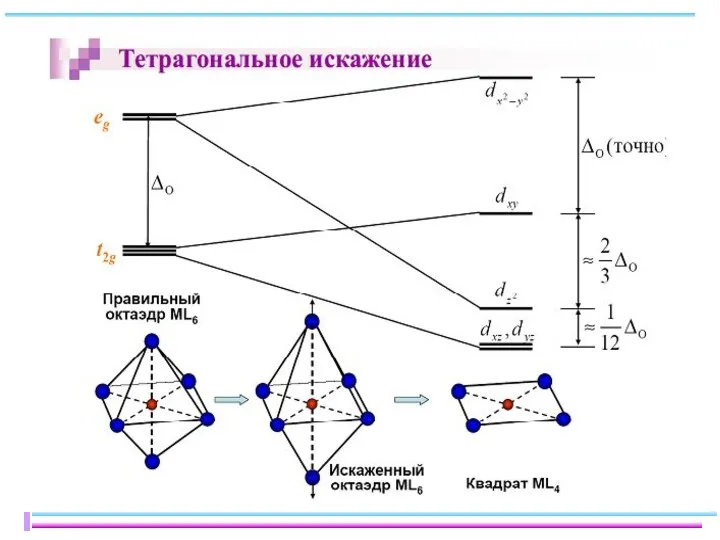
- 23. В случае [ML6]ν±,0 : октаэдрическое поле лигандов Поле слабо влияет (энергия падает) в случае d(xy), d(xz)
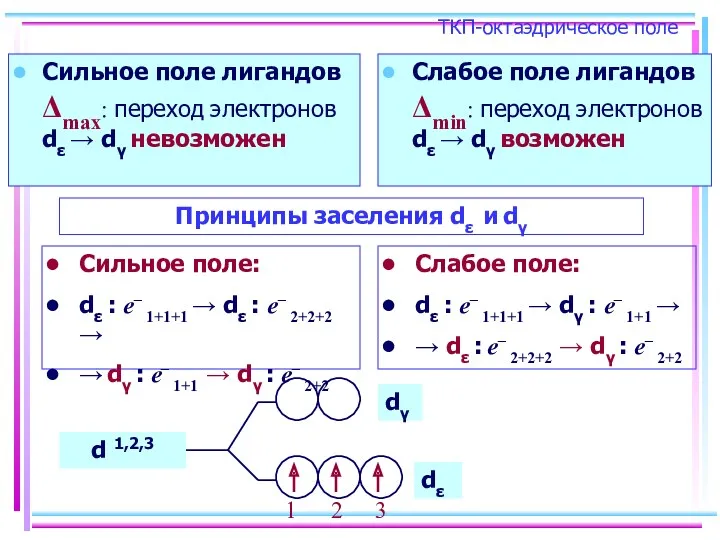
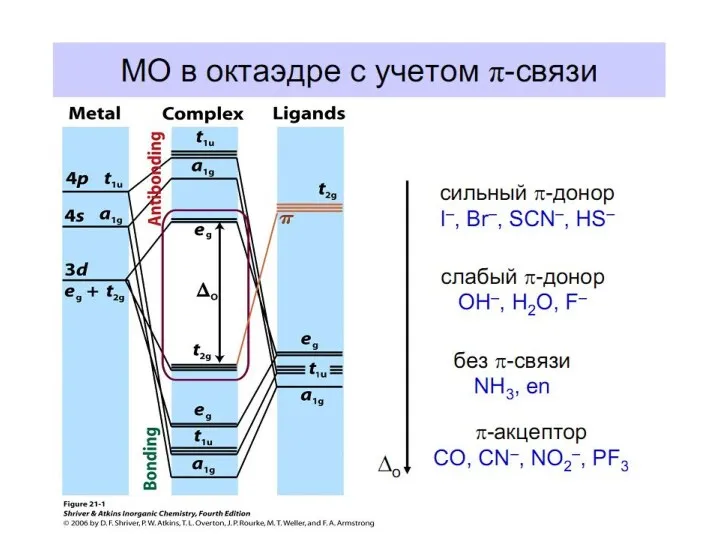
- 25. ТКП-октаэдрическое поле Сильное поле лигандов Δmax: переход электронов dε → dγ невозможен Слабое поле лигандов Δmin:
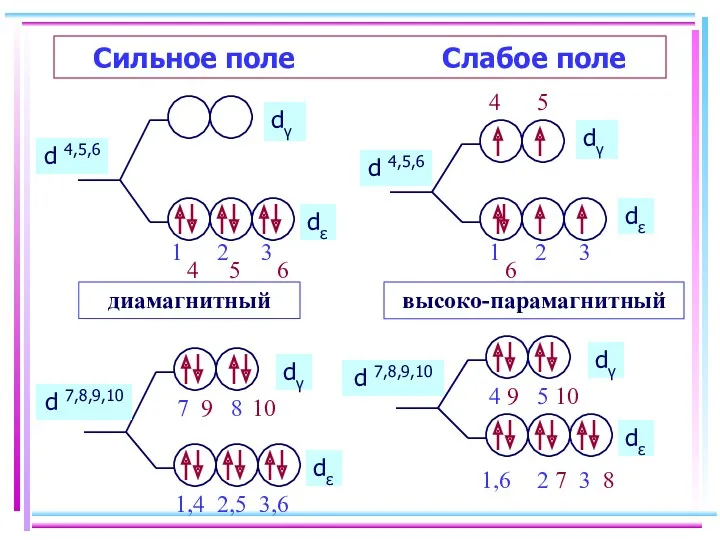
- 26. Сильное поле Слабое поле d 4,5,6 d 4,5,6 диамагнитный высоко-парамагнитный d 7,8,9,10 d 7,8,9,10
- 27. Параметр расщепления Δ и волновое число ν 1 см–1 соответствует ок. 12 Дж/моль Δ : 60
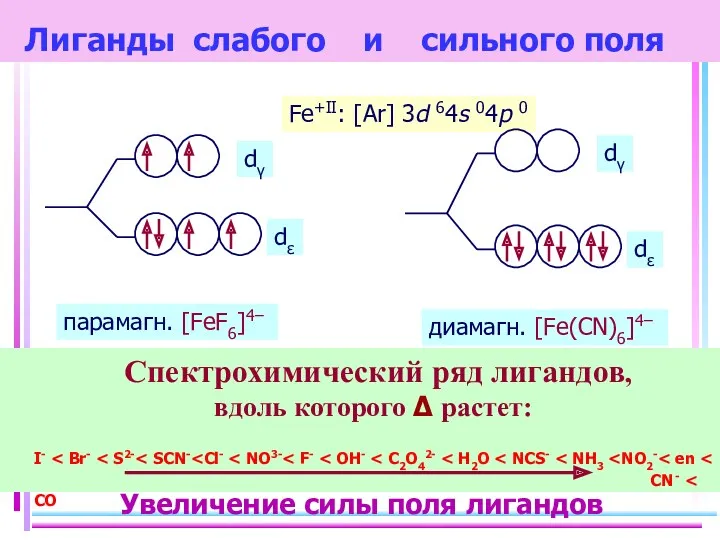
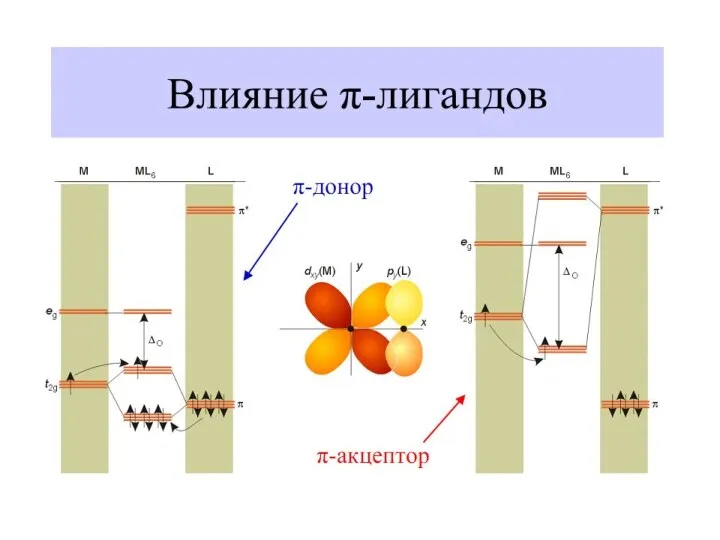
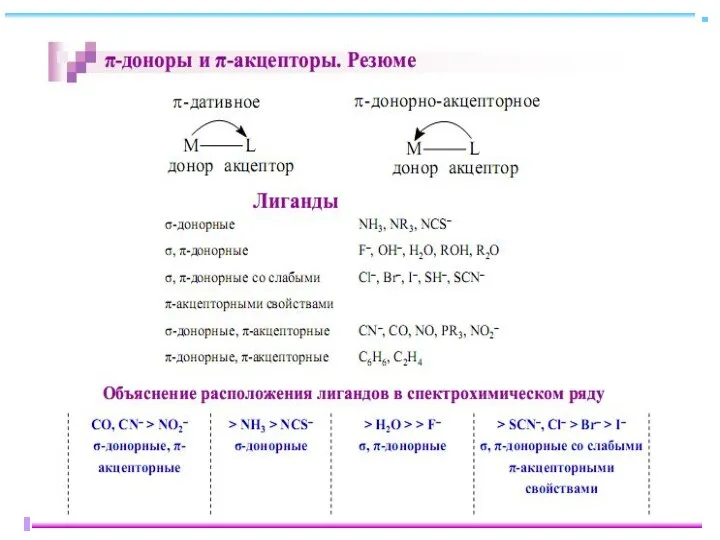
- 28. Лиганды слабого и сильного поля Спектрохимический ряд лигандов, вдоль которого Δ растет: I- CN- Fe+II: [Ar]
- 29. Реализация спиновых состояний у ионов с конфигурациями d4-d7
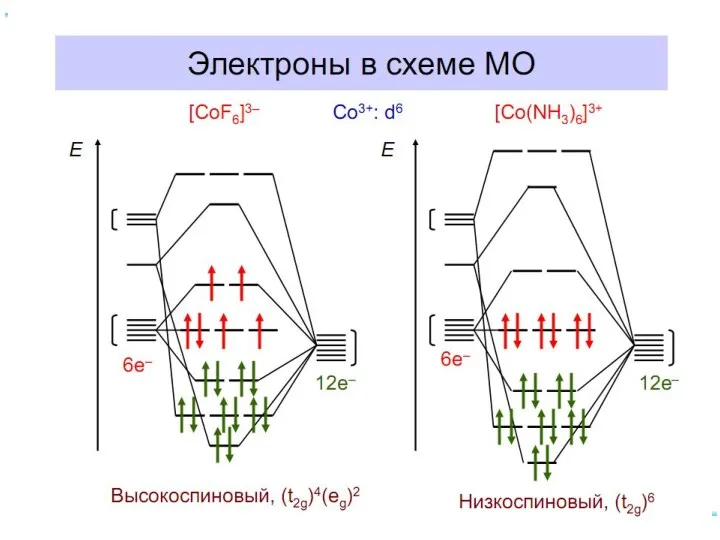
- 30. Электронное строение октаэдрических комплексных ионов [Co(NH3)6]3+ и [CoF6]3-.
- 31. Распределение d -электронов иона Со3+ в октаэдрических комплексах [CoF6] 3- и [Со(NН3)6]3+
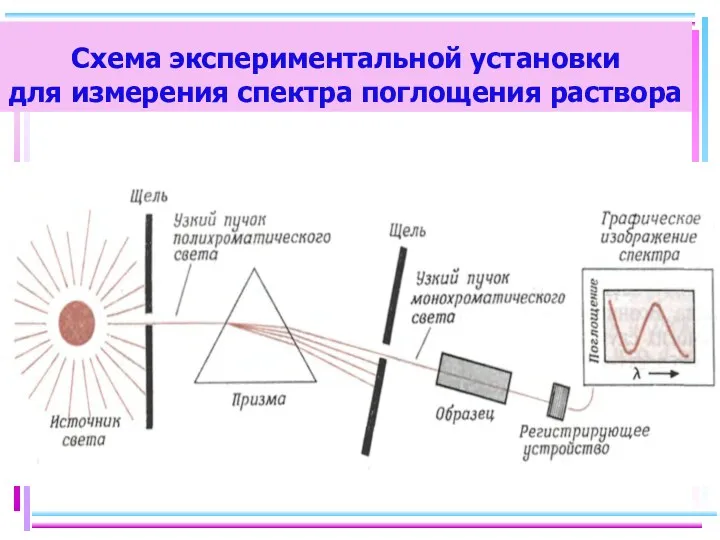
- 34. Схема экспериментальной установки для измерения спектра поглощения раствора
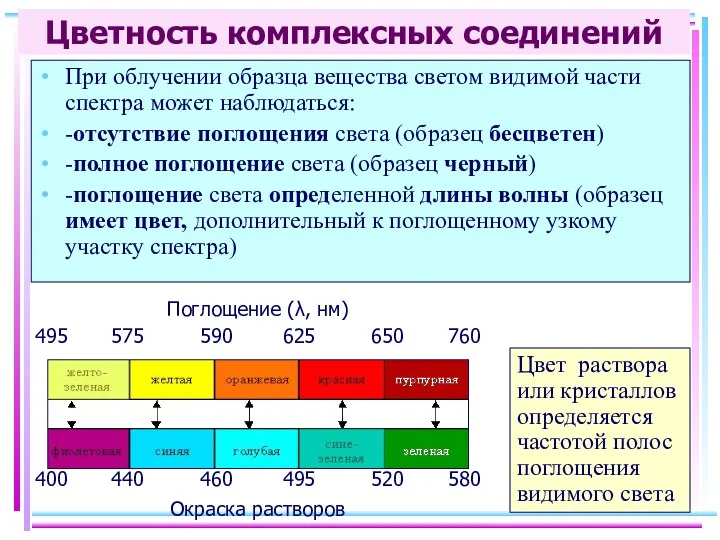
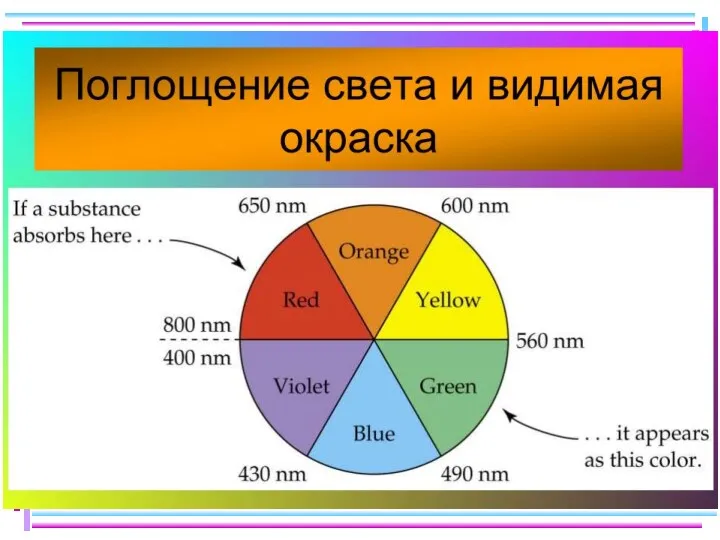
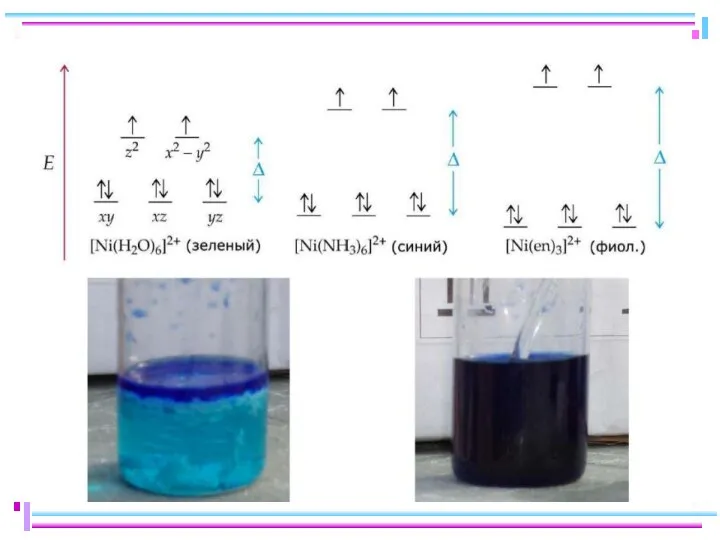
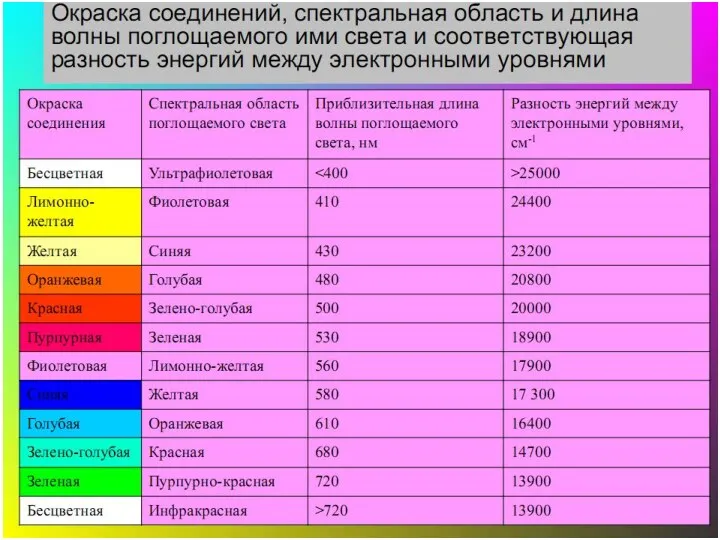
- 35. Цветность комплексных соединений При облучении образца вещества светом видимой части спектра может наблюдаться: -отсутствие поглощения света
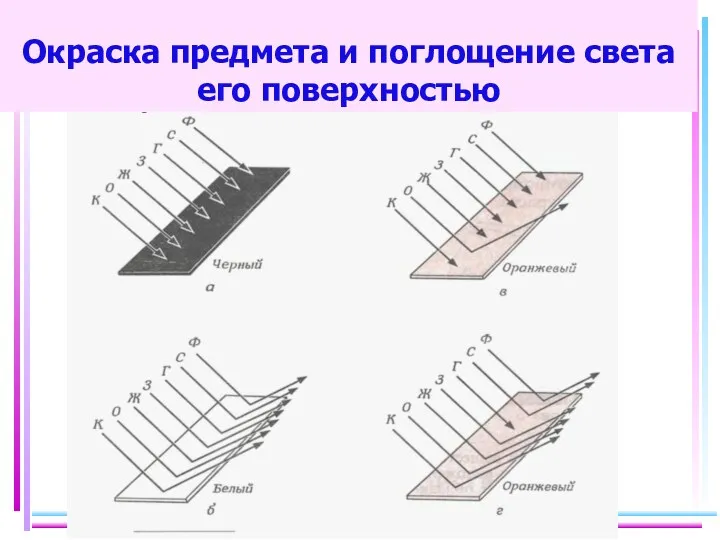
- 37. Окраска предмета и поглощение света его поверхностью
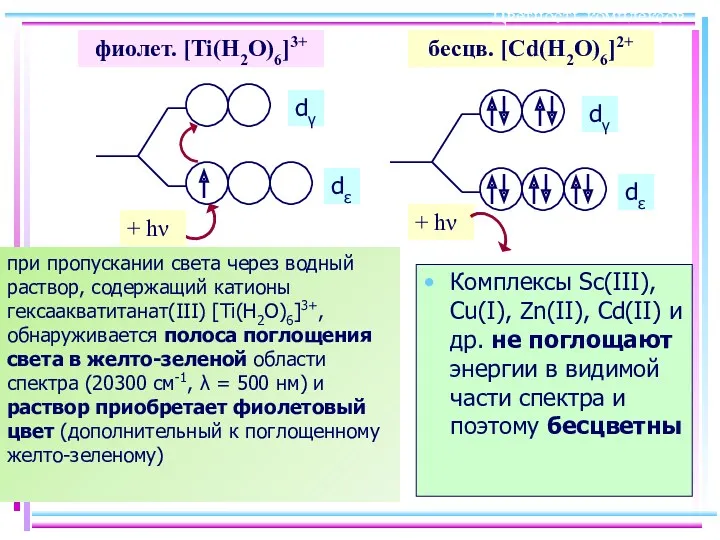
- 38. Цветность комплексов Комплексы Sc(III), Cu(I), Zn(II), Cd(II) и др. не поглощают энергии в видимой части спектра
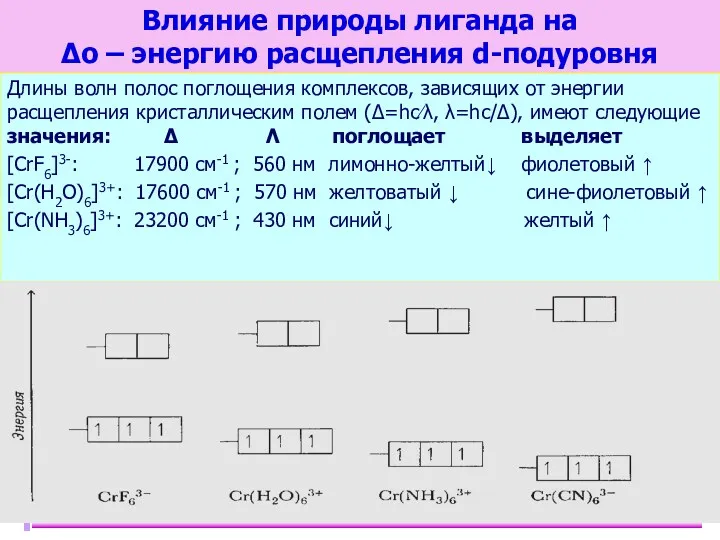
- 39. Влияние природы лиганда на Δо – энергию расщепления d-подуровня Длины волн полос поглощения комплексов, зависящих от
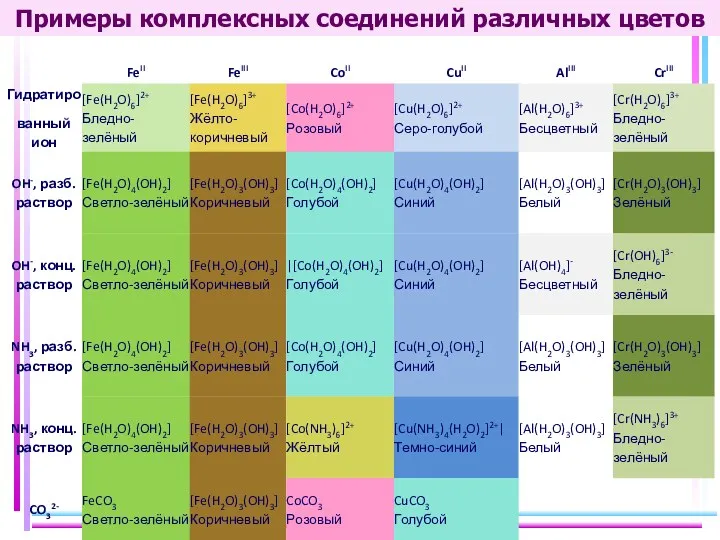
- 42. Примеры комплексных соединений различных цветов
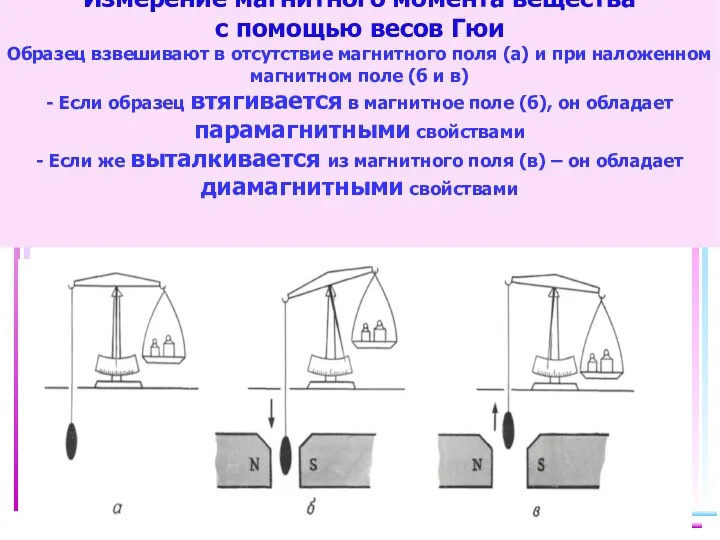
- 43. Измерение магнитного момента вещества с помощью весов Гюи Образец взвешивают в отсутствие магнитного поля (а) и
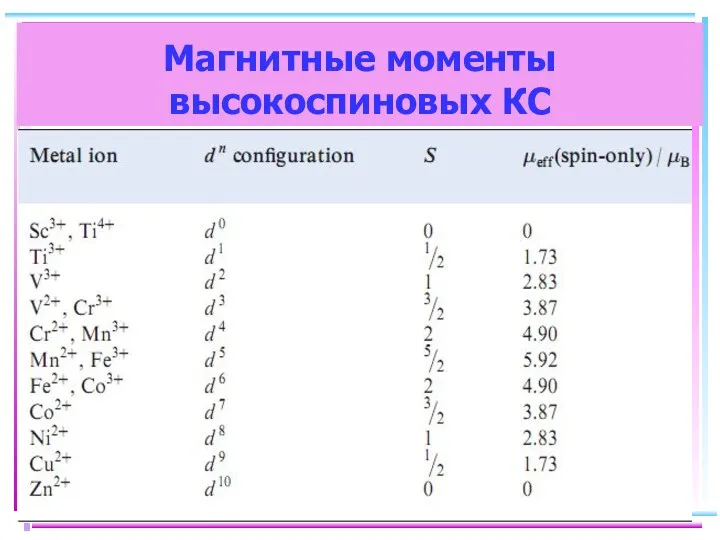
- 45. Магнитные моменты высокоспиновых КС
- 46. Энтальпия гидратации ионов [M(H2O)6]2+
- 47. ЭСКП двухзарядных ионов металлов в высокоспиновых комплексах [M(H2O)6]2+
- 48. Правило Сиджвика для определения состава комплексов Устойчивым является комплекс, в котором реализована 18-эл-ная оболочка из s-,
- 49. Правило Сиджвика (примеры) * 27Co0 [Ar]3d74s2 || 36Kr * 18 – 9 = 9e –; *
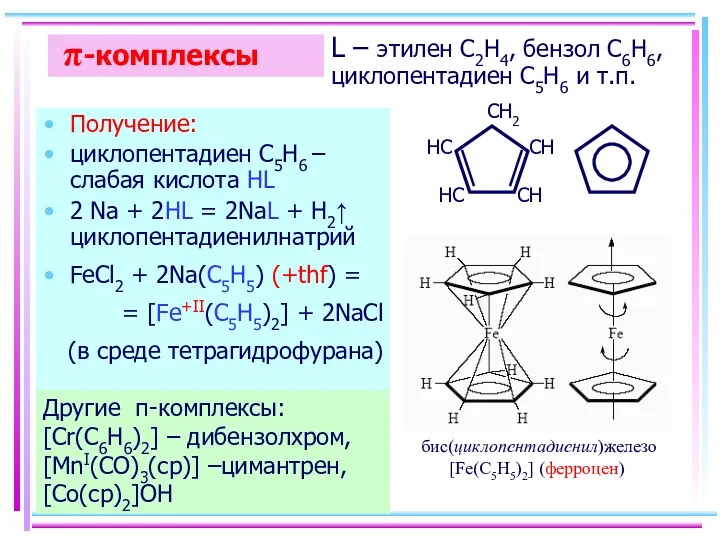
- 50. π-комплексы Получение: циклопентадиен С5H6 – слабая кислота HL 2 Na + 2HL = 2NaL + H2↑
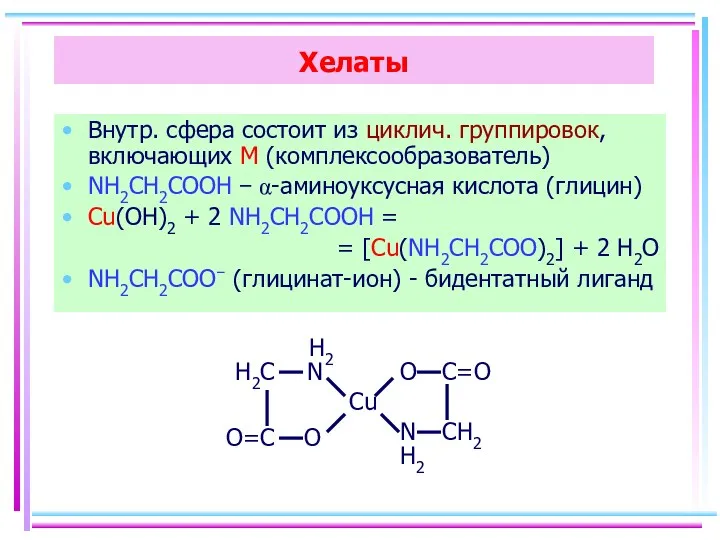
- 51. Хелаты Внутр. сфера состоит из циклич. группировок, включающих M (комплексообразователь) NH2CH2COOH − α-аминоуксусная кислота (глицин) Cu(OH)2
- 52. Реакция Чугаева Ni2+ + 2 NH3·H2O + 2H2L = = [Ni(HL)2](т) + 2NH4+ + 2H2O бис(диметилглиоксимато)никель(II)
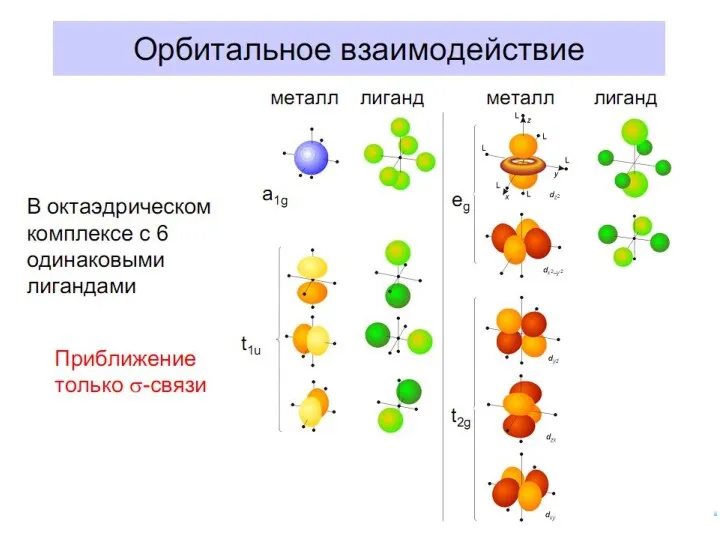
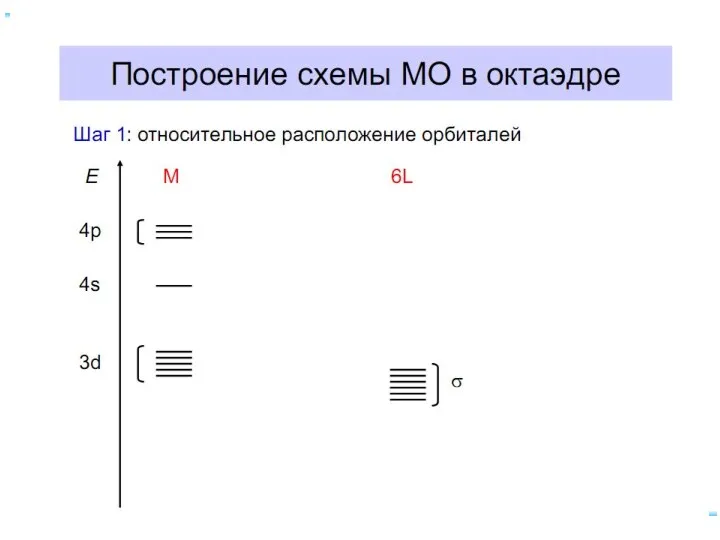
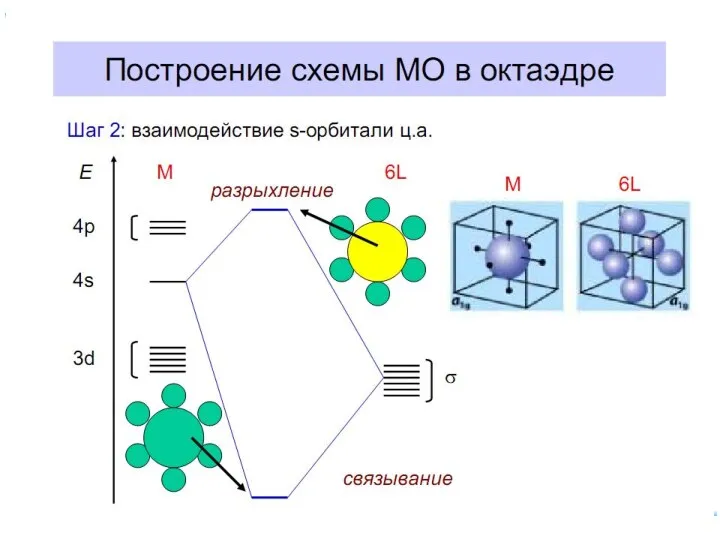
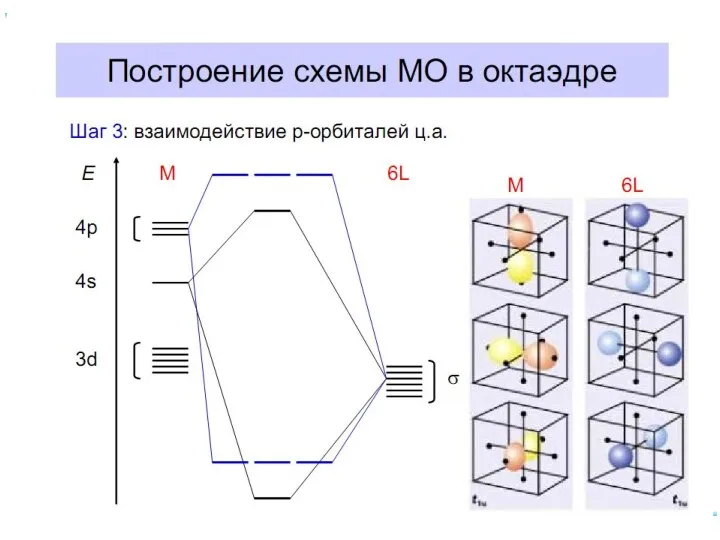
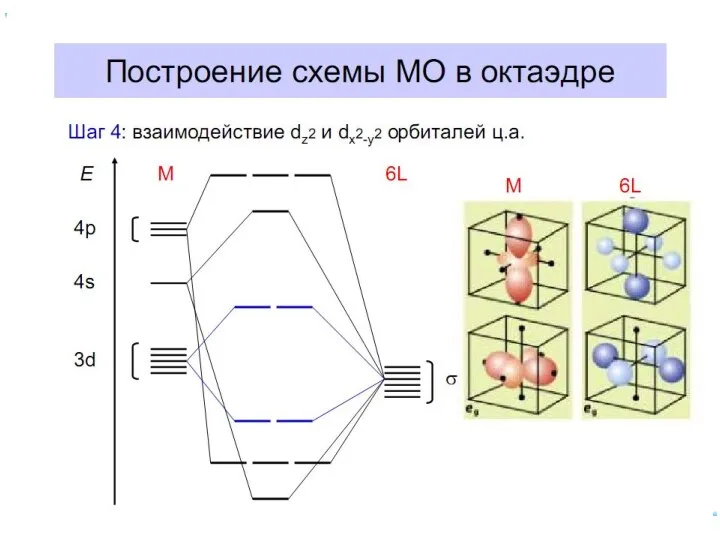
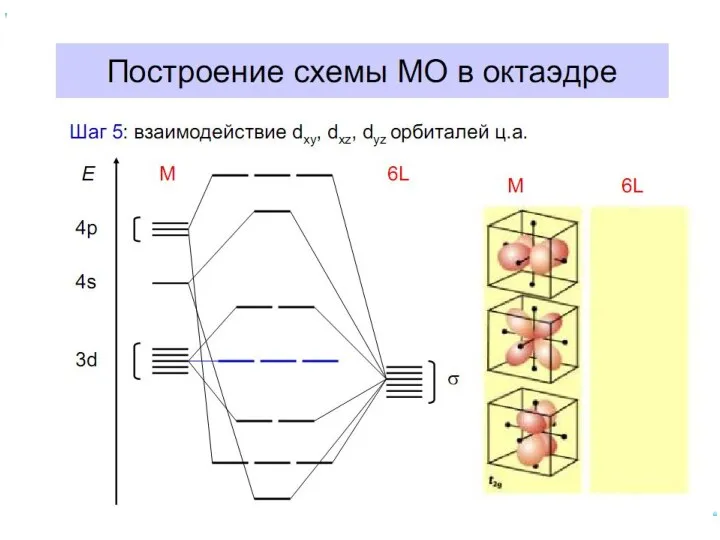
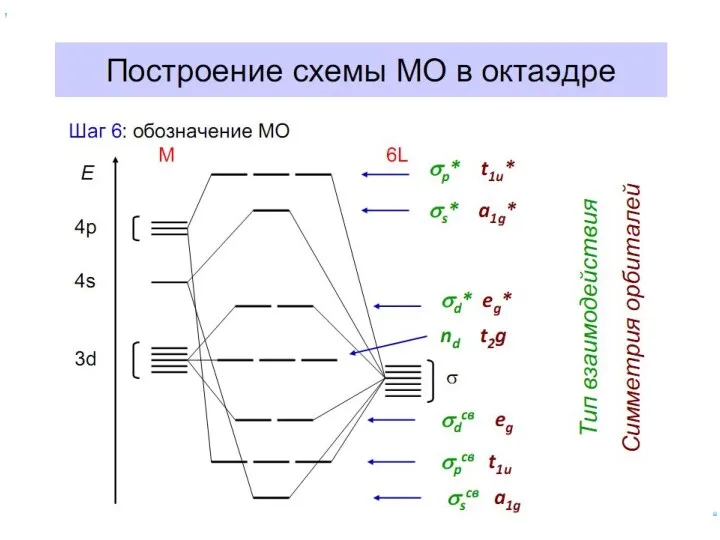
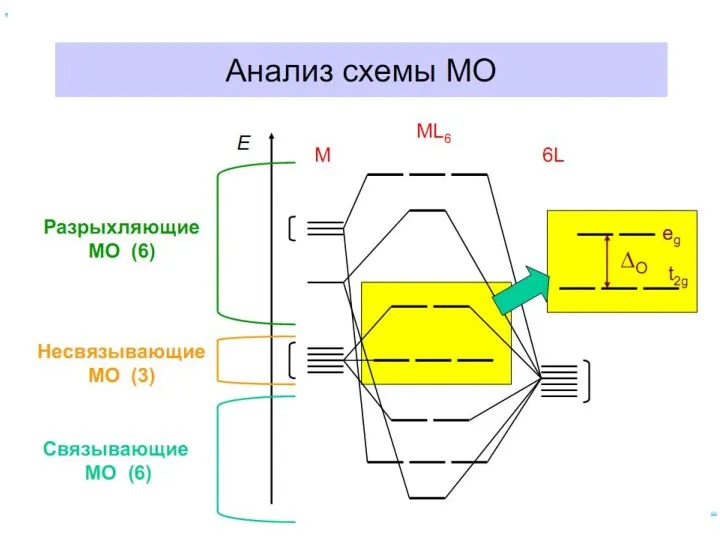
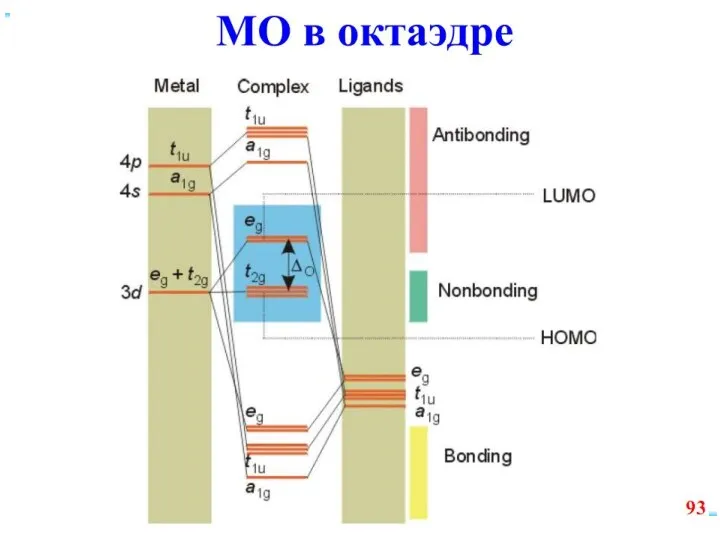
- 61. Построение схемы МО в октаэдре Общие принципы: 1. Центральный атом предоставляет 9 орбиталей– 5(n–1)d, 1ns, 3np(по
- 70. Построение схемы МО в октаэдре ИТАК, в октаэдрическом поле с 6-ю АО лигандов перекрываются 6 валентных
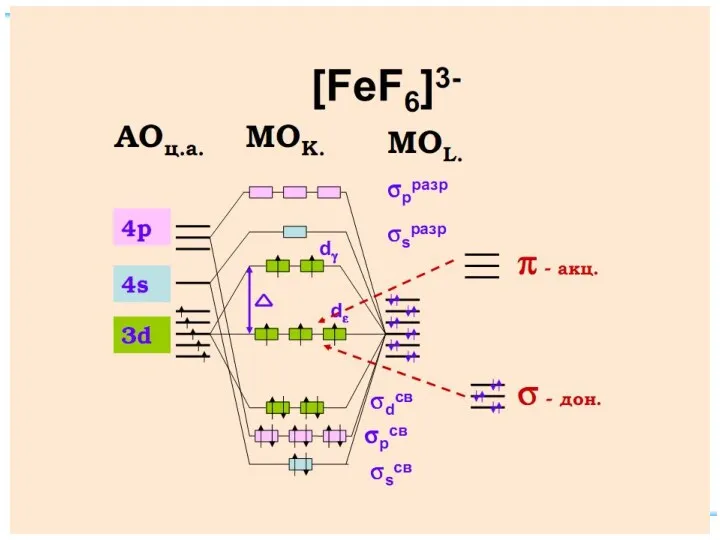
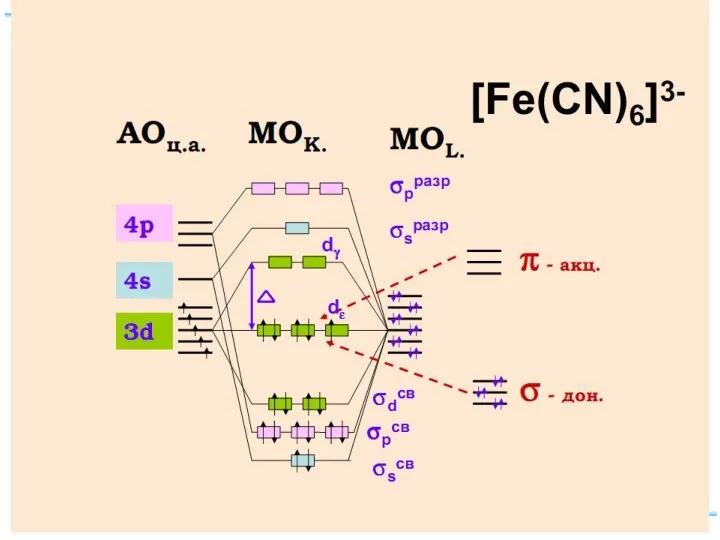
- 73. Энергетическая диаграмма МО для октаэдрических комплексов: высокоспинового [FeF6]4-(а) и низкоспинового [Fe(CN)6]4(б)
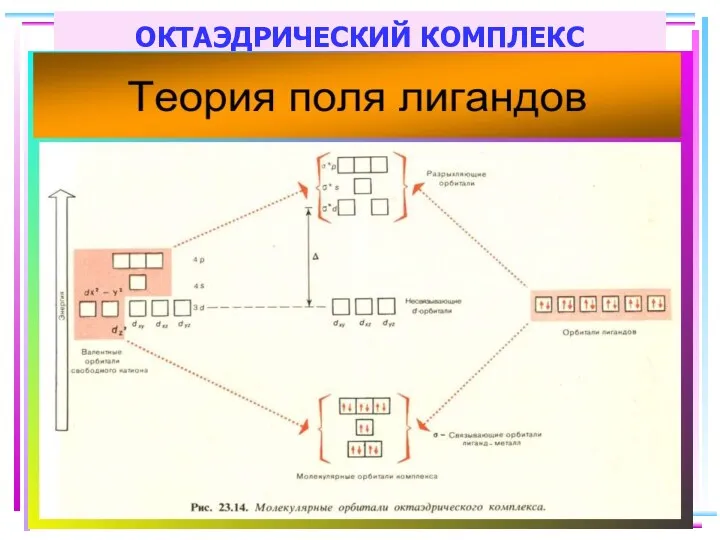
- 85. ОКТАЭДРИЧЕСКИЙ КОМПЛЕКС
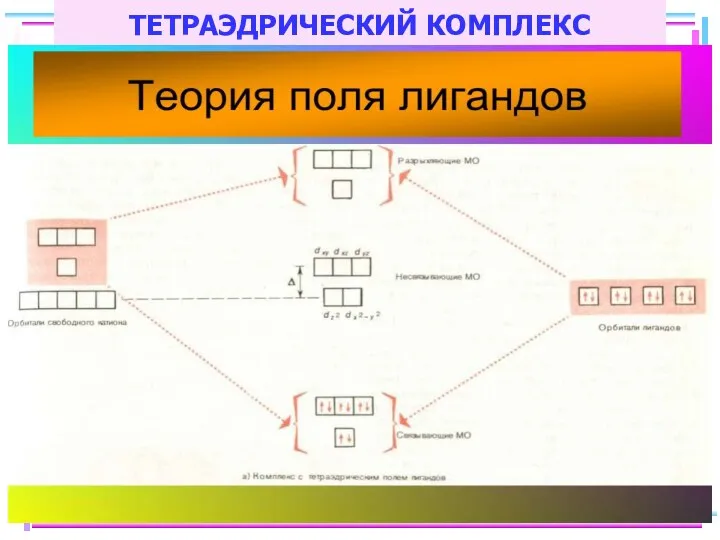
- 86. ТЕТРАЭДРИЧЕСКИЙ КОМПЛЕКС
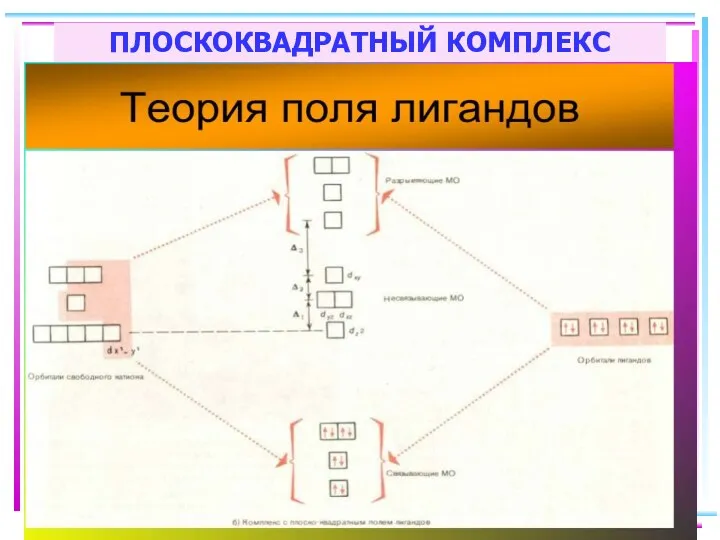
- 87. ПЛОСКОКВАДРАТНЫЙ КОМПЛЕКС
- 89. Скачать презентацию






![Ni+II [Ni(CN)4]2– уст., диамагн., квадрат КЧ 4 [Ni(CN)5]3– уст., диамагн.,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/379715/slide-12.jpg)
![Fe+II [FeF6]4– уст., парамагн., октаэдр КЧ 6 Fe+II [Fe(CN)6]4– уст., диамагн., октаэдр КЧ 6](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/379715/slide-13.jpg)



![В случае [ML6]ν±,0 : октаэдрическое поле лигандов Поле слабо влияет](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/379715/slide-22.jpg)



![Электронное строение октаэдрических комплексных ионов [Co(NH3)6]3+ и [CoF6]3-.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/379715/slide-29.jpg)
![Распределение d -электронов иона Со3+ в октаэдрических комплексах [CoF6] 3- и [Со(NН3)6]3+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/379715/slide-30.jpg)

![Энтальпия гидратации ионов [M(H2O)6]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/379715/slide-45.jpg)
![ЭСКП двухзарядных ионов металлов в высокоспиновых комплексах [M(H2O)6]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/379715/slide-46.jpg)

![Правило Сиджвика (примеры) * 27Co0 [Ar]3d74s2 || 36Kr * 18](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/379715/slide-48.jpg)
 + 2NH4+ + 2H2O бис(диметилглиоксимато)никель(II)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/379715/slide-51.jpg)





![Энергетическая диаграмма МО для октаэдрических комплексов: высокоспинового [FeF6]4-(а) и низкоспинового [Fe(CN)6]4(б)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/379715/slide-72.jpg)


 Классификация химических элементов
Классификация химических элементов Газовая хроматография
Газовая хроматография Тұнбалар мен қайнатпаларды алу принциптері
Тұнбалар мен қайнатпаларды алу принциптері План характеристики елемента за його положенням у періодичній системі та будовою атома
План характеристики елемента за його положенням у періодичній системі та будовою атома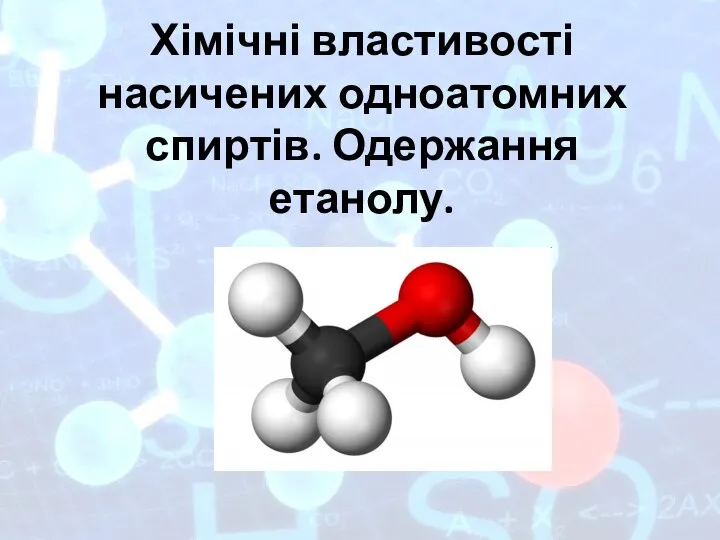 Хімічні властивості насичених одноатомних спиртів. Одержання етанолу
Хімічні властивості насичених одноатомних спиртів. Одержання етанолу Альдегиды, свойства, получение, применение
Альдегиды, свойства, получение, применение Камни и Лев
Камни и Лев Получение и свойства азота
Получение и свойства азота Крохмаль і целюлоза. Полімерна будова, властивості, застосування
Крохмаль і целюлоза. Полімерна будова, властивості, застосування Розділ 3. Теорія комплексних сполук. Комплексні сполуки
Розділ 3. Теорія комплексних сполук. Комплексні сполуки Вода. 8 класс
Вода. 8 класс Генетическая связь неорганических соединений
Генетическая связь неорганических соединений Хімічні явища в побуті
Хімічні явища в побуті Взаємодія кисню зі складними та простими речовинами. Урок 31. 7 клас
Взаємодія кисню зі складними та простими речовинами. Урок 31. 7 клас Structural revision of (+)-uprolide F diacetate confirmed by asymmetric total synthesis
Structural revision of (+)-uprolide F diacetate confirmed by asymmetric total synthesis Химия элементов
Химия элементов Granite
Granite Витамины молока и молочных продуктов. Жирорастворимые витамины
Витамины молока и молочных продуктов. Жирорастворимые витамины Знаки вторичной переработки
Знаки вторичной переработки Введение в химическую термодинамику
Введение в химическую термодинамику Сложные углеводы. Олигосахариды и полисахариды
Сложные углеводы. Олигосахариды и полисахариды Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3
Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3 Алюминий и его соединения
Алюминий и его соединения Группа веществ, изолируемых из биологического объекта путём минерализации (Металлические яды)
Группа веществ, изолируемых из биологического объекта путём минерализации (Металлические яды) Аммиак. Состав. Строение
Аммиак. Состав. Строение Химическая промышленность
Химическая промышленность Дисперсні системи
Дисперсні системи Типовые процессы технологии неорганических веществ. (Тема 3)
Типовые процессы технологии неорганических веществ. (Тема 3)