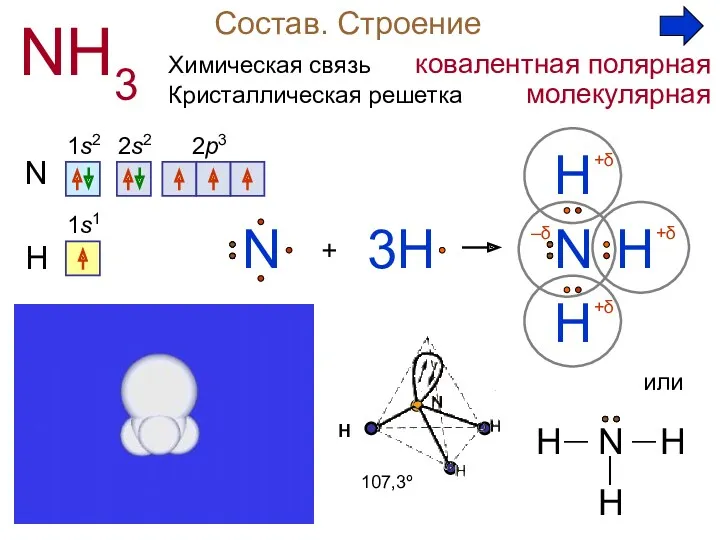
1. Химическая связь в молекуле аммиака:
А) ионная; Б) ковалентная полярная;
В) ковалентная неполярная.
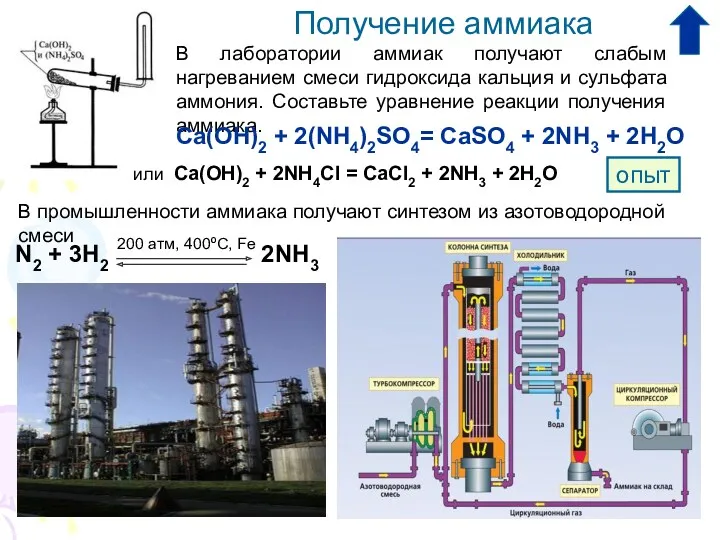
2. Каким способом получают аммиак в лаборатории:
А) прямым синтезом из азота и водорода;
Б) термическим разложением солей аммония;
В) взаимодействием солей аммония со щелочами.
3. Как можно различить хлорид аммония и хлорид натрия:
А) по запаху; Б) по действию нитрата серебра;
В) по действию щелочи при нагревании.
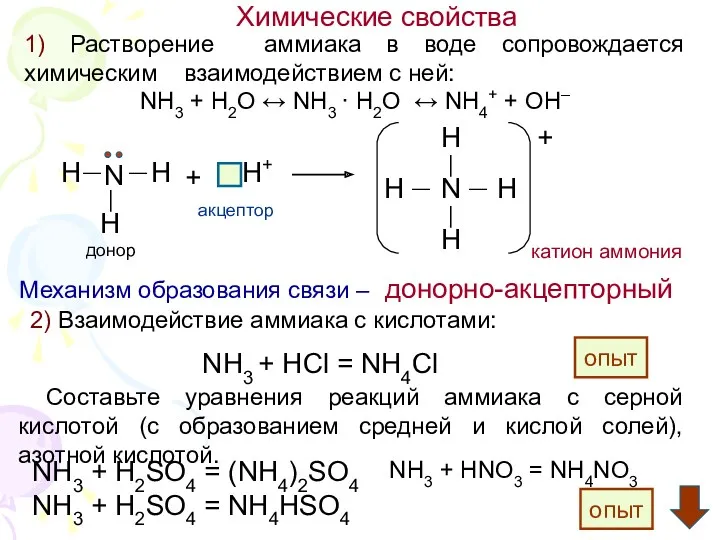
4. Водный раствор аммиака не реагирует:
А) с соляной кислотой; Б) с гидроксидом кальция; В) с водой.
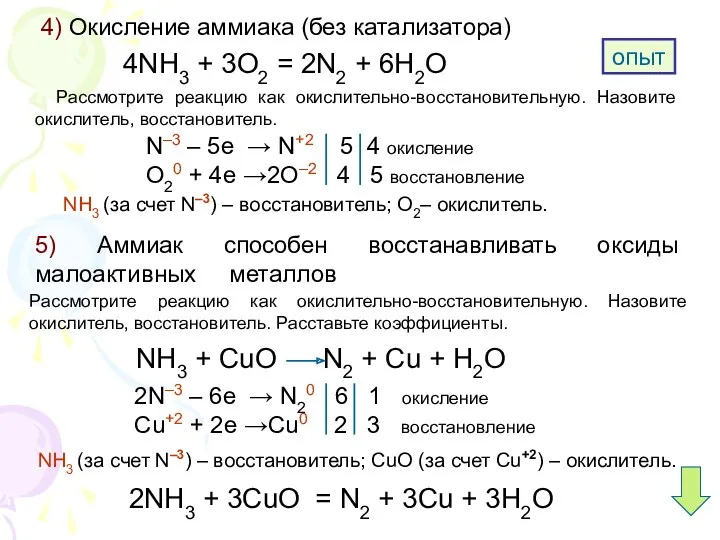
5. Аммиак способен окисляться до свободного азота:
А) без катализатора; Б) при повышенном давлении; В) с катализатором.
6. Механизм образования иона (катиона) аммония:
А) донорно-акцепторный; Б) ионный; В) радикальный;
7. Уравнению реакции NaOH + NH4Cl = NaCl + NH3 + H2O
cоответствует краткое ионное:
А) NH4+ + H+ = NН4+ Б) NH4+= NН3+ Н+ В) NH4+ + OH¯ = NH3 + H2O
Б
В
В
Б
А
А
В











 Составление уравнений ОВР
Составление уравнений ОВР Нахождение массовой доли
Нахождение массовой доли Химия s-элементов. Общая характеристика
Химия s-элементов. Общая характеристика Химия металлов: влияние металлов на организм человека
Химия металлов: влияние металлов на организм человека Новое направление в бизнесе компании – катализаторы синтеза метанола
Новое направление в бизнесе компании – катализаторы синтеза метанола Жидкостная экстракция
Жидкостная экстракция Прикладные аспекты химии поверхностно-активных веществ
Прикладные аспекты химии поверхностно-активных веществ ферментер
ферментер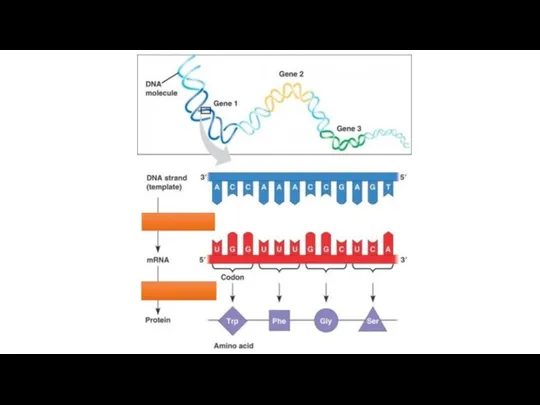 The translation and transcription
The translation and transcription Фосфор. Урок в 9 классе
Фосфор. Урок в 9 классе Теплові прояви механічної, електричної та хімічної енергії
Теплові прояви механічної, електричної та хімічної енергії Рентгеноструктуралық анализ. Лауе тәжірибесі, Брегг-Вульф теңдеуі, оны шығару жолдары
Рентгеноструктуралық анализ. Лауе тәжірибесі, Брегг-Вульф теңдеуі, оны шығару жолдары Обмен липидов
Обмен липидов Серная кислота
Серная кислота Электрохимия. Электродные потенциалы. Электродвижущие силы. Электролиз
Электрохимия. Электродные потенциалы. Электродвижущие силы. Электролиз Галогены
Галогены Простые вещества
Простые вещества Три правила взаимодействия элементов симметрии
Три правила взаимодействия элементов симметрии Нефть и продукты её переработки
Нефть и продукты её переработки Реактор получения элементарной серы
Реактор получения элементарной серы Дисперсные системы. Растворы
Дисперсные системы. Растворы Водород. Химический знак - H
Водород. Химический знак - H Химические свойства и получение алканов
Химические свойства и получение алканов Методы разделения и концентрирования органических соединений. Сорбционные методы. (Лекция 3)
Методы разделения и концентрирования органических соединений. Сорбционные методы. (Лекция 3) Поверхностно-активные вещества (ПАВ)
Поверхностно-активные вещества (ПАВ) Химическая связь. Природа химической связи
Химическая связь. Природа химической связи Валентність хімічних елементів
Валентність хімічних елементів Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества