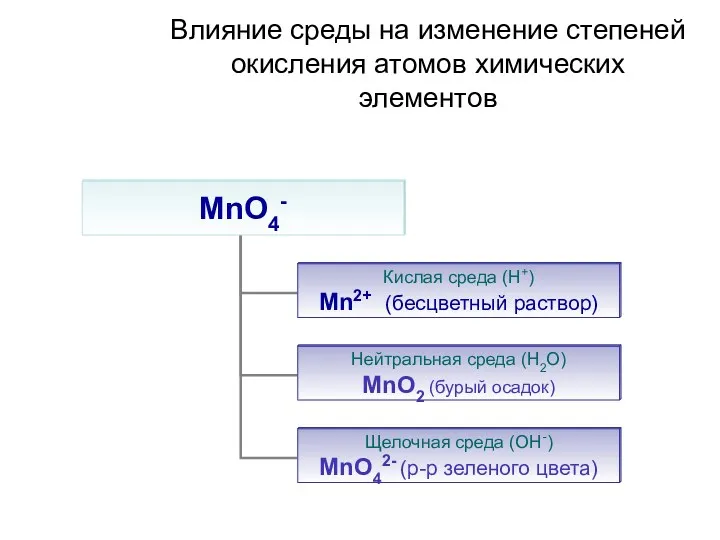
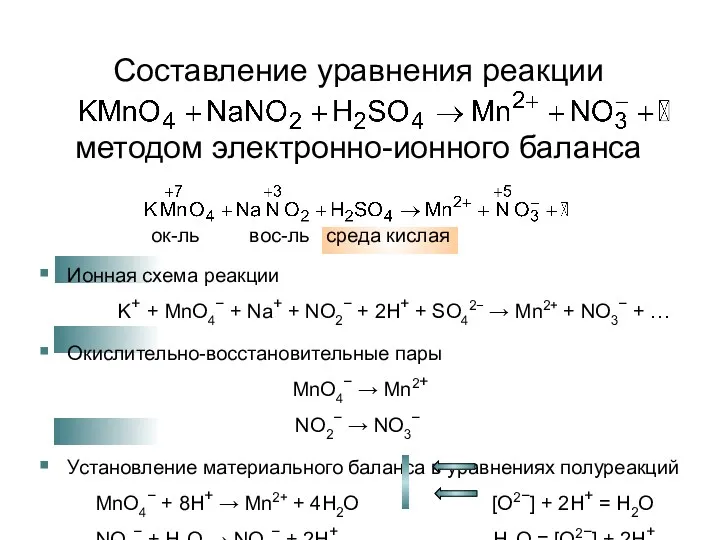
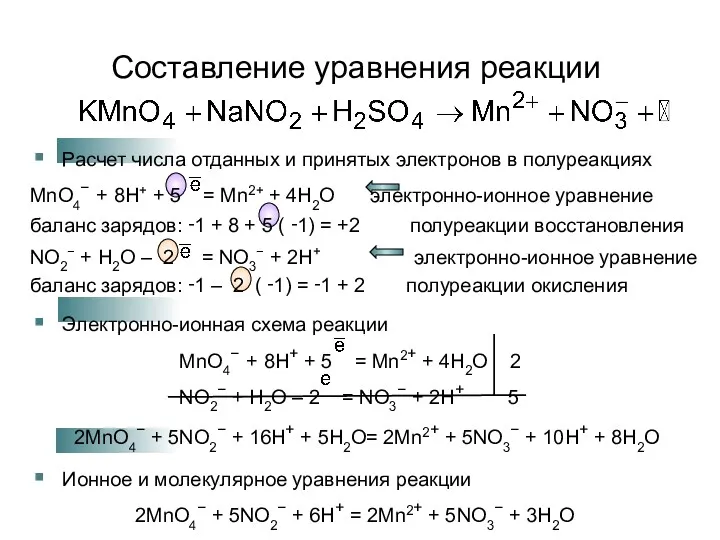
Расчет числа отданных и принятых электронов в полуреакциях
MnO4− +
8H+ + 5 = Mn2+ + 4H2O электронно-ионное уравнение
баланс зарядов: ‑1 + 8 + 5 ( ‑1) = +2 полуреакции восстановления
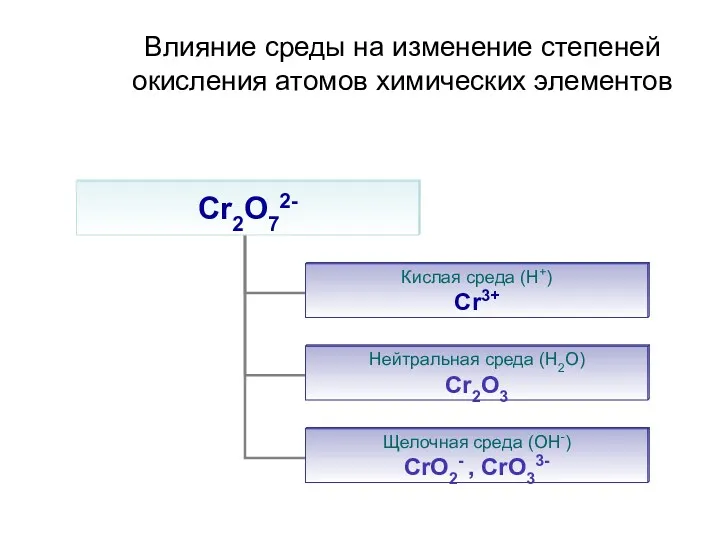
NO2− + H2O – 2 = NO3− + 2H+ электронно-ионное уравнение
баланс зарядов: ‑1 – 2 ( ‑1) = ‑1 + 2 полуреакции окисления
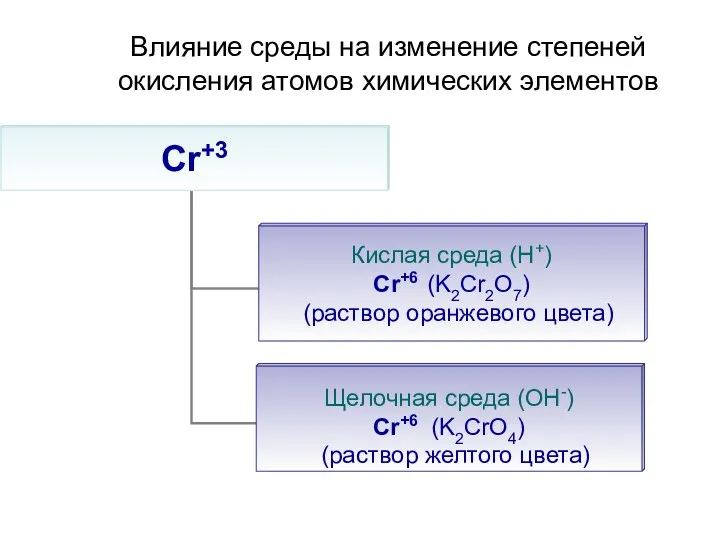
Электронно-ионная схема реакции
MnO4− + 8H+ + 5 = Mn2+ + 4H2O 2
NO2− + H2O – 2 = NO3− + 2H+ 5
2MnO4− + 5NO2− + 16H+ + 5H2O= 2Mn2+ + 5NO3− + 10H+ + 8H2O
Ионное и молекулярное уравнения реакции
2MnO4− + 5NO2− + 6H+ = 2Mn2+ + 5NO3− + 3H2O
2KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
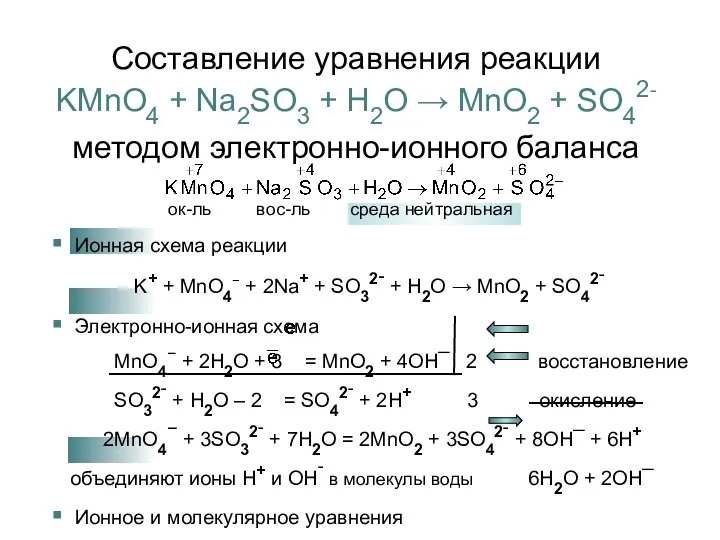
Составление уравнения реакции

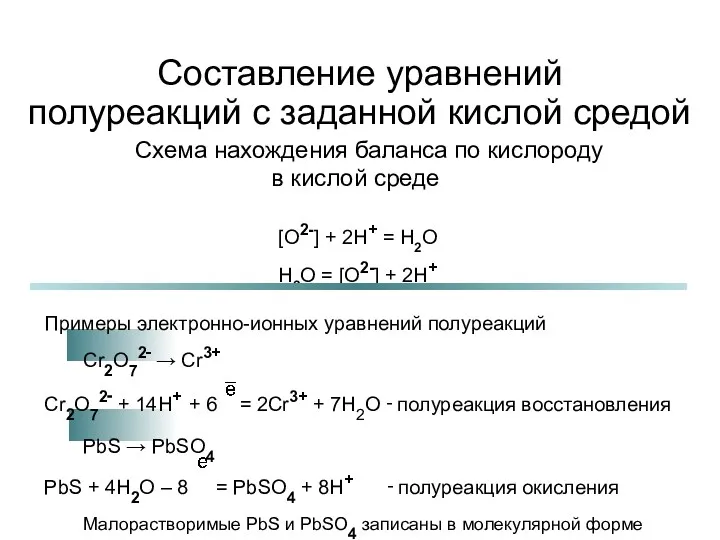
![Схема нахождения баланса по кислороду в щелочной среде [O2-] +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/590667/slide-8.jpg)

![Схема нахождения баланса по кислороду в нейтральной среде [O2-] +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/590667/slide-10.jpg)
 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей