Содержание
- 2. 1.Виды химической связи: ковалентные связи (полярная , неполярная) ионная металлическая водородная 2. степень окисление элементов. План
- 3. 1. ХИМИЧЕСКАЯ СВЯЗЬ «Под химической связью следует понимать силу, удерживающую атомы друг около друга в молекулах,
- 4. 2. ПОЧЕМУ ОБРАЗУЕТСЯ ХИМИЧЕСКАЯ СВЯЗЬ? Ответ вытекает из следующего термодина-мического принципа: «минимуму энергии системы соответствует максимум
- 5. 3. ПРИРОДА ХИМИЧЕСКОЙ СВЯЗИ Главная роль в образовании химических связей принадлежит электронам внешней оболочки, так называемым
- 6. ПРАВИЛО ОКТЕТА (Льюис, 1875-1946) При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную) внешнюю
- 7. ОБРАЗОВАНИЕ ОКТЕТА Cl· + ·Cl ׃ → ׃Cl ׃ Cl ׃ . . . . Na·
- 8. С В О Й С Т В А Х И М И Ч Е С К
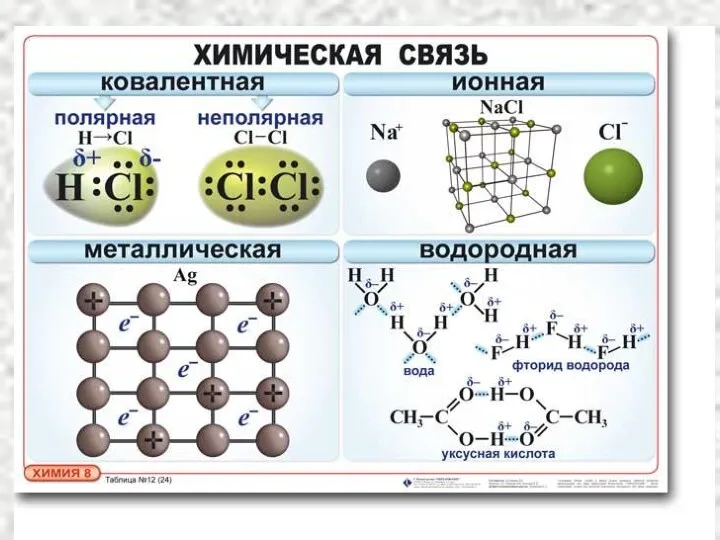
- 9. ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ Ионная Ковалентная (полярная и неполярная; по обменному и донорно-акцепторному механизмам), Металлическая. ОСНОВНЫЕ ТИПЫ:
- 10. Ионная химическая связь -электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении. Такая связь возникает
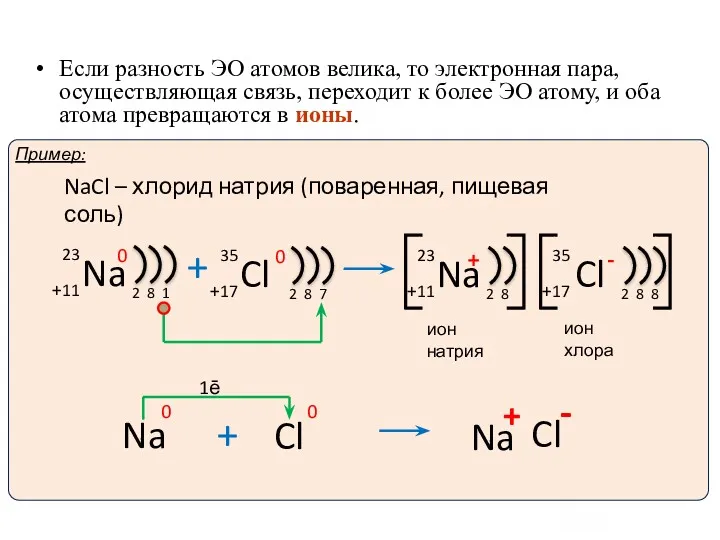
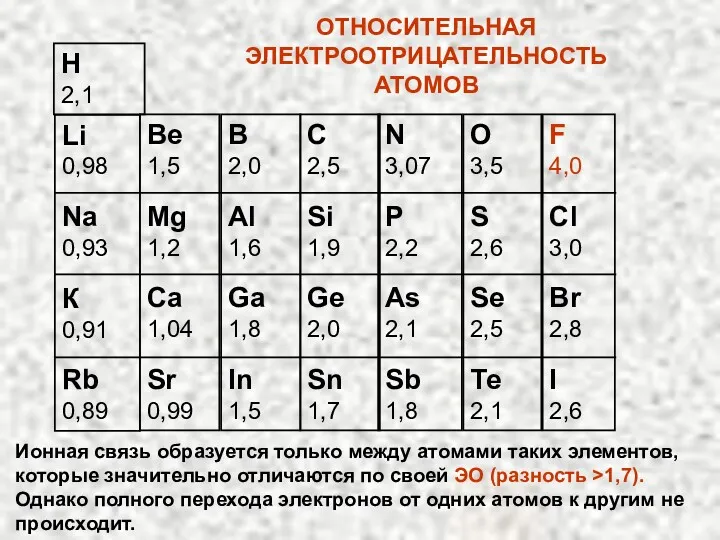
- 11. Ионы и ионная химическая связь. 1ē Если разность ЭО атомов велика, то электронная пара, осуществляющая связь,
- 12. Li 0,98 Na 0,93 К 0,91 Rb 0,89 Be 1,5 Mg 1,2 Ca 1,04 Sr 0,99
- 13. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ Определить разность относительных электро-отрицательностей атомов для связей Н — О и О —
- 14. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ Р е ш е н и е 1. По данным табл. ЭО вычисляем
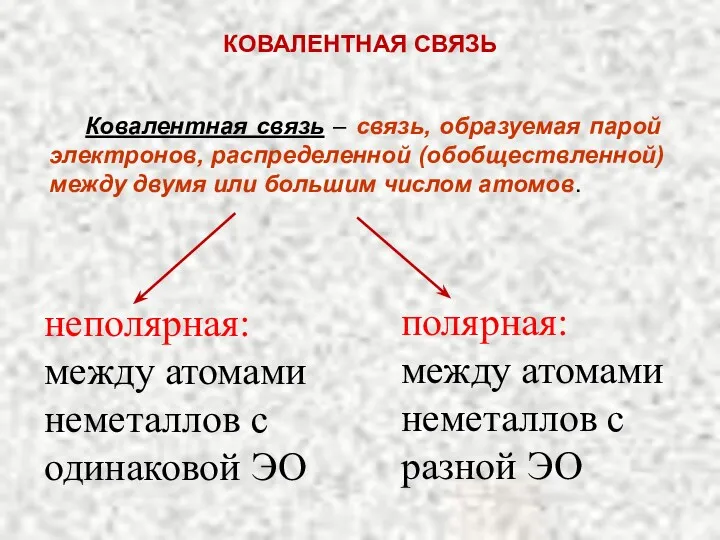
- 15. Ковалентная связь – связь, образуемая парой электронов, распределенной (обобществленной) между двумя или большим числом атомов. КОВАЛЕНТНАЯ
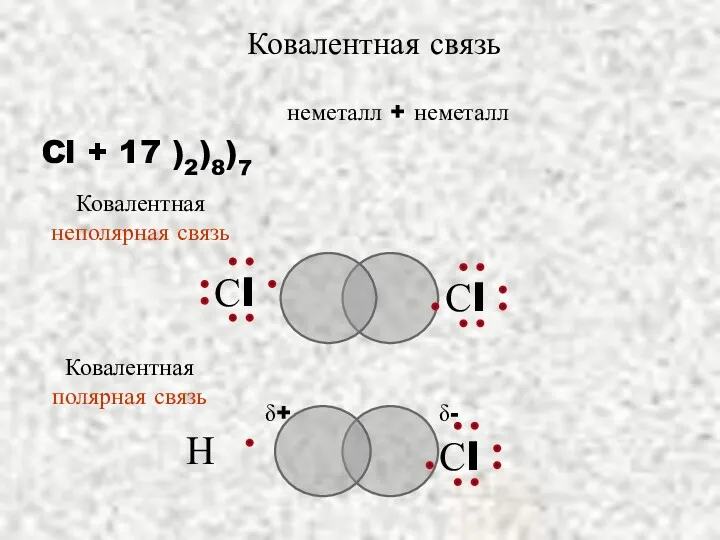
- 16. неметалл + неметалл Cl + 17 )2)8)7 Ковалентная связь δ+ δ- Ковалентная полярная связь Ковалентная неполярная
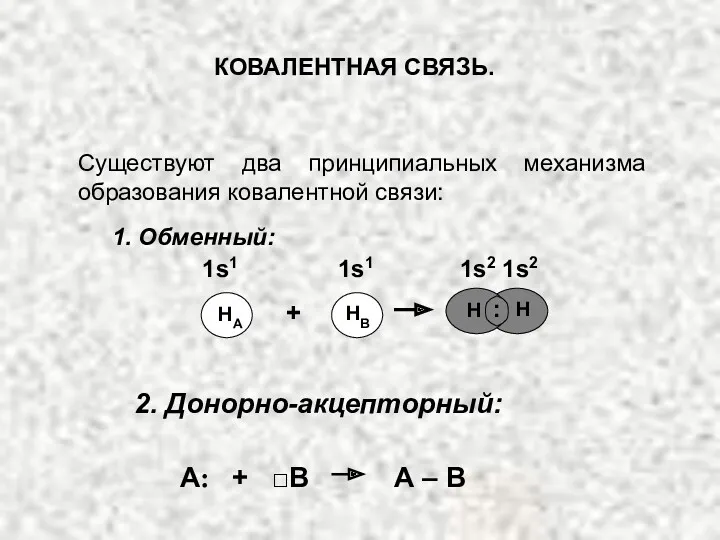
- 17. 2. Донорно-акцепторный: КОВАЛЕНТНАЯ СВЯЗЬ. Существуют два принципиальных механизма образования ковалентной связи: 1. Обменный: А: + □В
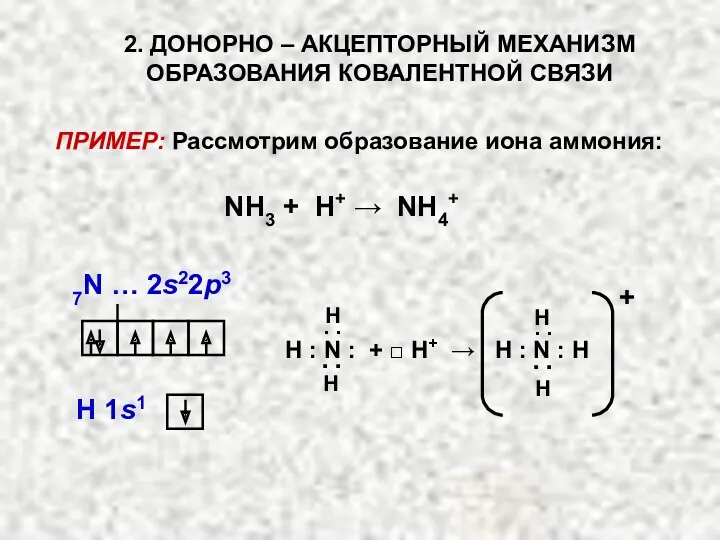
- 18. ПРИМЕР: Рассмотрим образование иона аммония: NH3 + H+ → NH4+ H ׃ N ׃ + □
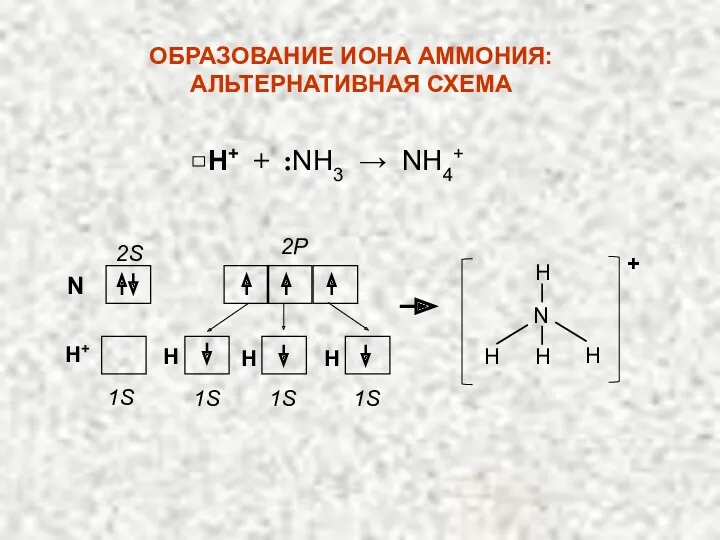
- 19. N 2S 2P H+ 1S 1S 1S 1S H H H Н+ + :NH3 → NH4+
- 20. ВАЛЕНТНОСТЬ атомы элементов могут образовывать лишь ограниченное число химических связей. Валентность - Способность атома присоединять или
- 21. Значение валентности определяется наличием одно-, двуэлектронных облаков и свободных орбиталей (с учетом обменного и Д-А механизма
- 22. Кратность связи определяется числом общих электронных пар. Так кратность связи в молекуле хлороводорода (Н-Cl) равна одному,
- 23. Металлическая связь Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Металлическая кристаллическая решетка и
- 24. Водородная связь Это связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой
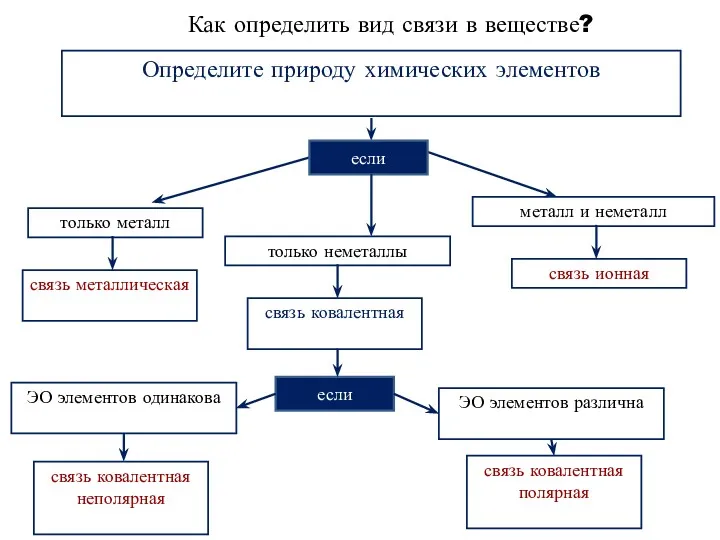
- 26. Как определить вид связи в веществе? Определите природу химических элементов если только металл только неметаллы металл
- 27. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- 28. Определите максимальную валентность кислорода и фтора. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ Пример 1.
- 29. Кислород и фтор во всех соединениях проявляют постоянную валентность, равную двум для кислорода и единице для
- 30. Какую валентность проявляет атом кремния? Пример 2.
- 31. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ Р е ш е н и е . Электронная конфигурация атома кремния 1s22s22p63s23p2.
- 32. Степень окисления - это условный заряд атомов, вычисленный из предположения, что вещество состоит только из ионов.
- 33. Степень окисления простых веществ равна О S0, P0, Si0 Cl20, O20, N20 Атомное строение: Молекулярное строение:
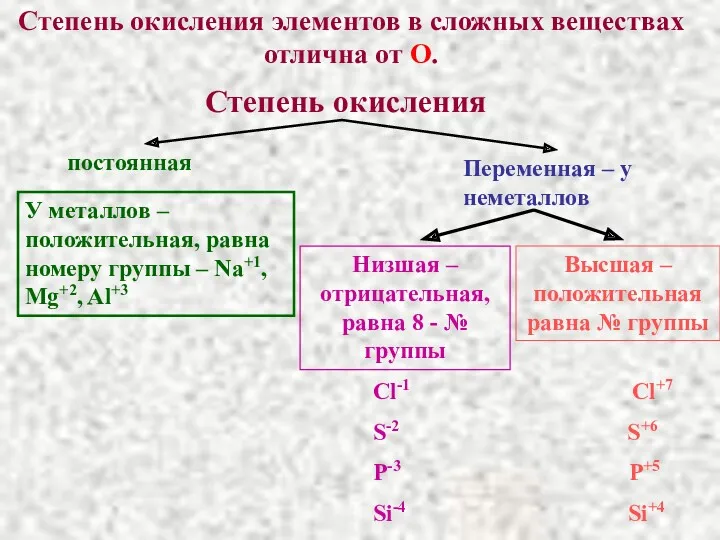
- 34. Степень окисления элементов в сложных веществах отлична от О. постоянная Переменная – у неметаллов У металлов
- 35. Правила определения с.о. С.о. атомов в простых веществах = 0 С.о. фтора = -1 С.о. кислорода
- 36. Промежуточные с.о. Рассмотрим возможные с.о. серы – S Максимальная +6 SO3 Минимальная -2 H2S Сера может
- 37. Суммарная степень окисления в молекуле всегда равна 0 +1 -2 Na2O +3 -1 AlCl3 +2 -1
- 38. Определение с.о. N2O3 На первом месте стоит элемент с «+» с.о., на втором с «-» У
- 39. Алгоритм определения степени окисления Al2S3 Металл – положительная СО Находится в III А группе - +3
- 40. Алгоритм определения с.о. Si O2 Постоянная степень окисления Переменная степень окисления -2 Сумма степеней окисления в
- 41. Бинарные соединения. Бинарные соединения – это соединения, состоящие из двух химических элементов.
- 42. Названия бинарных соединений. На первом месте в названии бинарного соединения записывается латинское название элемента с отрицательной
- 43. Названия бинарных соединений. Названия элементов с отрицательной степенью окисления: Cl - хлорид О - оксид Н
- 44. Задание 2: назвать бинарные соединения, формулы которых даны. +1 -1 NaCl - +2 -1 SCl2 -
- 45. Бинарные соединения. На первом месте всегда записывается элемент с положительной степенью окисления, а на втором -
- 46. Составление формул бинарных соединений по названию. оксид углерода (IV). 1) Записать символы химических элементов образующих соединение:
- 47. Составление формул бинарных соединений по названию. 2) Над атомами химических элементов в соединении проставить их степени
- 48. Составление формул бинарных соединений по названию. 3) Найти наименьшее общее кратное между значениями степеней окисления: +4
- 49. Составление формул бинарных соединений по названию. Определить индексы, разделив НОК на значения степеней окисления каждого элемента.
- 50. Задание: Составить формулы веществ по названиям. Сульфид лития - Оксид серы (IV) - Оксид азота (V)
- 51. Задание для самостоятельной подготовки: Назвать вещества: NO, N2O, N2O3, PCl3, PCl5, CuCl2. Составить формулы веществ по
- 52. ОПРЕДЕЛИТЕ ВИД ХИМИЧЕСКОЙ СВЯЗИ ОПРЕДЕЛИТЕ СТЕПЕНЬ ОКИСЛЕНИЯ АТОМОВ В МОЛЕКУЛАХ напишите электронные формулы атомов (учитывая степень
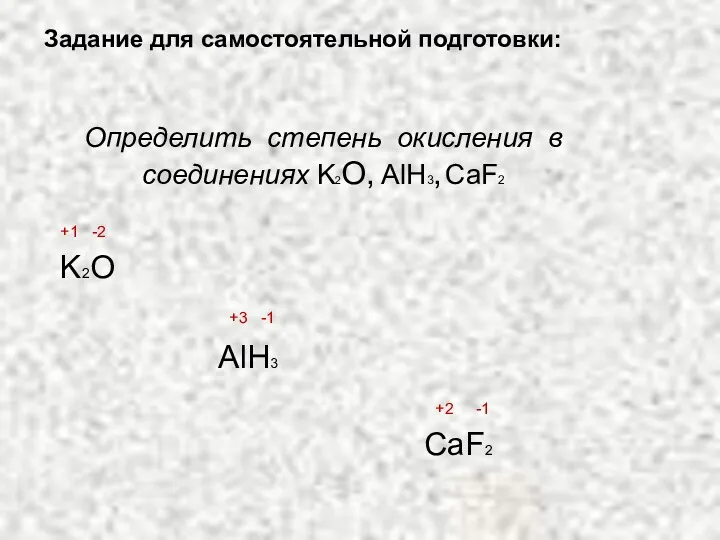
- 53. Определить степень окисления в соединениях K2О, AlH3, CaF2 +1 -2 K2O +3 -1 AlH3 +2 -1
- 54. СПАСИБО ЗА ВНИМАНИЕ!
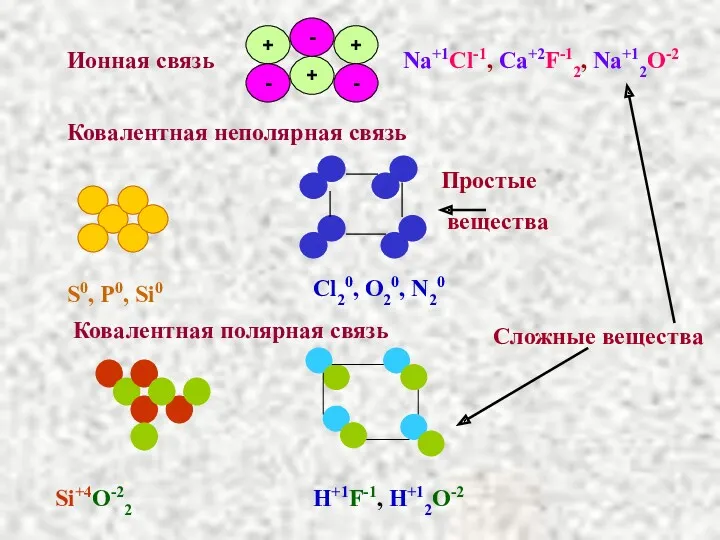
- 55. Ковалентная неполярная связь Ионная связь Na+1Cl-1, Ca+2F-12, Na+12O-2 Cl20, O20, N20 S0, P0, Si0 Ковалентная полярная
- 56. Какую валентность проявляет атом хлора ? ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ Пример 2.
- 58. Скачать презентацию











































 Предельные одноатомные спирты
Предельные одноатомные спирты Открытие Д.И. Менделеевым периодического закона. Периодическая система химических элементов
Открытие Д.И. Менделеевым периодического закона. Периодическая система химических элементов Химические реакции
Химические реакции Превращения веществ. Роль химии в жизни человека
Превращения веществ. Роль химии в жизни человека Алкиндер. Номенклатурасы, табиғатта кездесуі, физикалық және химиялық қасиеттері, алыну жолдары
Алкиндер. Номенклатурасы, табиғатта кездесуі, физикалық және химиялық қасиеттері, алыну жолдары Композиционные материалы для изоляции электрических машин
Композиционные материалы для изоляции электрических машин Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Химиялық өнеркәсіп шикізаты . Шикізат көздері Химиялық өндірістегі энергия және энергия көздері
Химиялық өнеркәсіп шикізаты . Шикізат көздері Химиялық өндірістегі энергия және энергия көздері Твердость минералов и их применение
Твердость минералов и их применение Строение атома
Строение атома Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы
Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы Теорія горіння та вибуху
Теорія горіння та вибуху Основы химмотологии моторных топлив. Тема 3
Основы химмотологии моторных топлив. Тема 3 Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Адсорбция. Раздел III
Адсорбция. Раздел III Кислоты. Определение и классификация
Кислоты. Определение и классификация Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Благородные металлы
Благородные металлы Альдегиды и кетоны
Альдегиды и кетоны Классификация органических соединений
Классификация органических соединений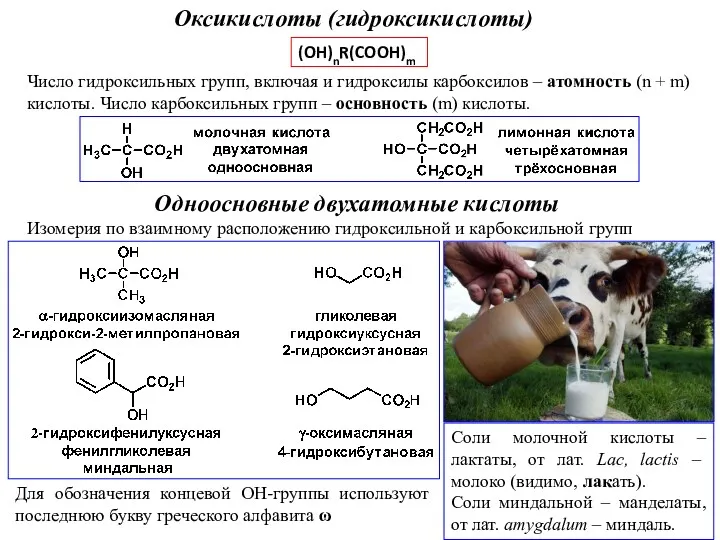 Оксикислоты (гидроксикислоты)
Оксикислоты (гидроксикислоты) Окислительно – восстановительные реакции
Окислительно – восстановительные реакции Химиялық жарыс кеші
Химиялық жарыс кеші Химическая термодинамика
Химическая термодинамика Сложные эфиры. Жиры
Сложные эфиры. Жиры Дефекты в твердых телах
Дефекты в твердых телах Water
Water Элемент цинк
Элемент цинк