Слайд 2

Вода в природе
H2O — самое распространённое вещество на Земле. Это единственное
вещество, которое существует на планете одновременно в трёх агрегатных состояниях.
Вода входит в состав всех живых организмов. Например, организм человека содержит до 70 % воды, рыбы — 80 %. В живой клетке вода представляет собой среду, в которой протекают жизненно важные процессы.
Слайд 3

Вода. Физические свойства
При обычных условиях вода — прозрачная жидкость без вкуса
и запаха. В тонком слое она бесцветна, а при толщине более 2 м имеет голубой оттенок.
Плотность жидкой воды максимальна при 4 °С и равна 1 г/см³ ( 1000 г/дм³). В отличие от других веществ твёрдая вода (лёд) легче жидкой. Плотность льда при 0 °С составляет 0,92 г/см³. Поэтому айсберги плавают по поверхности океанов, а пресноводные водоёмы зимой не промерзают до дна, и обитающие в них организмы выживают во время сильных морозов.
Слайд 4

Вода. Физические свойства
Температура плавления воды равна 0 °С, а температура кипения
— 100 °С. Это аномально высокие значения для вещества с такой низкой молекулярной массой.
Эта и другие особенности свойств воды обусловлены образованием агрегатов из полярных молекул воды за счёт межмолекулярных водородных связей.
Слайд 5

Из всех жидких и твёрдых веществ у воды самая высокая теплоёмкость.
Она медленно нагревается и так же медленно остывает.
У воды высокие значения теплоты плавления и теплоты парообразования. Поэтому процессы таяния льда и снега, испарения воды происходят постепенно и приводят к медленной смене сезонов года.
Ещё одна особенность воды — высокое поверхностное натяжение. Поверхностное натяжение обуславливает капиллярные явления, собирает воду в капли, создаёт поверхностную плёнку.
Слайд 6
Слайд 7

Гигроскопичность – способность веществ поглощать влагу из воздуха.
Соль, сахар –
гигроскопичные вещества.
Растворимость – способность вещества растворяться в воде.
Растворы – однородные смеси веществ.
Условно различают концентрированные и разбавленные растворы.
Вода, в 1 литре которой содержится больше 1 г растворенных солей, называется минеральной.
Слайд 8

Растворение – физико-химический процесс.
Ненасыщенный раствор – тот, в котором вещество еще
может растворяться при данной температуре.
Раствор, в котором при данной температуре вещество больше не растворяется, называется насыщенным.
Слайд 9
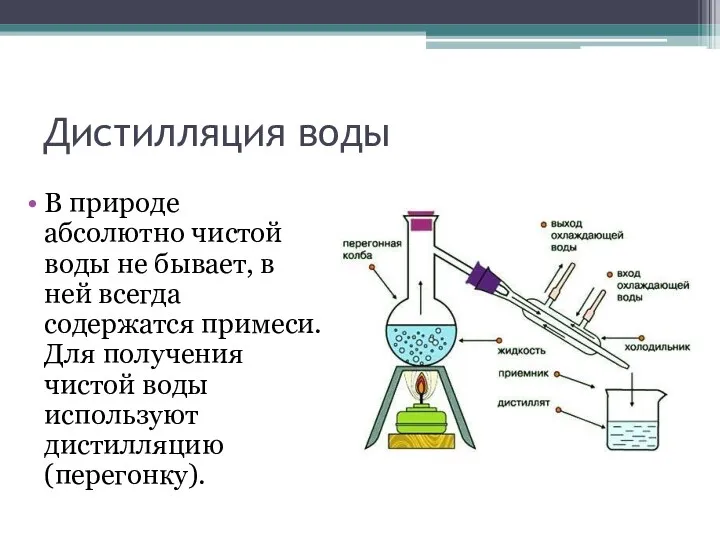
Дистилляция воды
В природе абсолютно чистой воды не бывает, в ней всегда
содержатся примеси. Для получения чистой воды используют дистилляцию (перегонку).
Слайд 10

Вода. Химические свойства
Фотосинтез
Взаимодействие с металлами
Взаимодействие с основными и кислотными оксидами
Электролиз
Гидролиз
Образование кристаллогидратов
Слайд 11

Слайд 12

Взаимодействие с металлами
При комнатной температуре вода реагирует с активными металлами с
образованием щелочей (растворимых воде оснований) и водорода:
2Na + 2H2O = 2NaOH + H2
Ca + 2H2O = Ca(OH)2 + H2
При нагревании вода вступает в реакции с менее активными металлами, расположенными в ряду активности до водорода. При этом образуются оксиды и водород:
3Fe + 4H2O = Fe3O4 + 4H2
Слайд 13

Взаимодействие с неметаллами
Вода может реагировать с некоторыми неметаллами. Так, вода загорается
в атмосфере фтора:
2F2 + 2H2O = 4HF + O2
При высокой температуре происходит её взаимодействие с углём:
C + H2O = CO + H2
Слайд 14

Взаимодействие с оксидами
Вода реагирует с оксидами активных металлов с образованием щелочей
(реакция идет, только если образуется растворимый гидроксид):
Na2O + H2O = 2NaOH
Вода реагирует с кислотными оксидами (кроме оксида кремния (IV)!).
При этом образуются кислоты:
SO3 + H2O = H2SO4
Слайд 15

Электролиз
2H2O=2H2+O2
Разложение воды под действием электрического тока.
Слайд 16

Гидролиз
Гидролиз – обменное взаимодействие некоторых веществ с водой.
Гидролиз белков, жиров
и углеводов происходит в органах пищеварения животных и является неотъемлемой частью обмена веществ в живых организмах.
Слайд 17

Образование кристаллогидратов
Вода может присоединяться к некоторым веществам. Такой процесс называется гидратацией.
В
результате гидратации многих солей образуются их кристаллогидраты:
CuSO4+5H2O=CuSO4⋅5H2O
Медный купорос
Слайд 18

Слайд 19

Кристаллогидраты
Кристаллические вещества, содержащие молекулы воды, называют кристаллогидратами.
Вода, входящая в их состав,
называется кристаллизационной водой.
Большинство кристаллогидратов является солями.
Медный купорос
CuSO4·5H2O
Слайд 20

Кристаллогидраты
Железный купорос FeSO4·7Н2О
Гипс CaSO4·2Н2О
Слайд 21

Кристаллогидраты
Кристаллическая сода Na2CO3·10Н2О




















 Теоретические основы органической химии
Теоретические основы органической химии Кислоты и их свойства
Кислоты и их свойства Воздух и его свойства
Воздух и его свойства Виды изомерии в органической химии
Виды изомерии в органической химии Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Химическая промышленность
Химическая промышленность Свойства растворов электролитов
Свойства растворов электролитов Роль химии в современной цивилизации
Роль химии в современной цивилизации Электрохимические процессы
Электрохимические процессы Обмен липидов
Обмен липидов Химические свойства воды
Химические свойства воды Экстрагирование в химической промышленности
Экстрагирование в химической промышленности Заключительный урок в 8 классе Тест по химии.
Заключительный урок в 8 классе Тест по химии. Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Жескость воды
Жескость воды ОВР в органической химии
ОВР в органической химии Чисті речовини і суміші
Чисті речовини і суміші Каталитический риформинг
Каталитический риформинг Кислород как элемент
Кислород как элемент Геохимия. Геохимическая система элементов
Геохимия. Геохимическая система элементов Бордың адам ағзасына әсері
Бордың адам ағзасына әсері Алюминий и его сплавы
Алюминий и его сплавы Кремний и его соединения
Кремний и его соединения Виды химической связи
Виды химической связи Положение металлов в периодической системе химических элементов. Особенности строения их атомов
Положение металлов в периодической системе химических элементов. Особенности строения их атомов Изотопы химических элементов
Изотопы химических элементов Электронные конфигурации атомов
Электронные конфигурации атомов Решение заданий ЕГЭ на составление окислительно-восстановительных реакций
Решение заданий ЕГЭ на составление окислительно-восстановительных реакций