Содержание
- 2. Содержание Электролитическая диссоциация Коллигативные свойства растворов электролитов Сильные и слабые электролиты Состояние сильных электролитов в растворе
- 3. Электролитическая диссоциация Электролиты - вещества, растворы или расплавы которых проводят электрический ток Причиной электропроводности растворов электролитов
- 4. Степень диссоциации Степень диссоциации (α ) – отношение количества вещества, распавшегося на ионы, к общему количеству
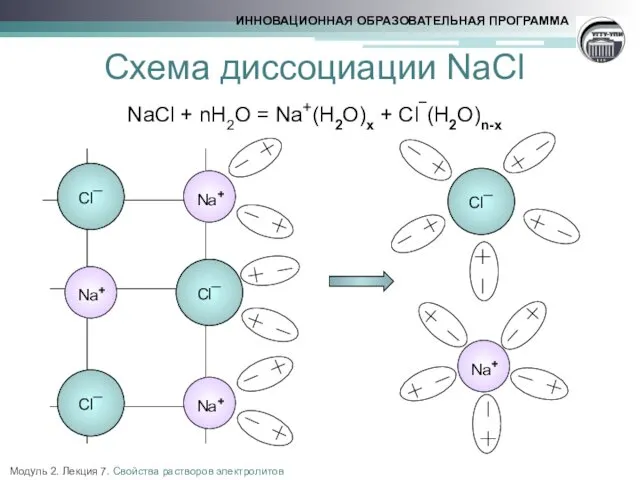
- 5. Схема диссоциации NaCl NaCl + nH2O = Na+(H2O)x + Cl¯(H2O)n-x Модуль 2. Лекция 7. Свойства растворов
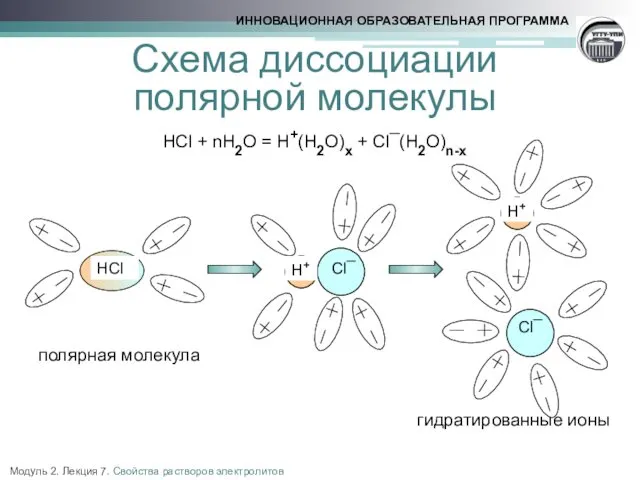
- 6. Схема диссоциации полярной молекулы HCl + nH2O = H+(H2O)x + Cl¯(H2O)n-x полярная молекула гидратированные ионы Модуль
- 7. Коллигативные свойства растворов электролитов Относительное понижение давления насыщенного пара растворителя над раствором Понижение температуры кристаллизации раствора
- 8. Изотонический коэффициент (i) равен отношению числа находящихся в растворе частиц (недиссоциированных молекул и ионов) к общему
- 9. Сильные электролиты Условно – степень диссоциации которых в 0,1М растворе > 30% Большинство солей Многие неорганические
- 10. Слабые электролиты Некоторые неорганические и большинство органических кислот: H2CO3, H2SiO3, HNO2, H3PO4, H2SO3, H2S, HF, HCN,
- 11. Состояние сильных электролитов в водном растворе Практически полностью диссоциированы на ионы Al2(SO4)3 = 2Al3+ + 3SO42-
- 12. Диссоциация слабых электролитов. Константа диссоциации В растворах слабых электролитов – равновесие между ионами и недиссоциированными молекулами:
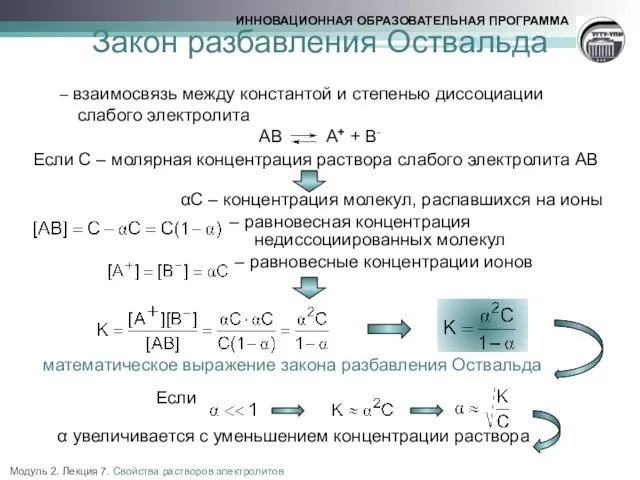
- 13. Закон разбавления Оствальда – взаимосвязь между константой и степенью диссоциации слабого электролита AB A+ + B-
- 14. Диссоциация слабых кислот Кислоты диссоциируют с образованием ионов водорода CH3COOH H+ + CH3COO- Многоосновные кислоты диссоциируют
- 15. Диссоциация слабых оснований Основания диссоциируют с образованием ионов ОH- Слабые основания, содержащие несколько ионов ОH-, диссоциируют
- 16. Активность ионов При описании свойств реальных растворов используют закономерности, применимые к идеальным и бесконечно разбавленным растворам,
- 17. Протонная теория кислот и оснований Предложена Д.Бренстедом Кислота – любая водородсодержащая частица (молекула или ион), способная
- 18. Протолиз и протолитические равновесия Протолиз – процесс передачи протона от кислоты к основанию Протолитическое или кислотно-основное
- 19. Кислотно-основные свойства воды Свойства кислоты H2O + NH3 NH4+ + OH- кислота1 oснование2 кислота2 основание1 Свойства
- 20. Электронная теория кислот и оснований Кислота – акцептор, основание – донор электронов Кислота может не содержать
- 21. Заключение Электролиты (соли, кислоты и основания) при растворении подвергаются полной или частичной диссоциации. В первом случае
- 23. Скачать презентацию

















 Чистые вещества и смеси
Чистые вещества и смеси Мыло и синтетические моющие средства
Мыло и синтетические моющие средства Материаловедение. Лекция 1
Материаловедение. Лекция 1 Залізо. Фізичні та хімічні властивості
Залізо. Фізичні та хімічні властивості Почему мыло пенится
Почему мыло пенится Алюминий
Алюминий Гидрогеохимия урана и тория
Гидрогеохимия урана и тория Природные источники углеводородов
Природные источники углеводородов Химические волокна (7 класс)
Химические волокна (7 класс) Аргентум, или серебро
Аргентум, или серебро Алкины. Физические и химические свойства
Алкины. Физические и химические свойства Спирты: общая характеристика
Спирты: общая характеристика Бескислородные керамические материалы
Бескислородные керамические материалы Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Objectives and background. Apply for an unknown mixture
Objectives and background. Apply for an unknown mixture Процессы, проходящие в растворах (продолжение темы)
Процессы, проходящие в растворах (продолжение темы) The Molecules of Life
The Molecules of Life Зеленая химия полиуретанов: механизм, катализ, проблемы использования возобновляемого сырья
Зеленая химия полиуретанов: механизм, катализ, проблемы использования возобновляемого сырья Электродные процессы
Электродные процессы Физические и химические свойства алмаза. Алмазная промышленность в России
Физические и химические свойства алмаза. Алмазная промышленность в России Кислоты
Кислоты Вклад ученых-химиков в победу в Великой Отечественной войне
Вклад ученых-химиков в победу в Великой Отечественной войне Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Основні класи неорганічних сполук
Основні класи неорганічних сполук Совершенствование урока химии в условиях ФГОС
Совершенствование урока химии в условиях ФГОС Игра Химические элементы (формулы и названия)
Игра Химические элементы (формулы и названия) Химическая кинетика и катализ
Химическая кинетика и катализ Органічні сполуки. 3D моделі органічних сполук
Органічні сполуки. 3D моделі органічних сполук