Содержание
- 2. Физические свойства кислот При обычных условиях кислоты могут быть жидкими и твердыми (борная, ортофосфорная, вольфрамовая) Кислоты
- 3. Классификация кислот
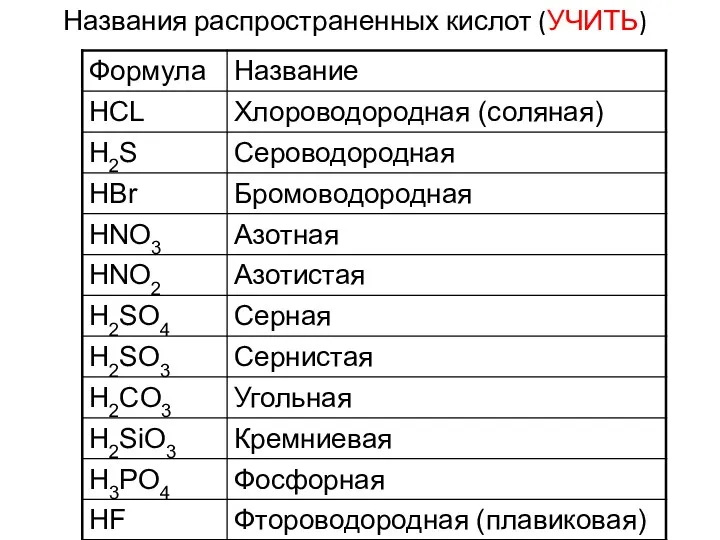
- 4. Названия распространенных кислот (УЧИТЬ)
- 5. Типичные реакции кислот 1. Кислота + основание = соль + вода H2SO4 +2 NaOH = Na2SO4
- 6. Типичные реакции кислот 3. Кислота + металл = водород + соль 2HCL +Zn = ZnCL2 +
- 7. Способы получения кислот 1. Взаимодействие кислотных оксидов с водой SO3 + H2O = H2SO4; CO2 +
- 8. Амфотерными называются гидроксиды , которые в зависимости от условий могут быть как донорами катионов водорода и
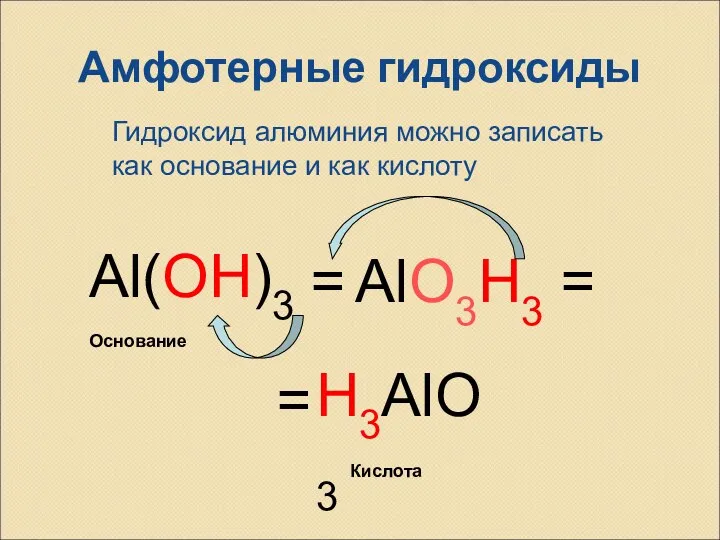
- 9. Амфотерные гидроксиды Al(OH)3 = H3AlO3 AlO3H3 = = Кислота Основание Гидроксид алюминия можно записать как основание
- 10. Некоторые гидроксиды с кислотно-основными свойствами:
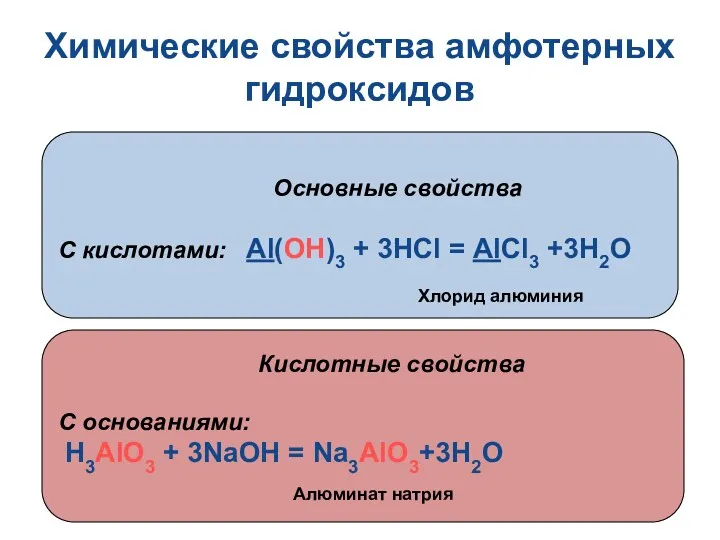
- 11. Химические свойства амфотерных гидроксидов Основные свойства С кислотами: Al(OH)3 + 3HCl = AlCl3 +3H2O Кислотные свойства
- 12. Способы получения амфотерных гидроксидов Осаждение разбавленной щёлочью из растворов солей соответствующего амфотерного элемента AlCl3 + NаOH
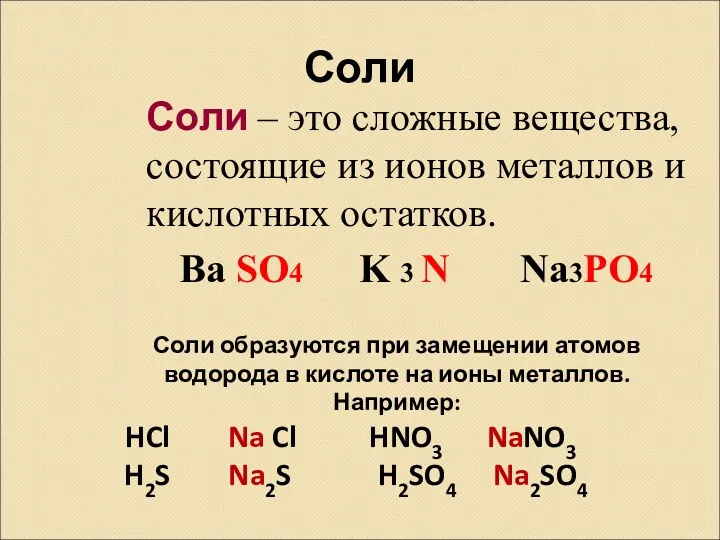
- 13. Соли Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков. Ba SO4 K
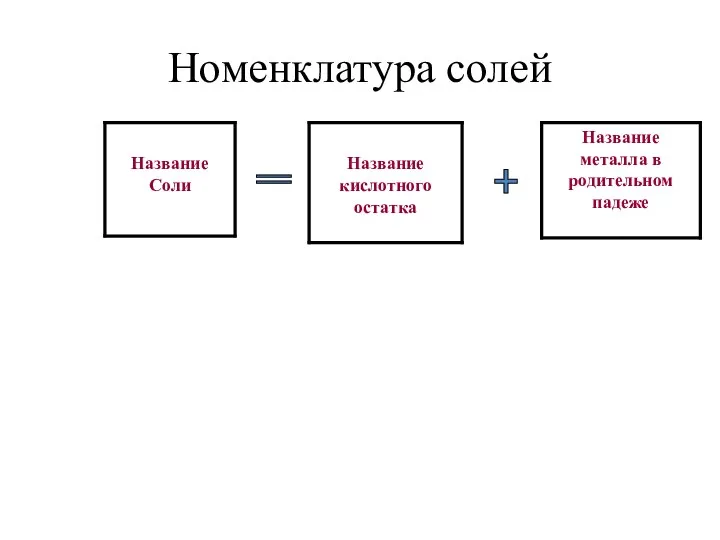
- 14. Номенклатура солей + =
- 15. Названия солей бескислородных кислот называем неметалл ( латинское название) с суффиксом – ид (в им. падеже);
- 16. Названия солей кислородсодержащих кислот Называем ион кислотного остатка (в именительном падеже); с суффиксами: -ат для высшей
- 17. Номенклатура солей (УЧИТЬ) F – Cl – Br – I – S 2- SO3 2- SO4
- 18. Алгоритм составления формулы соли бескислородной кислоты Первое действие: записываем степени окисления элементов, находим наименьшее общее кратное
- 19. Алгоритм составления формулы соли кислородсодержащей кислоты Первое действие: находим наименьшее общее кратное Второе действие: находим Ca2+
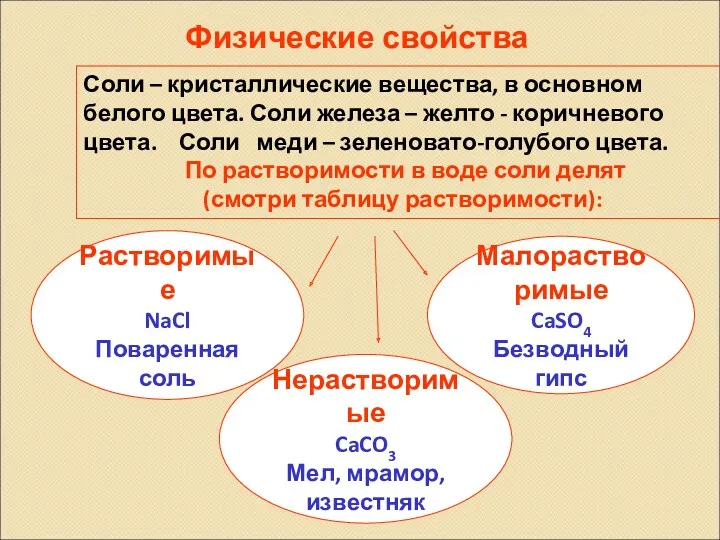
- 20. Физические свойства Растворимые NaCl Поваренная соль Соли – кристаллические вещества, в основном белого цвета. Соли железа
- 21. Типы солей Нормальные (средние) -это соли, в которых все атомы водорода соответствующей кислоты замещены на атомы
- 22. Соли реагируют с металлами( исключения активные металлы: Li, Na, K, Ca, Ba - которые при обычных
- 23. Соли реагируют с некоторыми кислотными оксидами: CaCO3 + SiO2 = CaSiO3 + CO2 Соли реагируют с
- 24. Взаимодействие металлов и неметаллов: 2Fe + 3Cl2 = 2FeCl3 Взаимодействие кислотных оксидов с основными и амфотерными
- 26. Скачать презентацию

















 Теория сплавов
Теория сплавов Эквивалент. Закон эквивалентов
Эквивалент. Закон эквивалентов Свойства воды
Свойства воды Щелочные металлы
Щелочные металлы Применение спиртов
Применение спиртов Альбитит-грейзеновые месторождения
Альбитит-грейзеновые месторождения Алкены. Состав, строение, свойства и химические превращения
Алкены. Состав, строение, свойства и химические превращения Запалювання нагрітим тілом та електричним розрядом
Запалювання нагрітим тілом та електричним розрядом Удобрения и их классификация
Удобрения и их классификация Химическая промышленность
Химическая промышленность Оксид цинка
Оксид цинка Агрегатное состояние веществ и типы химических связей
Агрегатное состояние веществ и типы химических связей Предельные одноатомные спирты
Предельные одноатомные спирты Залежність властивостей полімерів від їхньої будови. Термопластичні й термореактивні полімери
Залежність властивостей полімерів від їхньої будови. Термопластичні й термореактивні полімери Топливный элемент: проблемы и перспективы
Топливный элемент: проблемы и перспективы Строение атома и периодический закон Д.И. Менделеева
Строение атома и периодический закон Д.И. Менделеева Химическое равновесие
Химическое равновесие Охрана труда в кабинете (лаборатории) химии образовательного учреждения
Охрана труда в кабинете (лаборатории) химии образовательного учреждения Ерітіндіден заттарды бөлу әдістері
Ерітіндіден заттарды бөлу әдістері Введение в аналитическую химию. Введение в качественный анализ
Введение в аналитическую химию. Введение в качественный анализ Химия нефти и газа
Химия нефти и газа Prezentatsia
Prezentatsia Тотығу-тотықсыздану титрлеу әдістері: перманганатометрия йодометрия хроматометрия. Дәріс № 7
Тотығу-тотықсыздану титрлеу әдістері: перманганатометрия йодометрия хроматометрия. Дәріс № 7 Кaрбоновые кислоты
Кaрбоновые кислоты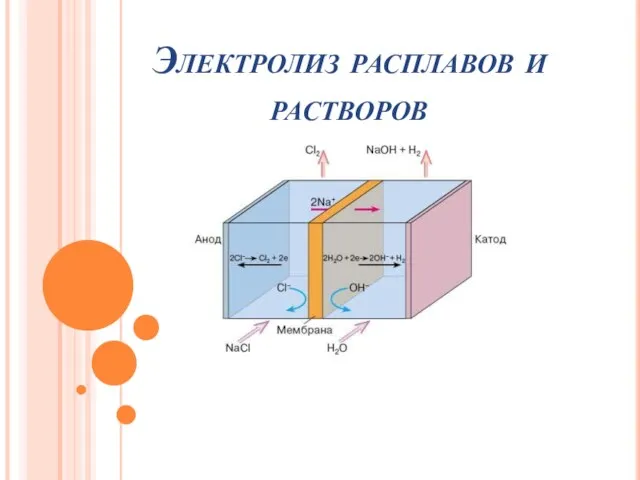 Электролиз расплавов и растворов
Электролиз расплавов и растворов Железо и его соединения
Железо и его соединения Спирти. Насичені одноатомні спирти: формули, ізомерія, систематична номенклатура
Спирти. Насичені одноатомні спирти: формули, ізомерія, систематична номенклатура Елементи вторинної структури пептидів і білків
Елементи вторинної структури пептидів і білків