Тотығу-тотықсыздану титрлеу әдістері: перманганатометрия йодометрия хроматометрия. Дәріс № 7 презентация
Содержание
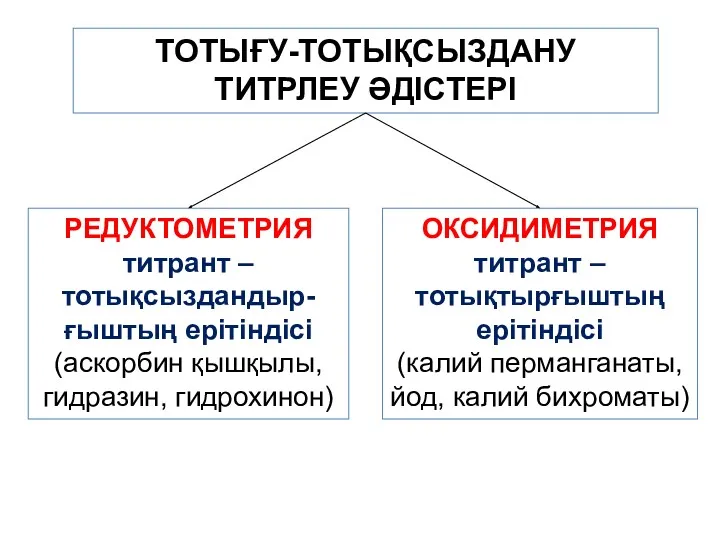
- 2. ТОТЫҒУ-ТОТЫҚСЫЗДАНУ ТИТРЛЕУ ӘДІСТЕРІ РЕДУКТОМЕТРИЯ титрант – тотықсыздандыр-ғыштың ерітіндісі (аскорбин қышқылы, гидразин, гидрохинон) ОКСИДИМЕТРИЯ титрант – тотықтырғыштың
- 3. Перманганатометрия әдісінде титрант ретінде күшті тотықтырғыш болып келетін KMnO4 - калий перманганатының тотықтырғыш қасиеттеріне негізделген. KMnO4
- 4. қышқылдық ортада (ерітінді түссізденеді) күлгін түсті
- 5. бейтарап ортада (ерітінді сары түсті) күлгін түсті
- 6. сілтілік ортада (ерітінді жасыл түсті) перманганат ион күлгін түсті манганат ион жасыл түсті
- 7. Перманганатометриялық титрлеуді көбісінде тек күшті қышқылдық ортада жүргізеді, ол үшін тек 2н H2SO4 күкірт қышқылы ерітіндісін
- 8. Титрлеуді бейтарап ортада өткізгенде редокс-индикаторларды қолдануға болады: дифениамин, дифениламинсульфоқышқылын ферроинды. Перманганатометриялық титрлеуді тура, кері және жанама
- 9. Перманганатометрияның практикалық қолданылуы: тура титрлеумен тотықсыздандырғыштарды анықтайды – Fe2+, Sn2+, U2+, оксидтерді, нитриттерді, сутегі пероксиді; кері
- 10. Йодометрия әдісінің негізінде келесі реакция жатыр: тотықтырғыш тотықсыз- дандырғыш
- 11. Йодтың тотықтырғыштық және тотықсыздандырғыштық қасиеттеріне қарай йодометрияны екі әдіске бөледі: ЙОДОМЕТРИЯ – титрант I2 ерітіндісі. Титрлеуді
- 12. 2) ЙОДИМЕТРИЯ – титранттар KI және Na2S2O3 Титрлеуді калий йодиді KI ерітіндісімен жүргізеді, нәтижесінде бөлініп шыққан
- 13. Йод ерітіндісінің нақты титрі стандартталған Na2S2O3*5H2O натрий тиосульфаты ерітіндісі бойынша аптасына 2-3 рет анықталады. Ал натрий
- 14. Йодометриялық реакцияларды бірнеше жолмен өткізуге болады: Индикаторсыз жолмен – бұл жағдайда ерітіндідегі бос күйдегі йод сары
- 15. Йодты натрий тиосульфатымен титрлеу кезінде келесі ережелерді міндетті түрде сақтау қажет: титрлеуді салқын бөлмеде өткізу қажет,
- 16. Йодтың тотықтырғыш потенциалы күшті тотықтырғыштар мен күшті тотықсыздандырғыштардың потенциалдары шамаларының арасында орташа орын алады, сондықтан йодометрия
- 17. Йодометрияның қолданылуы: тотықсыздандырғыштарды анықтауда – As3+, Sb3+, Sn2+ қосылыстарын, сульфиттерді, H2S, ZnS,; тотықтырғыштарды анықтауда – K2Cr2O7,
- 18. майлардың сапасын зерттеуде олардың құрамындағы пероксидтердің мөлшерін йодометриялық әдіспен анықтайды; органикалық қышқылдарды анықтау (шарап, лимон, оксиқышқылдар);
- 20. Скачать презентацию
















 Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы
Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Аминокислоты. Что нужно для настоящего атлета?
Аминокислоты. Что нужно для настоящего атлета? Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Строение и свойства циклоалканов
Строение и свойства циклоалканов ПРИРОДНЫЕ ГОРЮЧИЕ И НЕФТЯНЫЕ ПОПУТНЫЕ ГАЗЫ
ПРИРОДНЫЕ ГОРЮЧИЕ И НЕФТЯНЫЕ ПОПУТНЫЕ ГАЗЫ Алкани, насичені вуглеводні
Алкани, насичені вуглеводні Строение атома. Периодический закон Менделеева
Строение атома. Периодический закон Менделеева Теория строения органических веществ А.М. Бутлеров
Теория строения органических веществ А.М. Бутлеров Кристаллы. Выращивание кристалла
Кристаллы. Выращивание кристалла Химическая связь и строение химических соединений
Химическая связь и строение химических соединений Установка по переработке углеводородов
Установка по переработке углеводородов Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон
Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон Основные классы органических соединений и их роль в живых организмах
Основные классы органических соединений и их роль в живых организмах Введение в общеобразовательную научную дисциплину Химия
Введение в общеобразовательную научную дисциплину Химия Бытовая химия. Правила безопасного обращения со средствами бытовой химии
Бытовая химия. Правила безопасного обращения со средствами бытовой химии Наглядное пособие Динамические модели. Химическое равновесие в растворах
Наглядное пособие Динамические модели. Химическое равновесие в растворах Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Водород. Урок химии
Водород. Урок химии Галогены. Химические свойства. Применение
Галогены. Химические свойства. Применение Темір. Жай заттармен
Темір. Жай заттармен Дисперсные системы
Дисперсные системы Прикладная геохимия. Вторичные ореолы
Прикладная геохимия. Вторичные ореолы Розчини високомолекулярних сполук
Розчини високомолекулярних сполук Липолиз. Обмен кетоновых тел
Липолиз. Обмен кетоновых тел Серебро. История
Серебро. История Методы пробоотбора воздуха. Лекция 2
Методы пробоотбора воздуха. Лекция 2 Полистирол өндірісі
Полистирол өндірісі