Содержание
- 2. План урока Понятие о спиртах Классификация спиртов Номенклатура спиртов Водородная связь Химические свойства спиртов Отдельные представители,
- 3. 1.Понятие о спиртах. Классификация и номенклатура спиртов
- 4. Спирты́ (устаревшее алкого́ли) — органические соединения, содержащие одну или несколько гидроксильных групп (гидроксил, OH),непосредственно связанных с
- 5. Изомерия и номенклатура спиртов.
- 6. Физические свойства спиртов
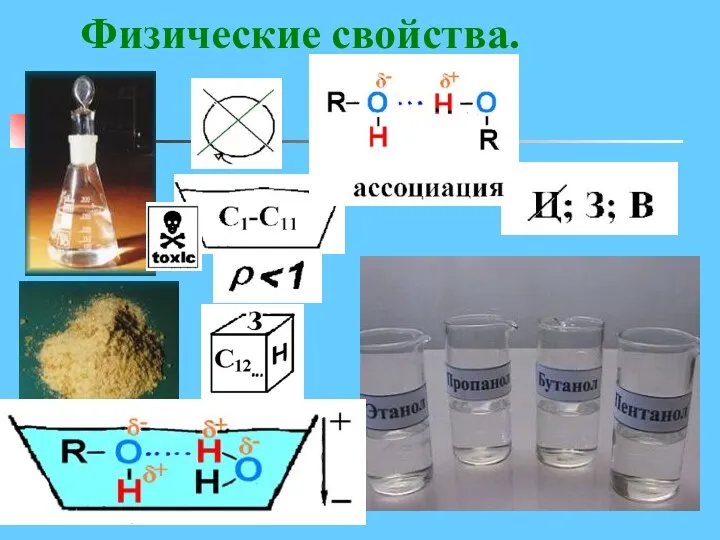
- 7. Физические свойства.
- 8. Физические свойства спиртов Низшие и средние члены ряда предельных одноатомных спиртов, содержащие от одного до одиннадцати
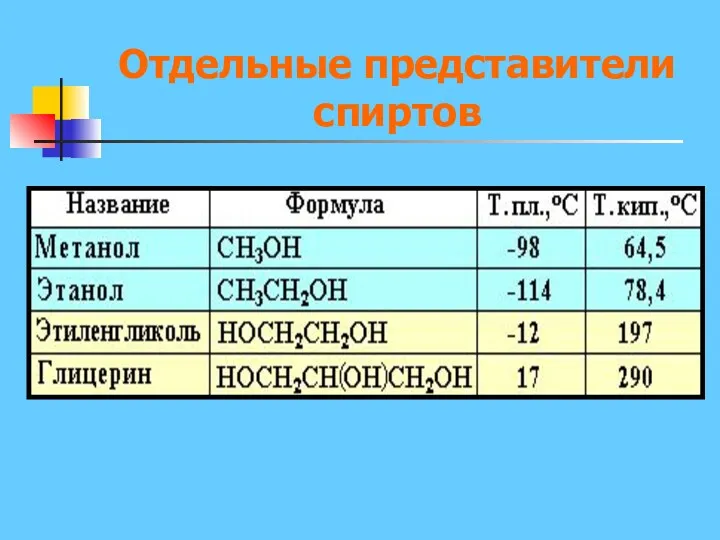
- 9. Отдельные представители спиртов
- 10. 3. Физические свойства спиртов
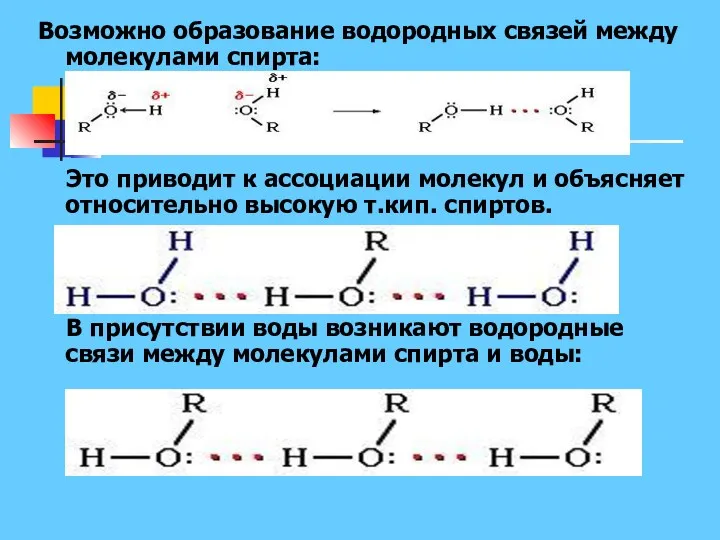
- 11. Возможно образование водородных связей между молекулами спирта: Это приводит к ассоциации молекул и объясняет относительно высокую
- 12. Химические свойства спиртов
- 13. Химические свойства спиртов
- 14. Химические свойства спиртов
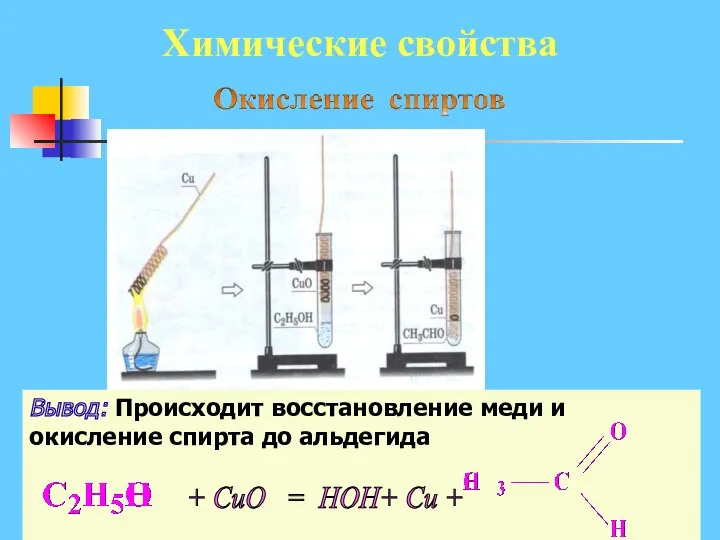
- 15. Лабораторный опыт 3. Окисление этанола. Ход работы: Прокалить спираль из медной проволоки в пламени спиртовки до
- 16. Химические свойства Вывод: Происходит восстановление меди и окисление спирта до альдегида + CuO = HOH+ Cu
- 17. Получение спиртов
- 18. Получение спиртов
- 19. Отдельные представители спиртов Отдельные представители спиртов
- 20. Применение этанола Этиловый спирт употребляется при приготовлении различных спиртных напитков. В медицине для приготовления экстрактов из
- 21. Одноатомный спирт - этанол Бесцветная жидкость с характерным запахом и жгучим вкусом, температурой кипения78С. Легче воды.
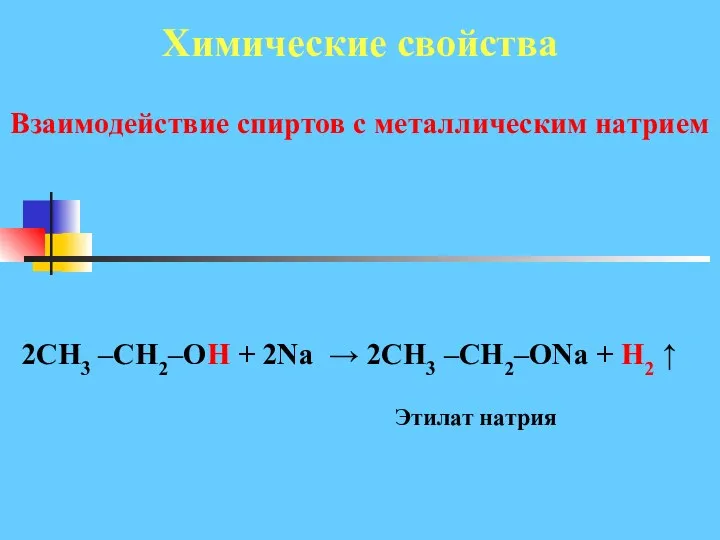
- 22. Взаимодействие спиртов с металлическим натрием Этилат натрия Химические свойства 2CH3 –CH2–OH + 2Na → 2CH3 –CH2–ONa
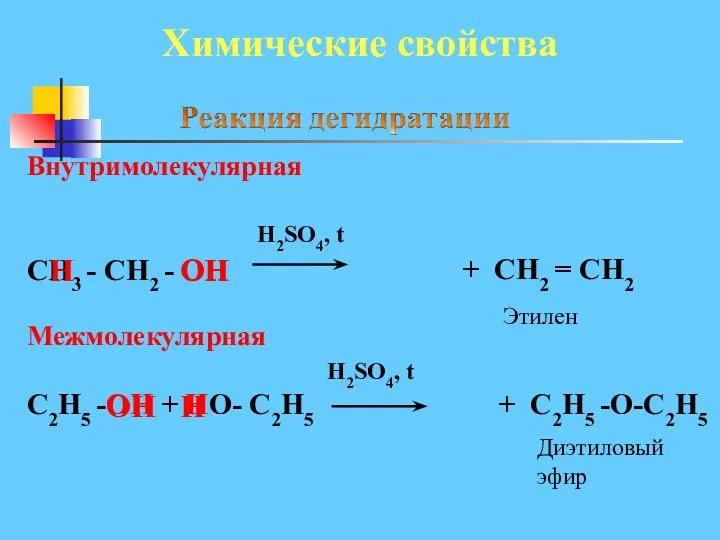
- 23. Химические свойства Внутримолекулярная H2SO4, t СН3 - СН2 - ОН ОН Межмолекулярная H2SO4, t С2Н5 -ОН
- 24. 3. Межмолекулярная дегидратация спиртов - отщепление молекулы воды от двух молекул спирта при нагревании в присутствии
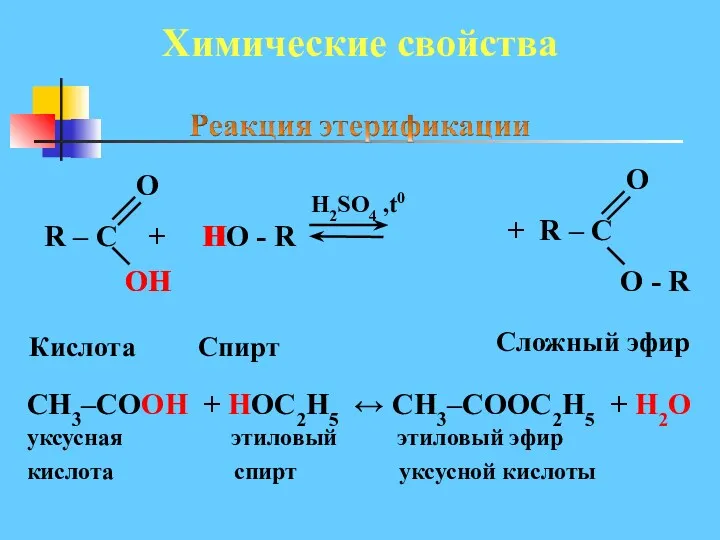
- 25. Химические свойства R – C + HO - R H2SO4 ,t0 O ОH OH H Кислота
- 26. Получение спиртов Этанол Гидратация этилена С2Н4 + Н2О = С2Н5ОН Из глюкозы C6H12O6 = 2С2Н5ОН +
- 27. Одноатомный спирт - метанол Жидкость без цвета с температурой кипения 64С, характерным запахом Легче воды. Горит
- 29. Скачать презентацию



















 Классификация химических реакций
Классификация химических реакций Как трудно быть особенной…
Как трудно быть особенной… Классификация кристаллов по типу химической связи
Классификация кристаллов по типу химической связи Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ
Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ Водород
Водород Физико-химия дисперсных систем. Коллоидные растворы
Физико-химия дисперсных систем. Коллоидные растворы Кремний и его соединения. К уроку химии в 9 классе
Кремний и его соединения. К уроку химии в 9 классе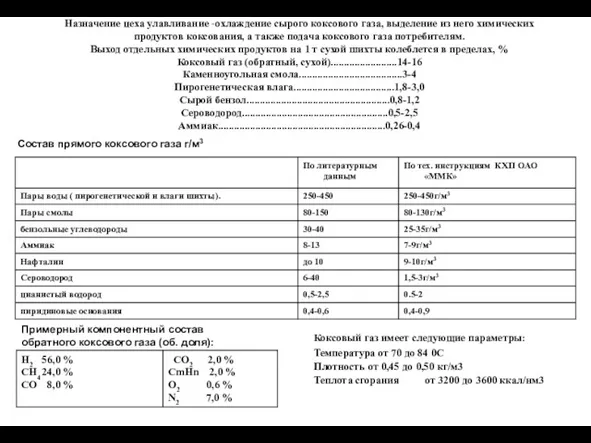 Охлаждение сырого коксового газа, выделение из него химических продуктов коксования
Охлаждение сырого коксового газа, выделение из него химических продуктов коксования Химические формулы. 8 класс
Химические формулы. 8 класс Химия в строительстве
Химия в строительстве Химия в повседневной жизни человека
Химия в повседневной жизни человека Алюминий и его соединения
Алюминий и его соединения Белоктар. Биохимиясы
Белоктар. Биохимиясы Свойства металлов
Свойства металлов Кислородсодержащие соединения серы SO2
Кислородсодержащие соединения серы SO2 Химические реакции
Химические реакции Нефелометрический анализ
Нефелометрический анализ Удобрения
Удобрения Хімічні властивості оксидів
Хімічні властивості оксидів Тепловой эффект химических реакций
Тепловой эффект химических реакций Сущность хроматографии. Лекция 2-3
Сущность хроматографии. Лекция 2-3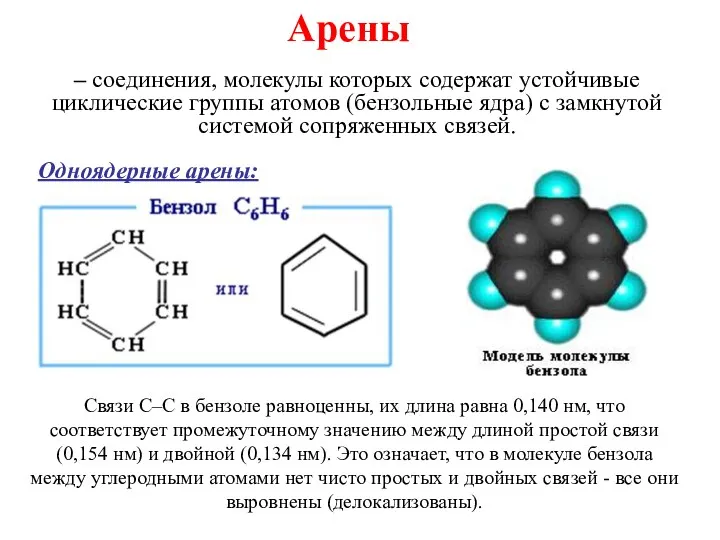 Ароматические углеводороды
Ароматические углеводороды Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Оксиды
Оксиды Кобальт. Нахождение в природе. Получение
Кобальт. Нахождение в природе. Получение Electrochemistry. Oxidation-reduction equilibrium in water solutions
Electrochemistry. Oxidation-reduction equilibrium in water solutions Загрязнение продуктов питания
Загрязнение продуктов питания Методы окислительно-восстановительного титрования (Редоксиметрия)
Методы окислительно-восстановительного титрования (Редоксиметрия)