Содержание
- 2. Тема урока: «Как трудно быть особенной …» Девиз урока: «Можно не любить химию, но прожить без
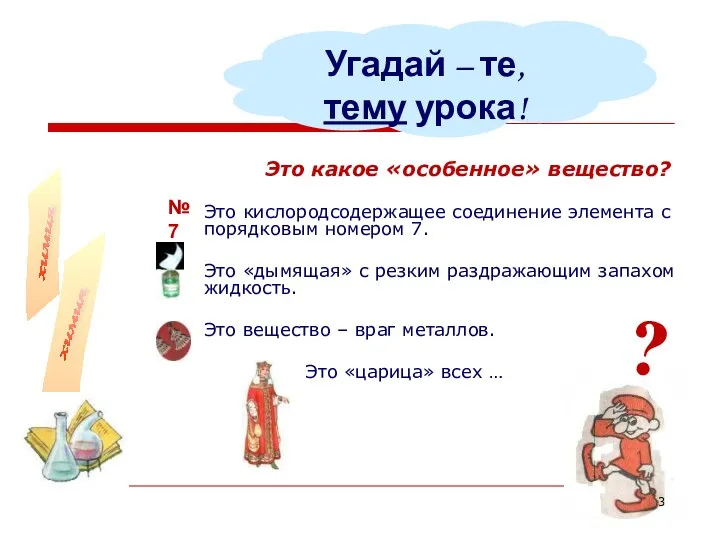
- 3. Это какое «особенное» вещество? Это кислородсодержащее соединение элемента с порядковым номером 7. Это «дымящая» с резким
- 4. Цель урока: систематизировать и углубить знания о кислотах; познакомиться со строением молекулы и физическими свойствами азотной
- 5. ВНИМАНИЕ ! Само- и взаимоконтроль Выполните тест «Азот» Вариант № 1 /Повышенный уровень/ Вариант № 2
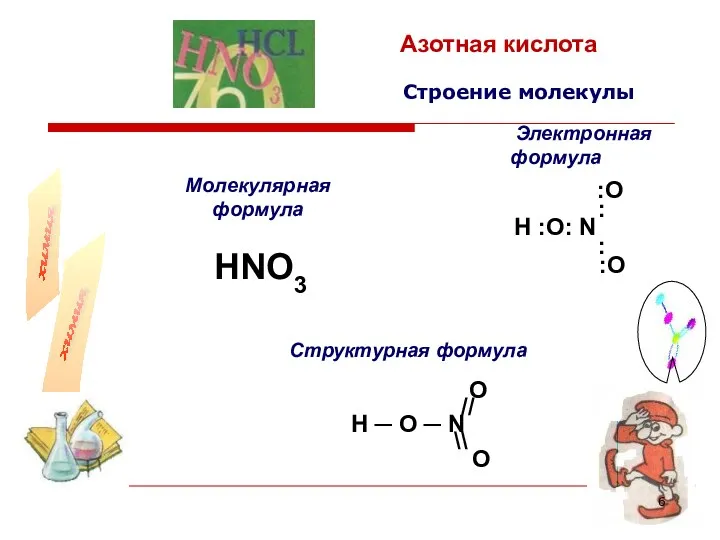
- 6. Азотная кислота Строение молекулы Электронная формула :O : H :O: N : :O Структурная формула O
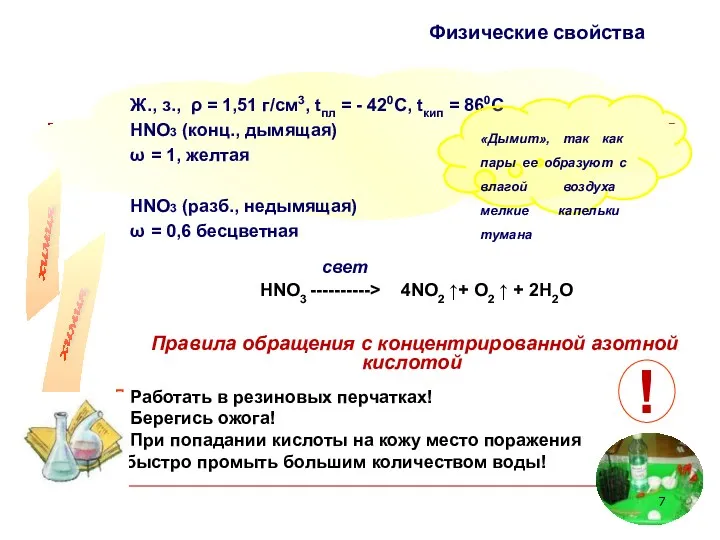
- 7. Ж., з., ρ = 1,51 г/см3, tпл = - 420С, tкип = 860С НNO3 (конц., дымящая)
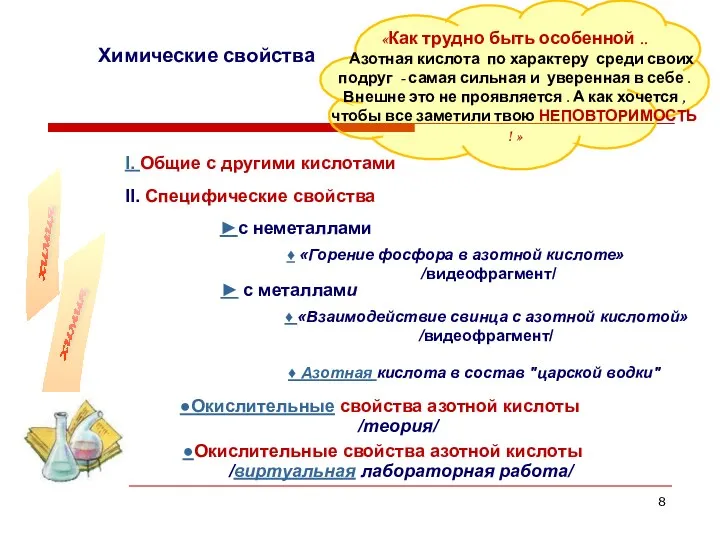
- 8. «Как трудно быть особенной .. Азотная кислота по характеру среди своих подруг - самая сильная и
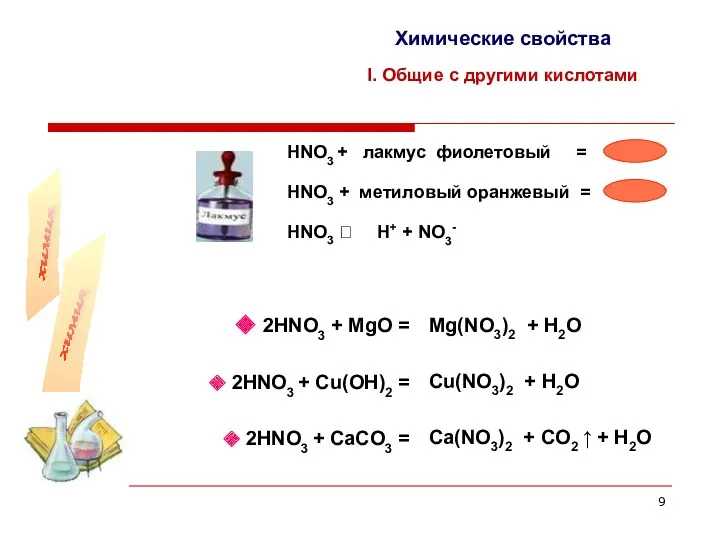
- 9. Химические свойства I. Общие с другими кислотами НNO3 + лакмус фиолетовый = 2НNO3 + MgO =
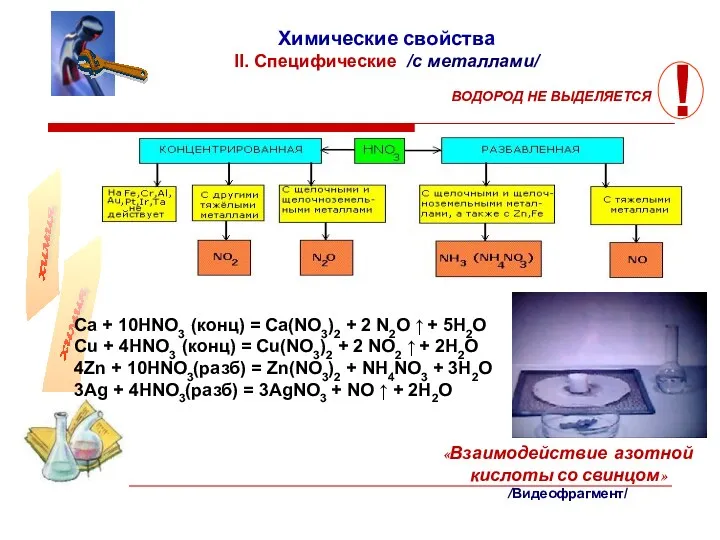
- 10. Многие неметаллы легко окисляются: сера при кипячении с азотной кислотой постепенно окисляется в серную кислоту; фосфор
- 11. Ca + 10HNO3 (конц) = Ca(NO3)2 + 2 N2O ↑ + 5H2O Cu + 4HNO3 (конц)
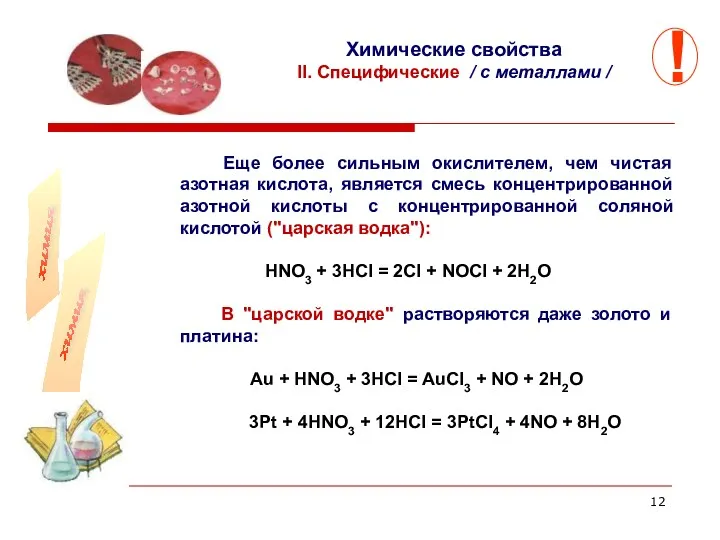
- 12. Еще более сильным окислителем, чем чистая азотная кислота, является смесь концентрированной азотной кислоты с концентрированной соляной
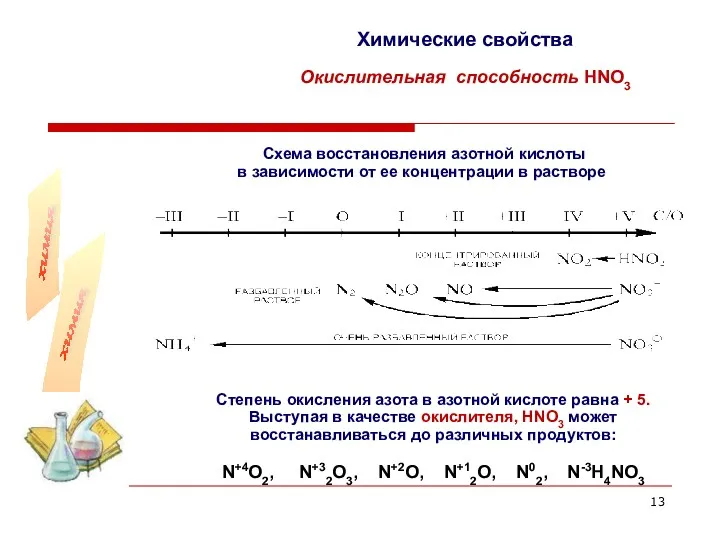
- 13. Химические свойства Окислительная способность HNO3 Схема восстановления азотной кислоты в зависимости от ее концентрации в растворе
- 14. Виртуальная лабораторная работа Окислительные свойства азотной кислоты Инструкция /пошаговая/ Запустите программу «Виртуальная химическая лаборатория» (щелчок мышкой)
- 15. Получение ГЛАУБЕР Иоганн Рудольф (1604-1670), немецкий химик и врач. Получил чистую азотную кислоту в 1650 году.
- 16. NH3 ---------------? HNO3 ? ВНИМАНИЕ ! Творческий мини – проект «Производство азотной кислоты» Цель проекта: Придумайте
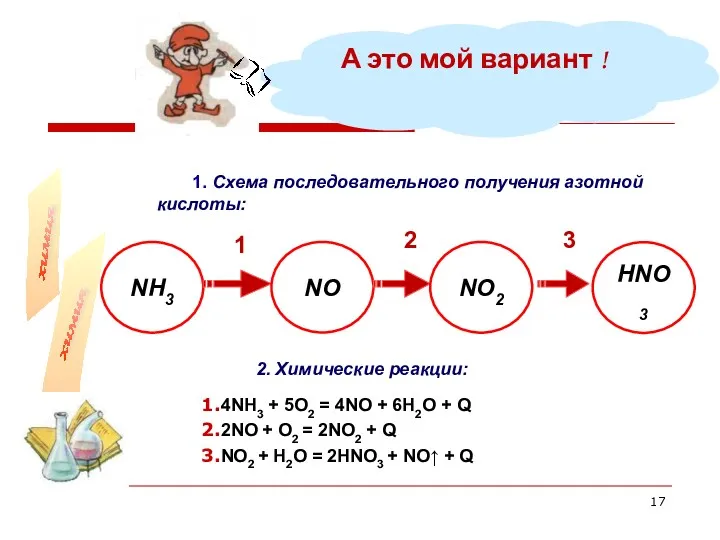
- 17. 1. Схема последовательного получения азотной кислоты: А это мой вариант ! 2. Химические реакции: 1 2
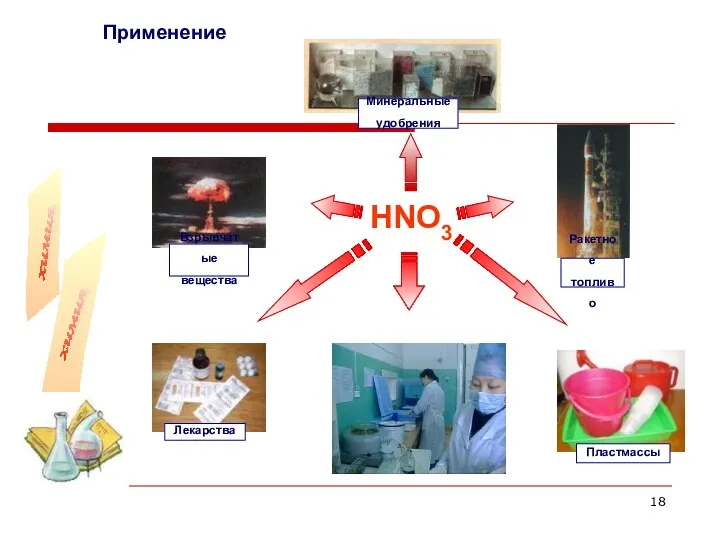
- 18. Применение HNO3
- 19. Окраска лакмуса в растворе азотной кислоты: Синяя Красная ПРОВЕРЬ СЕБЯ ! ?
- 20. При взаимодействии концентрированной азотной кислоты с медной стружкой образуется газ: Аммиак Оксид азота (Оксид азота (IVОксид
- 21. Будь внимательным на уроке ! ПРОВЕРЬ СЕБЯ !
- 22. Молодец! ПРАВИЛЬНО! ПРОВЕРЬ СЕБЯ !
- 24. Скачать презентацию









 Типы химических реакций
Типы химических реакций Дисперсні системи. Загальні властивості розчинів
Дисперсні системи. Загальні властивості розчинів Фотохимический смог и химизм его образования
Фотохимический смог и химизм его образования алкадиены
алкадиены Алкалоиды и принципы их классификации
Алкалоиды и принципы их классификации Фуллерендер құрылымдары және олардың түрлерi
Фуллерендер құрылымдары және олардың түрлерi Электронно-ионный баланс и Закон Авогадро. 8 класс
Электронно-ионный баланс и Закон Авогадро. 8 класс Тіршілік процесіне қатысатын гетерофункционалды қосылыстар
Тіршілік процесіне қатысатын гетерофункционалды қосылыстар Коррозия металлов и способы защиты от коррозии
Коррозия металлов и способы защиты от коррозии 20231116_tipy_himicheskih_reaktsiy
20231116_tipy_himicheskih_reaktsiy Методика “Кольоропис”
Методика “Кольоропис” Кристаллические решетки
Кристаллические решетки Кондуктометрия
Кондуктометрия Розв'язування задач за рівнянням хімічних реакцій
Розв'язування задач за рівнянням хімічних реакцій Щелочные металлы
Щелочные металлы Дисперсные системы. Дисперсное состояние вещества. Лекция 10
Дисперсные системы. Дисперсное состояние вещества. Лекция 10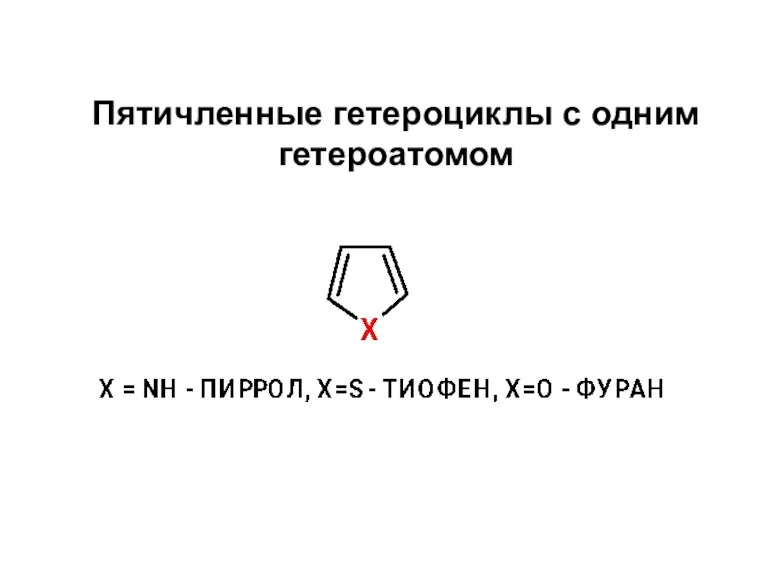 Пятичленные гетероциклы с одним гетероатомом
Пятичленные гетероциклы с одним гетероатомом Система питания двигателя от газобаллонной установки
Система питания двигателя от газобаллонной установки Реакции щелочных металлов (Группа 1) – Li, Na, K
Реакции щелочных металлов (Группа 1) – Li, Na, K Интеллектуальная игра Кто хочет стать отличником?. Химия. 11 класс
Интеллектуальная игра Кто хочет стать отличником?. Химия. 11 класс Алкадиены
Алкадиены Поверхностные явления
Поверхностные явления Хімія металургійних процесів. Теорія сплавів
Хімія металургійних процесів. Теорія сплавів Основы органической химии
Основы органической химии Физико-химия полимеров и их растворов
Физико-химия полимеров и их растворов Специфическое поведение гетерофункциональных соединений как результат взаимного влияния атомов
Специфическое поведение гетерофункциональных соединений как результат взаимного влияния атомов Природные источники углеводородов и их переработка
Природные источники углеводородов и их переработка Теория электролитической диссоциации
Теория электролитической диссоциации