Содержание
- 2. В III до нашей эры на острове Родос был построен маяк в виде огромной статуи Гелиоса.
- 3. Что является символом Парижа? – Эйфелева башня. Она неизлечима больна, ржавеет и разрушается, и только постоянная
- 4. Чугун Сплав железа с углеродом (2-4%) Сталь Сплав железа с углеродом (меньше 2%) Применяется в фасонном
- 5. Коррозия – рыжая крыса, Грызёт металлический лом. В. Шефнер Ежегодно в мире «теряется» до ¼ произведённого
- 6. А.Н.Несмеянов Знать – значит победить!
- 7. разрушение металлов и сплавов под воздействием окружающей среды. Коррозия
- 8. Виды коррозии По характеру разрушения сплошная (общая): равномерная, неравномерная локальная(местная): точечная, пятнами, язвами, подповерхностная, сквозная и
- 9. Химическая коррозия - вид коррозии, протекающий в средах, непроводящих электрический ток. Коррозия происходит в результате взаимодействия
- 10. Электрохимическая коррозия - в среде электролита возникает электрический ток при контакте двух металлов (или на поверхности
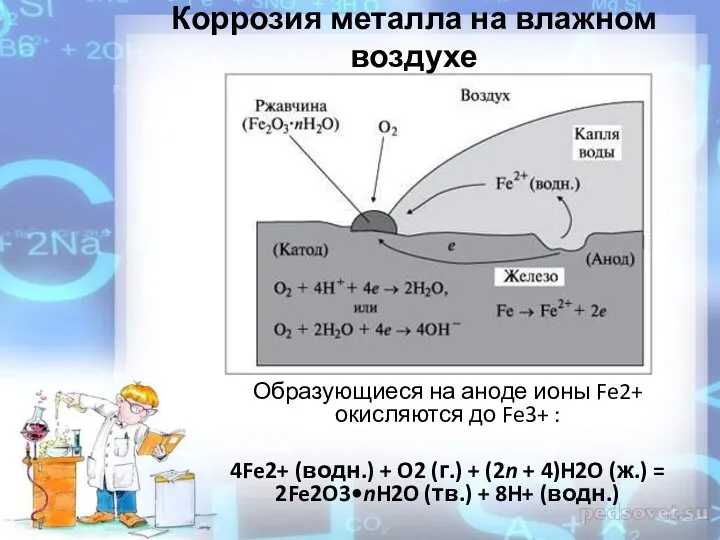
- 12. Образующиеся на аноде ионы Fe2+ окисляются до Fe3+ : 4Fe2+ (водн.) + O2 (г.) + (2n
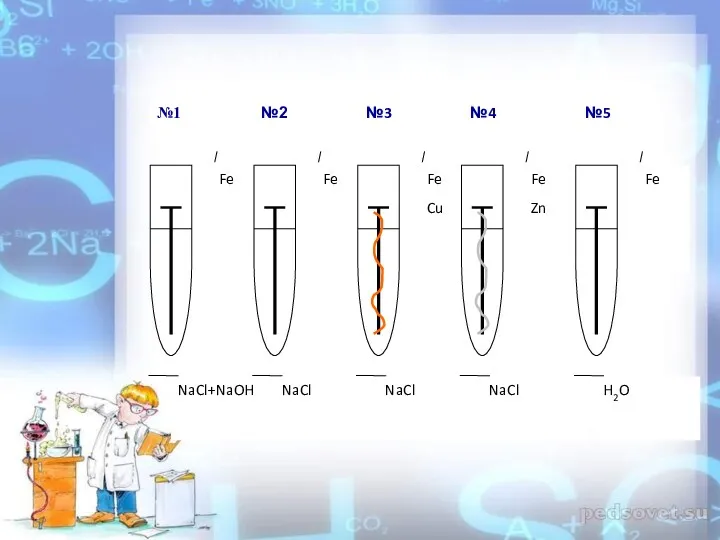
- 14. Железо слабо прокорродировало в воде, в чистой воде коррозия идет медленнее, т. к. вода слабый электролит.
- 15. Добавка к воде NaCl усиливает коррозию Fe. добавка к раствору NaCl – NaOH, как видно из
- 16. Т. о. скорость коррозии данного металла зависит от состава омывающей среды. Одни составные части омывающий металл
- 17. В обоих случаях Fe находится в одном и том же растворе, но в одном случае оно
- 18. Окисляется Zn, как более активный металл А (-) отщепляющиеся от его атомов перемещаются на поверхность Fe
- 19. В обоих случаях Fe находится в одном и том же растворе, но в одном случае оно
- 20. А (-) К (+) Cu Реакция растворенного в воде кислорода с железом приводит к образованию бурой
- 21. Коррозия металла резко усиливается, если он соприкасается с каким-либо другим, менее активным металлом, т. е. расположенным
- 23. Защита от коррозии - Изоляция металла от среды - Изменение состава металла (сплава) - Изменение среды
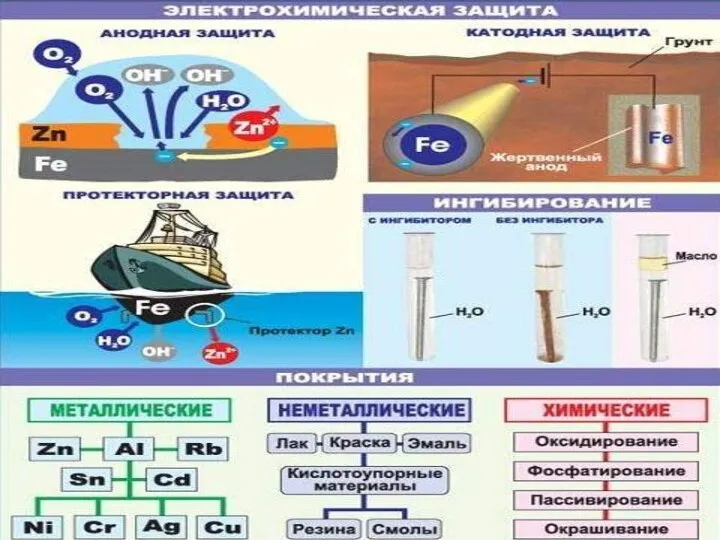
- 24. Барьерная защита - механическая изоляция поверхности при использовании поверхностных защитных покрытий: неметаллических (лаки, краски, смазки, эмали,
- 25. Какое поверхностное защитное покрытие использовалось в данном случае? К какой группе поверхностных защитных покрытий оно относится?
- 26. Какое поверхностное защитное покрытие использовалось в данном случае? К какой группе поверхностных защитных покрытий оно относится?
- 27. Изменение состава металла (сплава) Протекторная защита - добавление в материал покрытия порошковых металлов, создающих с металлом
- 28. К основной конструкции прикрепляются заклёпки или пластины из более активного металла, которые и подвергаются разрушению. Такую
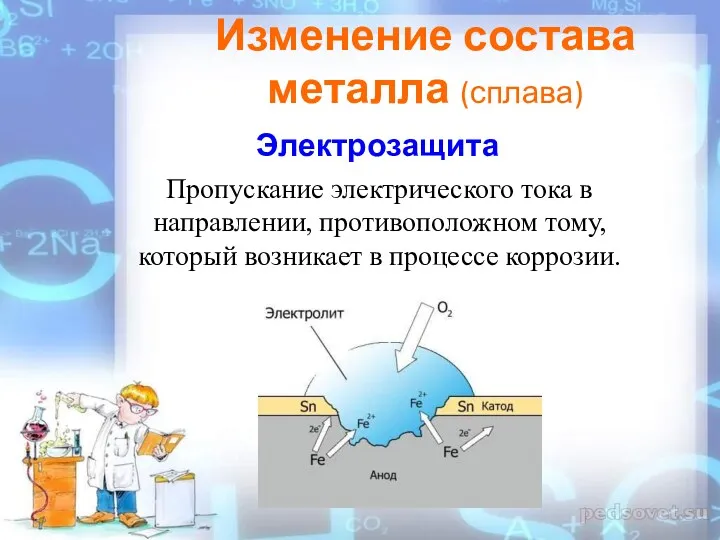
- 29. Пропускание электрического тока в направлении, противоположном тому, который возникает в процессе коррозии. Изменение состава металла (сплава)
- 30. В повседневной жизни человек чаще всего встречается с покрытиями железа цинком и оловом. Листовое железо, покрытое
- 31. Введение в металл легирующих добавок: Cr, Ni, Ti, Mn, Mo, V, W и др. Изменение состава
- 32. Изменение среды Ингибирование Введение веществ, замедляющих коррозию (ингибиторов): - для кислотной коррозии: азотсодержащие органические основания, альдегиды,
- 33. В какой пробирке гвоздь не заржавел и почему? Изменение среды
- 35. Скачать презентацию




























 Осмий. Применение
Осмий. Применение Мир первозданной красоты. Природные уникумы Урала
Мир первозданной красоты. Природные уникумы Урала Кислородные соединения углерода
Кислородные соединения углерода Основания и их свойства
Основания и их свойства Гидрирование альдегидов и кетонов
Гидрирование альдегидов и кетонов Поверхностно-активные вещества
Поверхностно-активные вещества Қайтымды реакция. Химиялық тепе-теңдік
Қайтымды реакция. Химиялық тепе-теңдік Электролиз: его применение
Электролиз: его применение Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Соединения серы
Соединения серы Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Геохимия рудных месторождений
Геохимия рудных месторождений 36fd4612109c46a6a8f3b83635fe0e02
36fd4612109c46a6a8f3b83635fe0e02 Непредельные углеводороды
Непредельные углеводороды Горно-химическое сырье
Горно-химическое сырье Нанотехнологии в школьном образовании. Семинар учителей химии
Нанотехнологии в школьном образовании. Семинар учителей химии Алюминий и его соединения. Строение атома
Алюминий и его соединения. Строение атома Фосфор и его соединения
Фосфор и его соединения Химическая кинетика
Химическая кинетика Общие методические приемы в оценке качества лекарственных форм
Общие методические приемы в оценке качества лекарственных форм Характеристика азота и фосфора. Физические и химические свойства
Характеристика азота и фосфора. Физические и химические свойства Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію Как заменить всю химическую косметику натуральной
Как заменить всю химическую косметику натуральной Метаморфические породы
Метаморфические породы Элементы V группы главной подгруппы
Элементы V группы главной подгруппы Электролитическая диссоциация веществ
Электролитическая диссоциация веществ Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Химия в быту
Химия в быту