Слайд 2

Слайд 3

Қайтымсыз реакциялар
РИО
жану
Кейбір қосылыстардың ыдырауы
1. Тұнбаның түсуі
2. Газ бөліну
3. Өте аз
диссоцияланатын заттар п.б. Н2О
Слайд 4
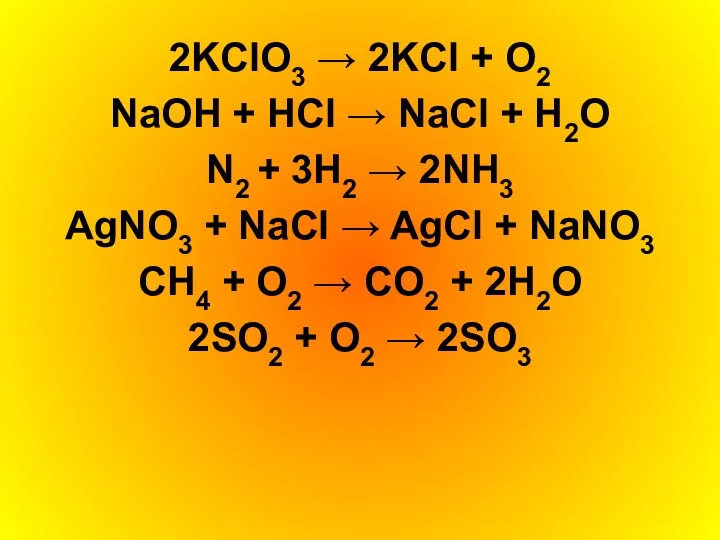
2KClO3 → 2KCl + O2
NaOH + HCl → NaCl + H2O
N2
+ 3H2 → 2NH3
AgNO3 + NaCl → AgCl + NaNO3
CH4 + O2 → CO2 + 2H2O
2SO2 + O2 → 2SO3
Слайд 5
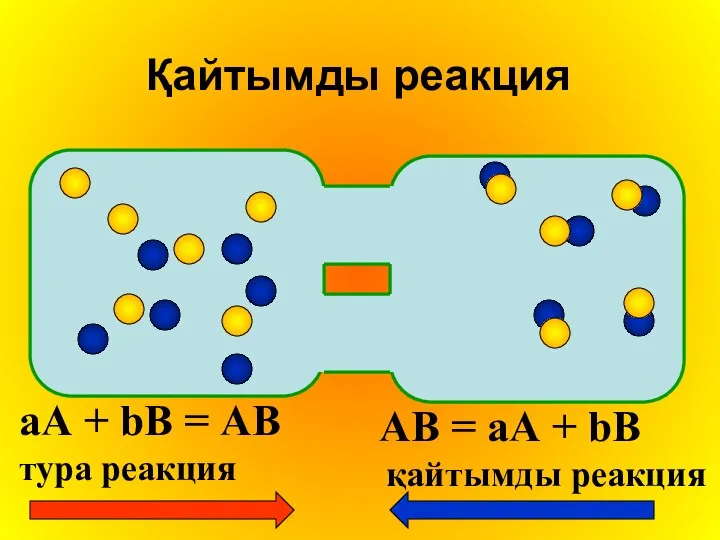
Қайтымды реакция
aА + bВ = АВ
тура реакция
АВ = aА + bВ
қайтымды
реакция
Слайд 6
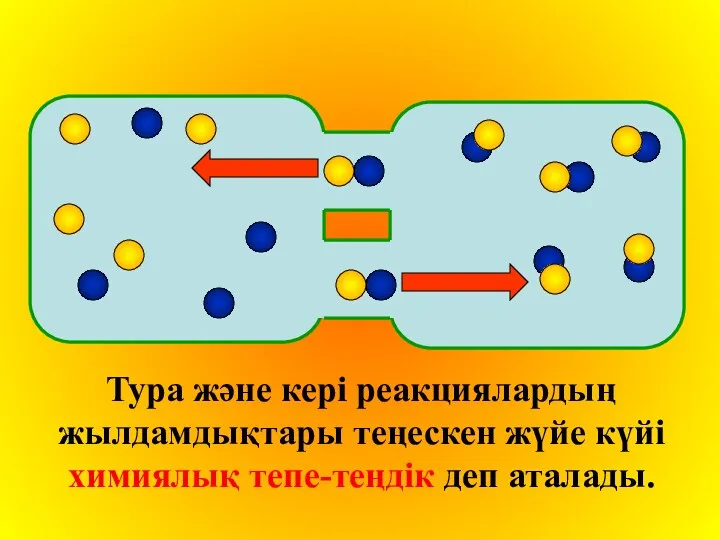
Тура және кері реакциялардың жылдамдықтары теңескен жүйе күйі химиялық тепе-теңдік деп
аталады.
Слайд 7
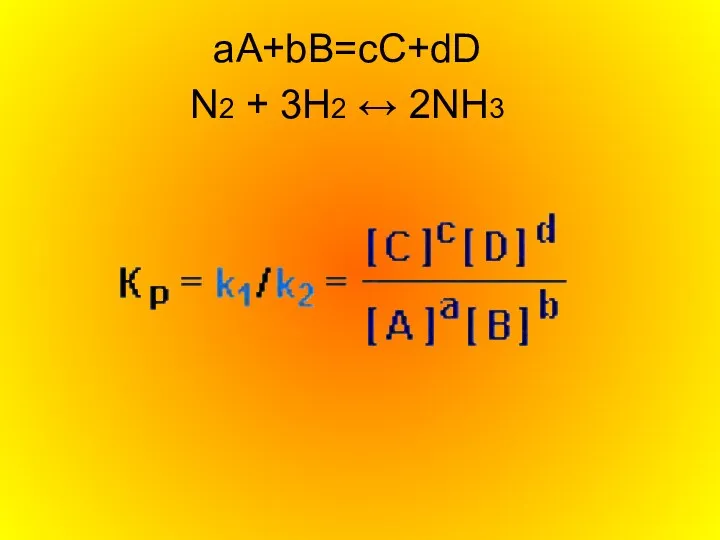
aА+bВ=cC+dD
N2 + 3H2 ↔ 2NH3
Слайд 8

Принцип Ле Шателье
Анри Луи
Ле Шателье
Химиялық тепе-теңдік күйіне келіп тұрған жүйе
жағдайының (концентрация, температура, қысым) біреуін өзгерту, тепе-теңдікті сол өзгертуге қарсы әрекет туғызатын реакция бағытына қарай ығыстырады.
Слайд 9
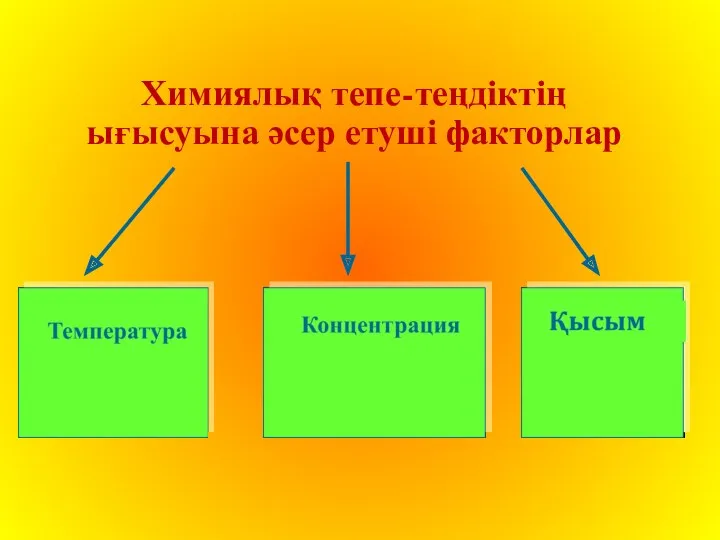
Химиялық тепе-теңдіктің ығысуына әсер етуші факторлар
Слайд 10
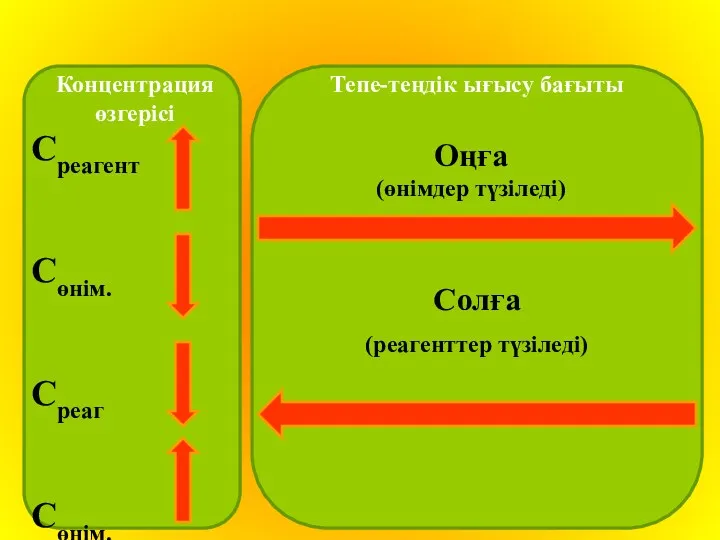
Концентрация өзгерісі
Тепе-теңдік ығысу бағыты
Среагент
Сөнім.
Среаг
Сөнім.
Оңға
(өнімдер түзіледі)
Солға
(реагенттер түзіледі)
Слайд 11
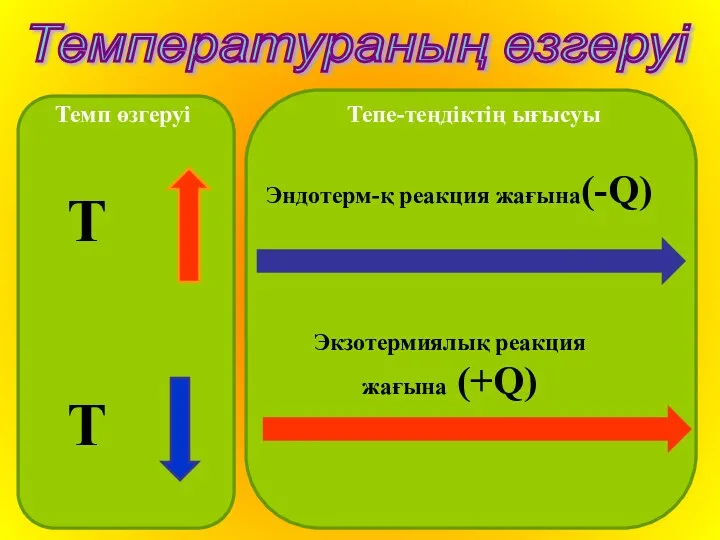
Темп өзгеруі
Тепе-теңдіктің ығысуы
Температураның өзгеруі
Т
Т
Эндотерм-қ реакция жағына(-Q)
Экзотермиялық реакция жағына (+Q)
Слайд 12
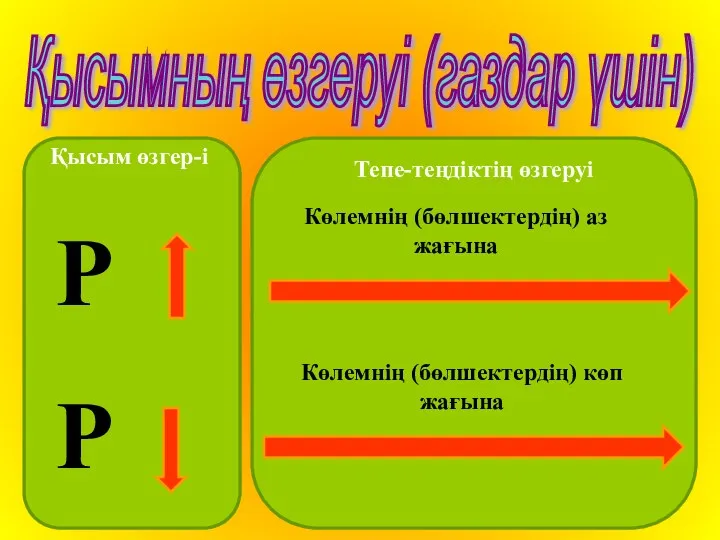
Қысым өзгер-і
Тепе-теңдіктің өзгеруі
Қысымның өзгеруі (газдар үшін)
Р
Р
Көлемнің (бөлшектердің) аз жағына
Көлемнің
(бөлшектердің) көп жағына
Слайд 13
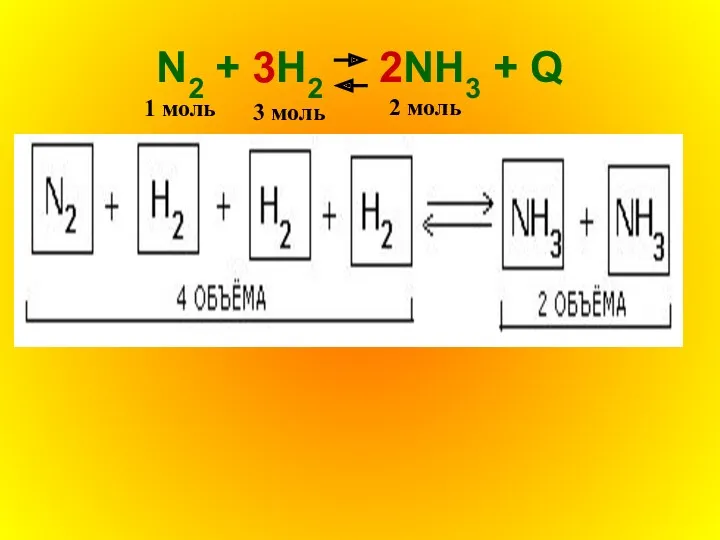
N2 + 3H2 2NH3 + Q
1 моль
3 моль
2 моль
Слайд 14

Тепе-теңдікті өнімдер жағына ығыстыратын факторларды ата:
2NF3(г) + 3H2(г) 6HF(г) + N2(г)
C(г)
+ 2N2O (г) CO2(г) + 2N2(г)
I2(г) + 5CO2(г) I2O5(г) + 5CO(г)
Слайд 15

1) Қандай реакцияда температураны жоғарлатқанда тепе-теңдік солға қарай ығысады?
A) 2HCl ↔
Cl2 + H2 – Q
B) N2 + O2 ↔ 2NO – Q
C) 2H2 + O2 ↔ 2H2O + Q
D) 2SO3 ↔ 2SO2 + O2 - Q
E) I2 + Н2 ↔ 2НI - Q
Слайд 16

2) 2SO2+O2 ↔2SO3+Q реакцияның химиялық тепе-теңдігін ығыстыруға әсер етпейді :
А) катализаторды
қолдану
В) оттегі концентрациясын көбейту
С) қысымды жоғарлату
D) Температураны төмендету
Е) температураны жоғарлату.





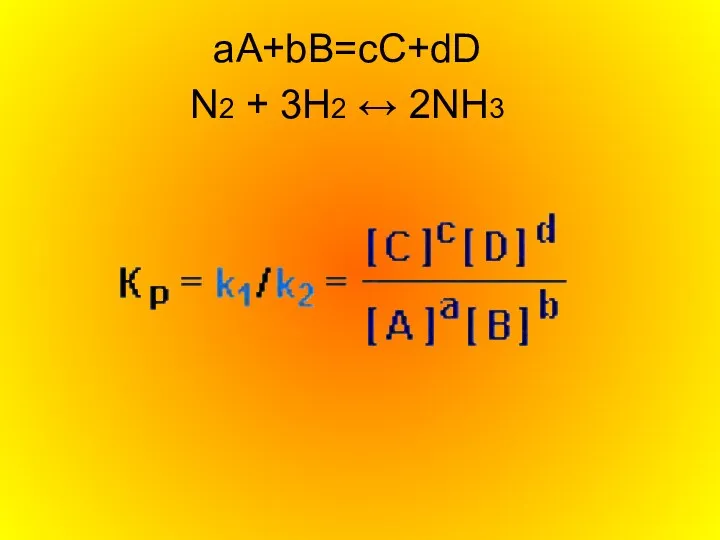









 Поняття про родини хімічних елементів: лужні метали, галогени, інертні елементи. Урок хімії у 8 класі
Поняття про родини хімічних елементів: лужні метали, галогени, інертні елементи. Урок хімії у 8 класі Коллигативные свойства растворов
Коллигативные свойства растворов Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність Свойства природного газа
Свойства природного газа Стали и чугуны. Классификация и маркировка
Стали и чугуны. Классификация и маркировка Химические реакции в растворах электролитов. Обобщение и систематизация знаний
Химические реакции в растворах электролитов. Обобщение и систематизация знаний Щелочные и щелочноземельные металлы
Щелочные и щелочноземельные металлы Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Сложные эфиры
Сложные эфиры Пластмаси. Види пластмас. (11 клас)
Пластмаси. Види пластмас. (11 клас) Волшебница - вода
Волшебница - вода Строение атома и атомного ядра. Изотопы
Строение атома и атомного ядра. Изотопы Твердые смазки
Твердые смазки Маркировка пластиковой посуды
Маркировка пластиковой посуды Термодинамика растворов неэлектролитов
Термодинамика растворов неэлектролитов Модифицированные природные полимеры. Их свойства
Модифицированные природные полимеры. Их свойства Законы химии. Классы неорганических соединений
Законы химии. Классы неорганических соединений Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Дисахариды и полисахариды
Дисахариды и полисахариды Щелочноземельные металлы
Щелочноземельные металлы Теплота горения
Теплота горения Процессы нитрозирования и основные реакции диазосоединений
Процессы нитрозирования и основные реакции диазосоединений Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие
Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие Окислительно- восстановительные реакции
Окислительно- восстановительные реакции Чистые вещества и смеси
Чистые вещества и смеси Прикладная геохимия. Первичные ореолы
Прикладная геохимия. Первичные ореолы Почему протекают химические реакции
Почему протекают химические реакции Электрохимия. Окислительно-восстановительные реакции
Электрохимия. Окислительно-восстановительные реакции