Содержание
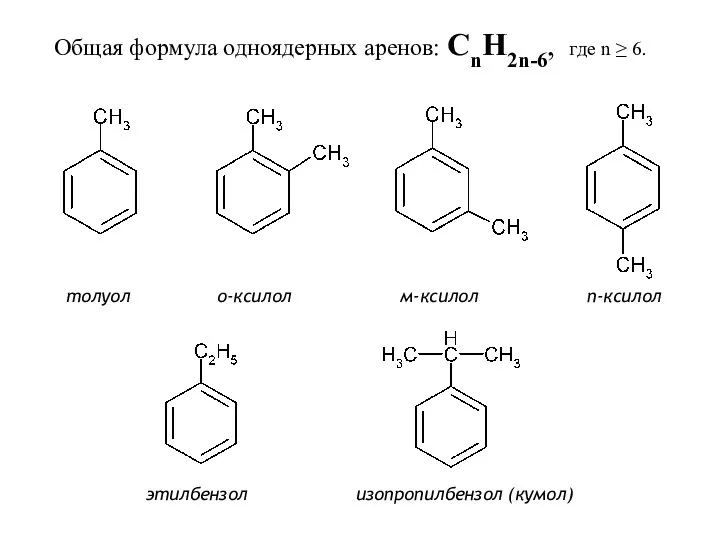
- 2. толуол о-ксилол м-ксилол п-ксилол этилбензол изопропилбензол (кумол) Общая формула одноядерных аренов: CnH2n-6, где n ≥ 6.
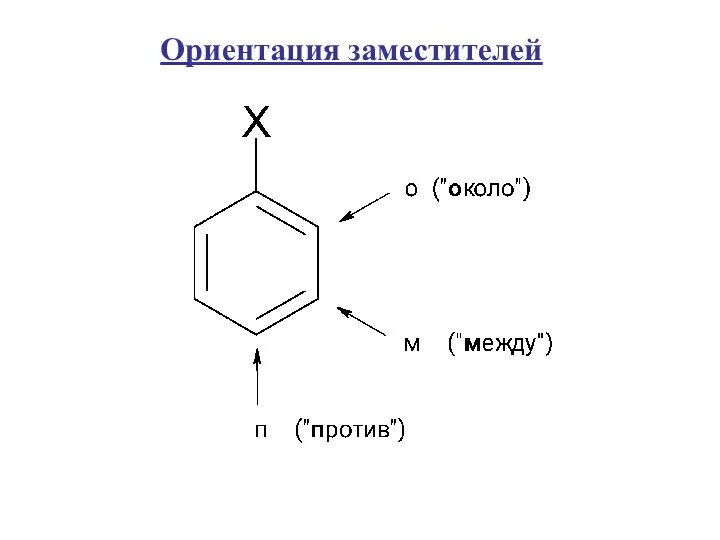
- 3. Ориентация заместителей
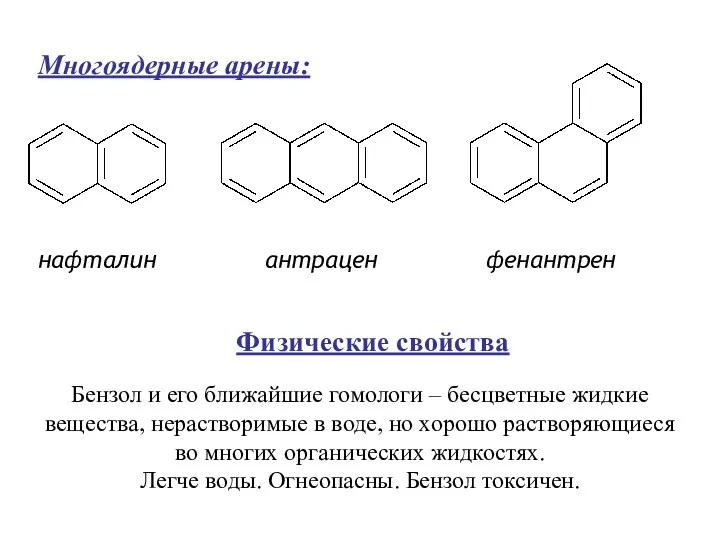
- 4. нафталин антрацен фенантрен Многоядерные арены: Физические свойства Бензол и его ближайшие гомологи – бесцветные жидкие вещества,
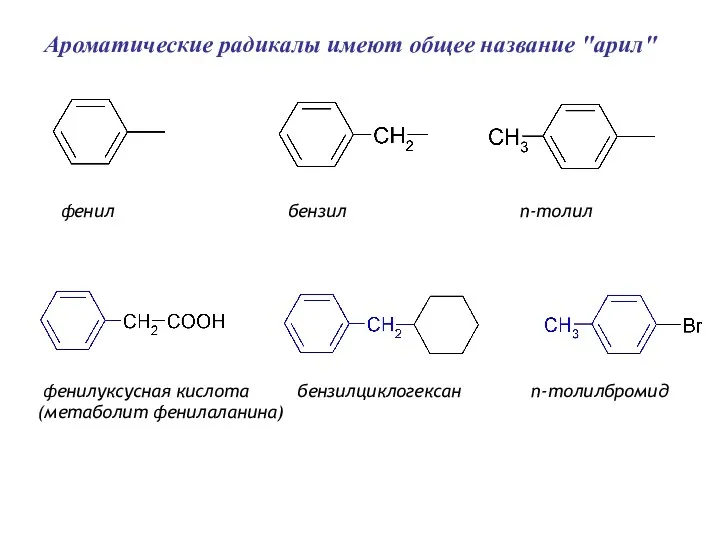
- 5. Ароматические радикалы имеют общее название "арил" фенил бензил п-толил фенилуксусная кислота бензилциклогексан п-толилбромид (метаболит фенилаланина)
- 6. Виды изомерии 1.1. Изомерия положения заместителей (например, о-, м- и п-ксилолы). 1.2. Изомерия углеродного скелета алкильного
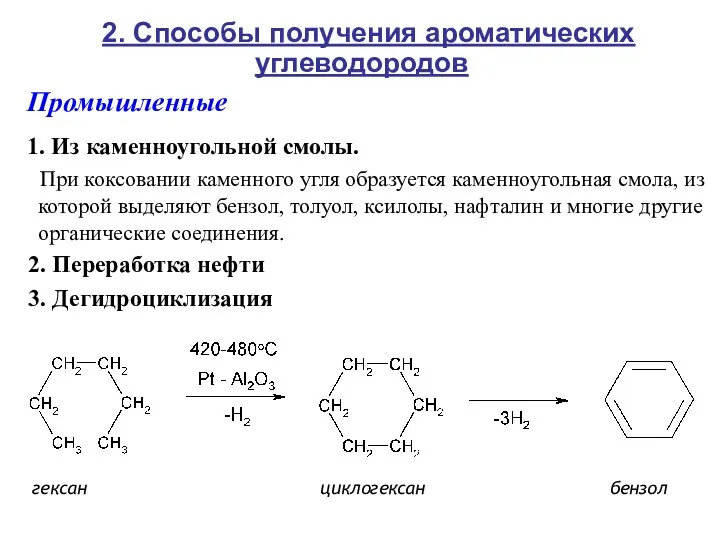
- 7. 2. Способы получения ароматических углеводородов Промышленные 1. Из каменноугольной смолы. При коксовании каменного угля образуется каменноугольная
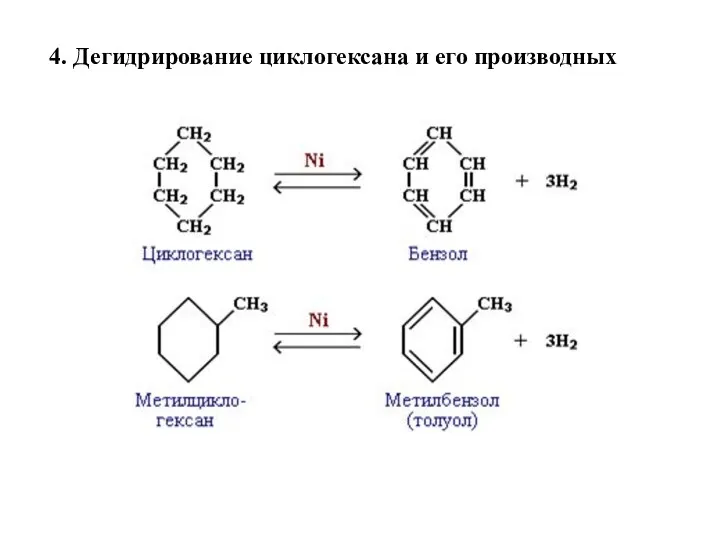
- 8. 4. Дегидрирование циклогексана и его производных
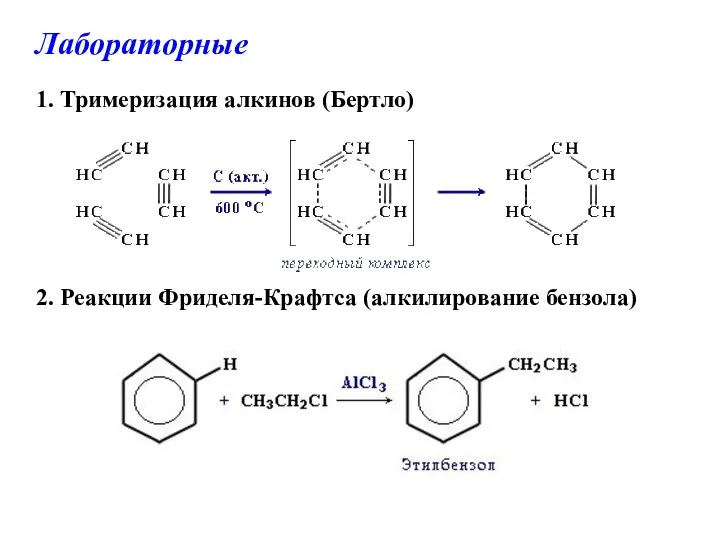
- 9. Лабораторные 1. Тримеризация алкинов (Бертло) 2. Реакции Фриделя-Крафтса (алкилирование бензола)
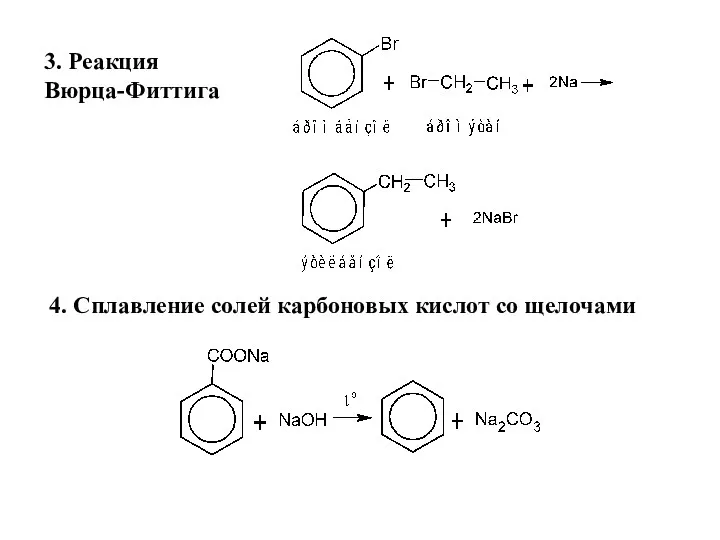
- 10. 3. Реакция Вюрца-Фиттига 4. Сплавление солей карбоновых кислот со щелочами
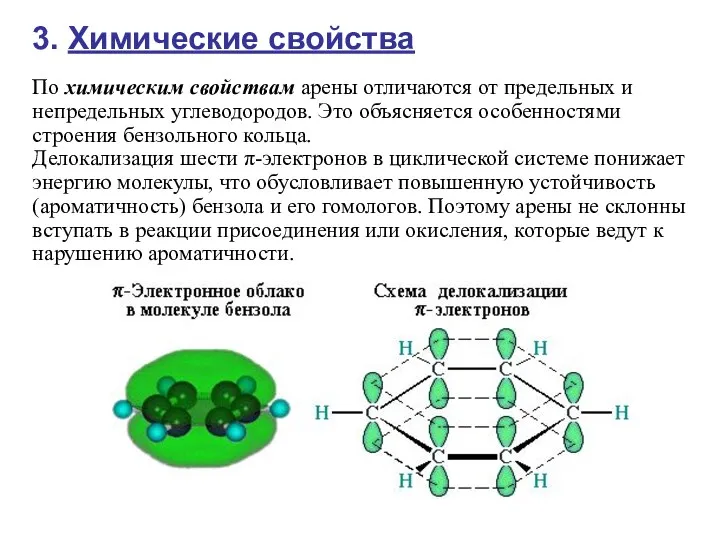
- 11. 3. Химические свойства По химическим свойствам арены отличаются от предельных и непредельных углеводородов. Это объясняется особенностями
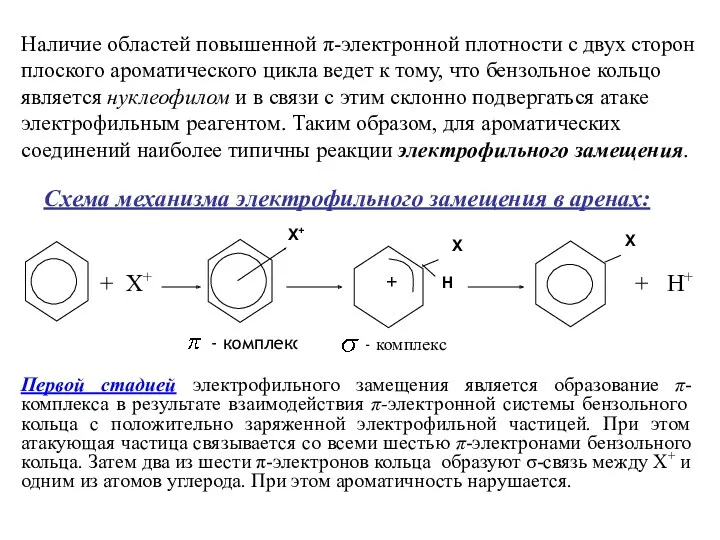
- 12. + X+ + Н+ Наличие областей повышенной π-электронной плотности с двух сторон плоского ароматического цикла ведет
- 13. Вторая стадия состоит в переходе π-комплекса в σ-комплекс (бензониевый ион). Это происходит в результате выделения из
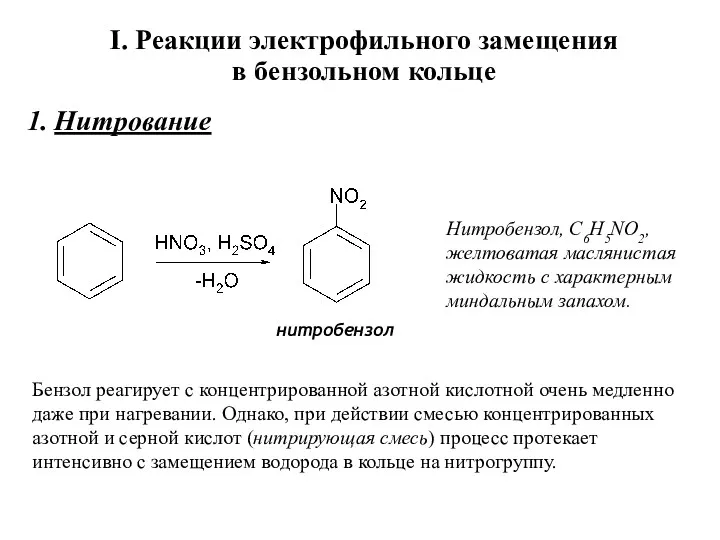
- 14. I. Реакции электрофильного замещения в бензольном кольце 1. Нитрование нитробензол Нитробензол, C6H5NO2, желтоватая маслянистая жидкость с
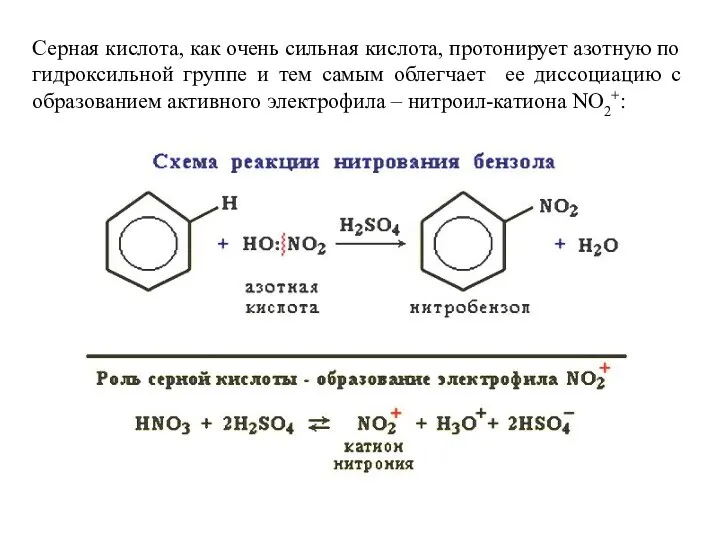
- 15. Серная кислота, как очень сильная кислота, протонирует азотную по гидроксильной группе и тем самым облегчает ее
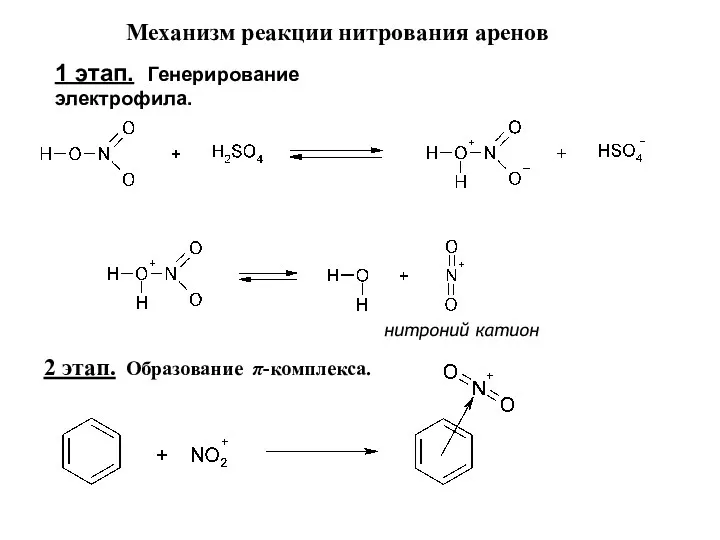
- 16. Механизм реакции нитрования аренов 1 этап. Генерирование электрофила. нитроний катион 2 этап. Образование π-комплекса.
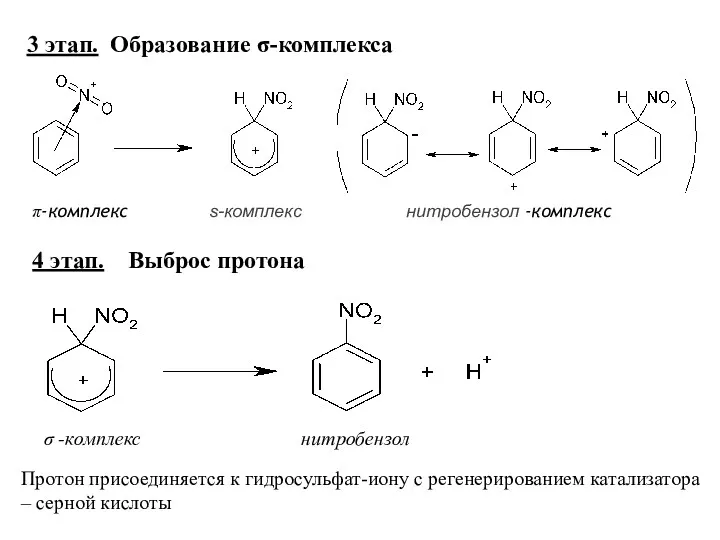
- 17. 3 этап. Образование σ-комплекса π-комплекс s-комплекс нитробензол -комплекс 4 этап. Выброс протона σ -комплекс нитробензол Протон
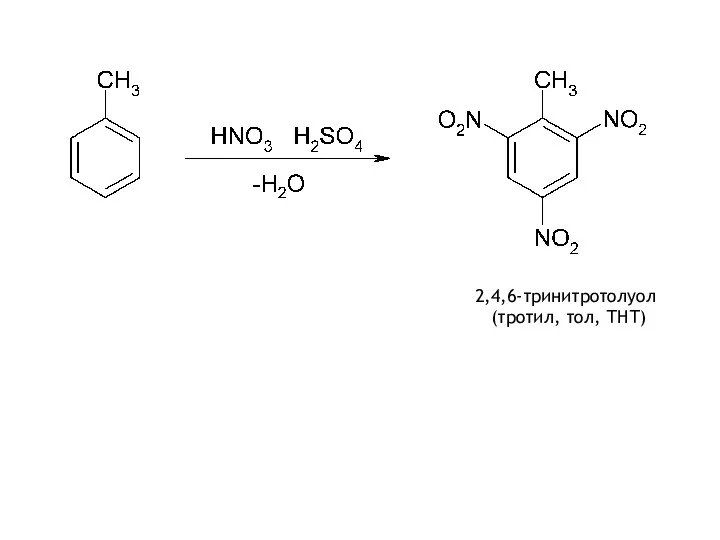
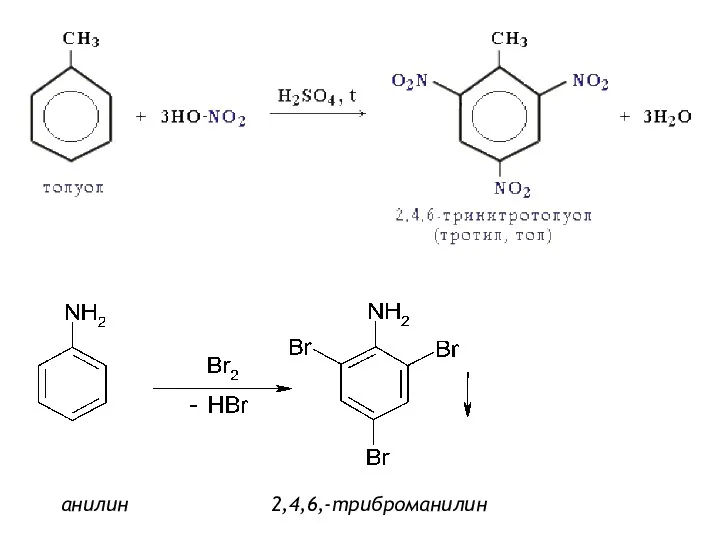
- 18. 2,4,6-тринитротолуол (тротил, тол, ТНТ)
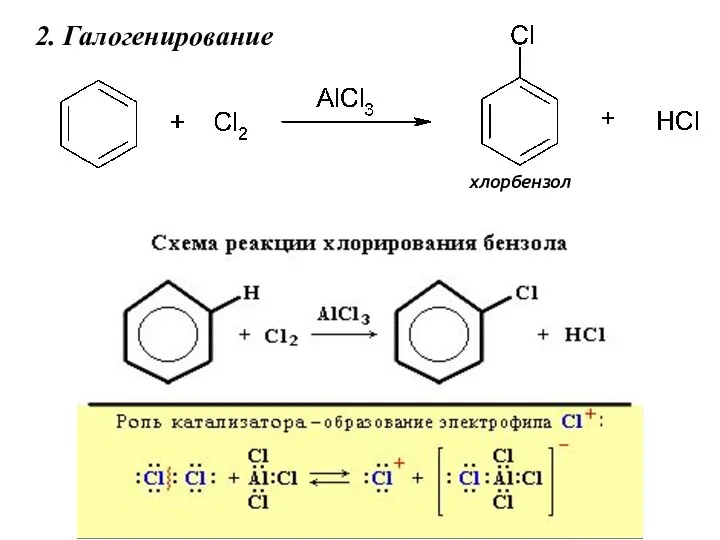
- 19. 2. Галогенирование хлорбензол
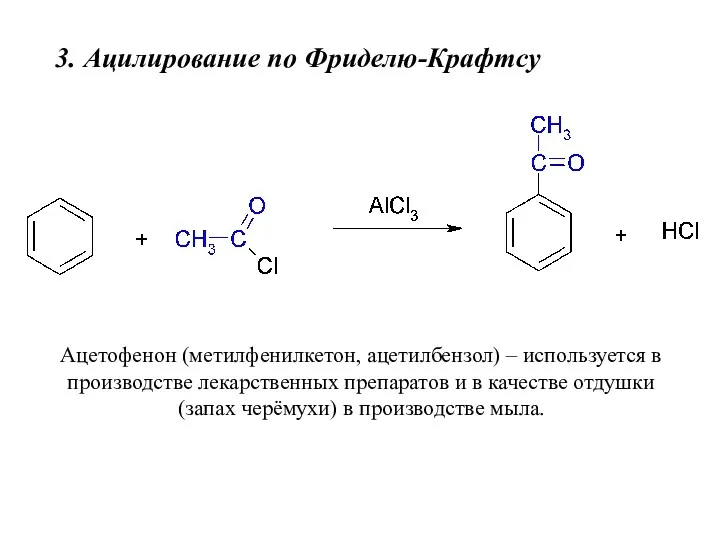
- 20. 3. Ацилирование по Фриделю-Крафтсу Ацетофенон (метилфенилкетон, ацетилбензол) – используется в производстве лекарственных препаратов и в качестве
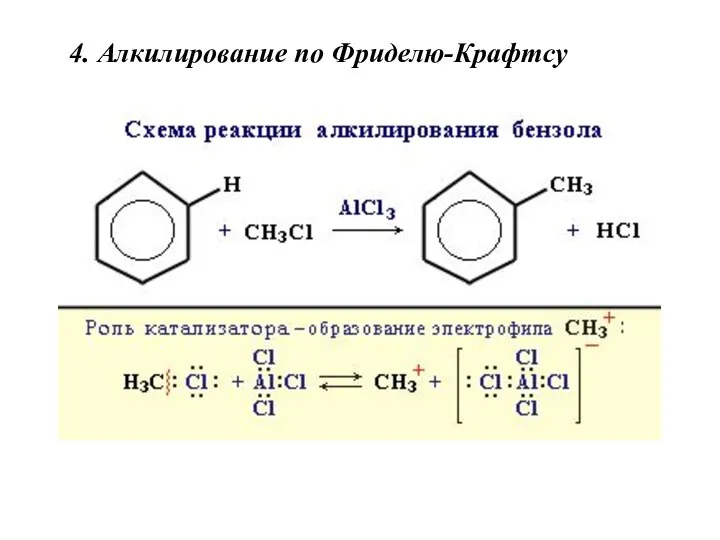
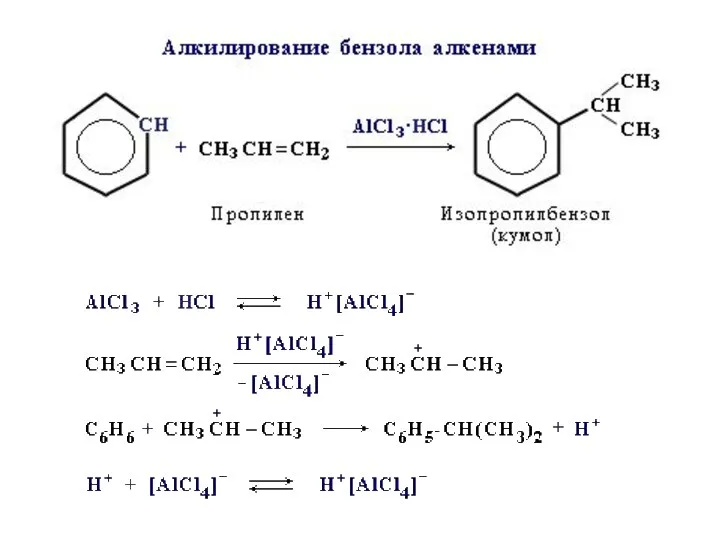
- 21. 4. Алкилирование по Фриделю-Крафтсу
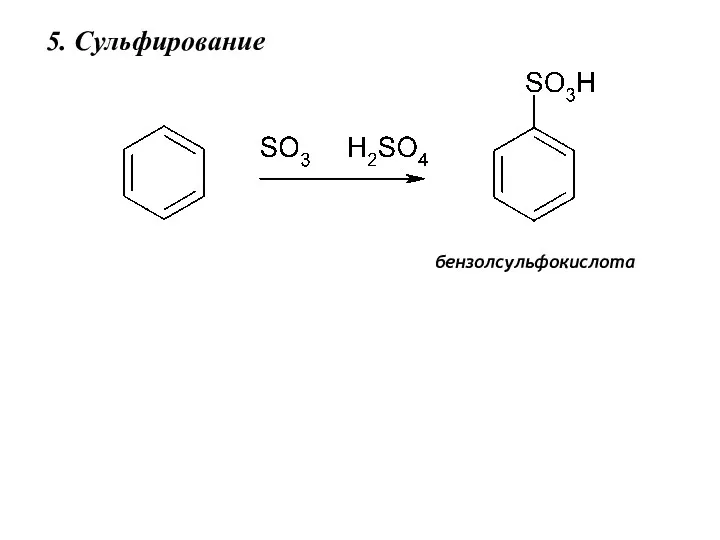
- 23. 5. Сульфирование бензолсульфокислота
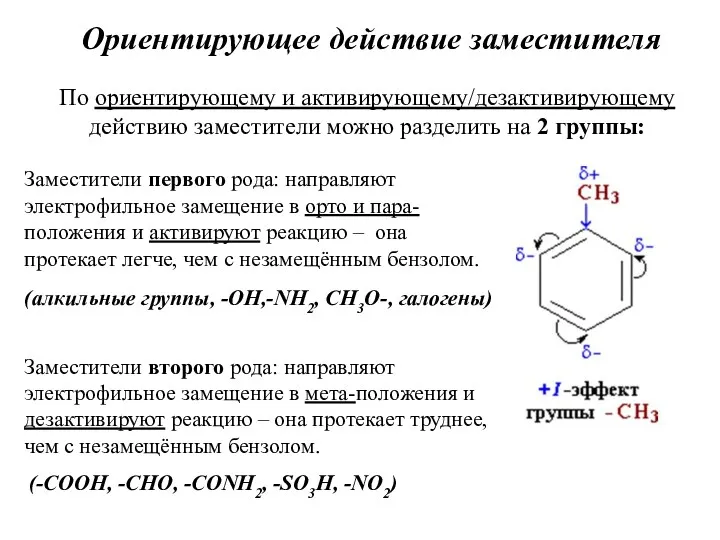
- 24. Ориентирующее действие заместителя (алкильные группы, -OH,-NH2, CH3O-, галогены) Заместители первого рода: направляют электрофильное замещение в орто
- 25. анилин 2,4,6,-триброманилин
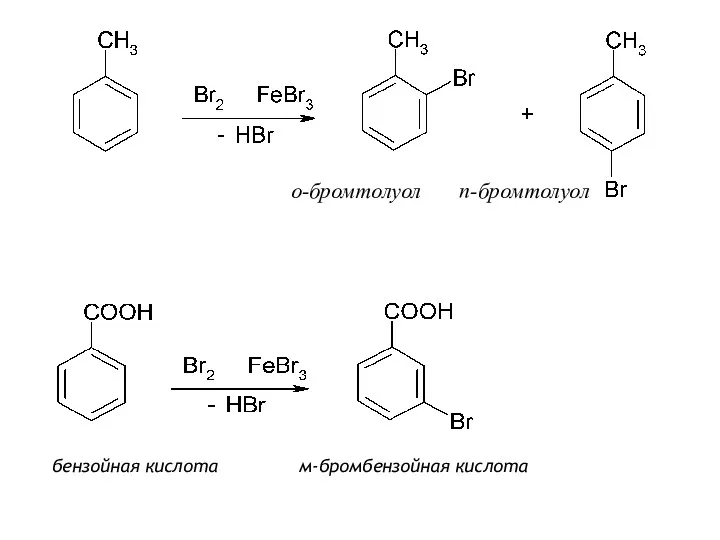
- 26. о-бромтолуол п-бромтолуол бензойная кислота м-бромбензойная кислота
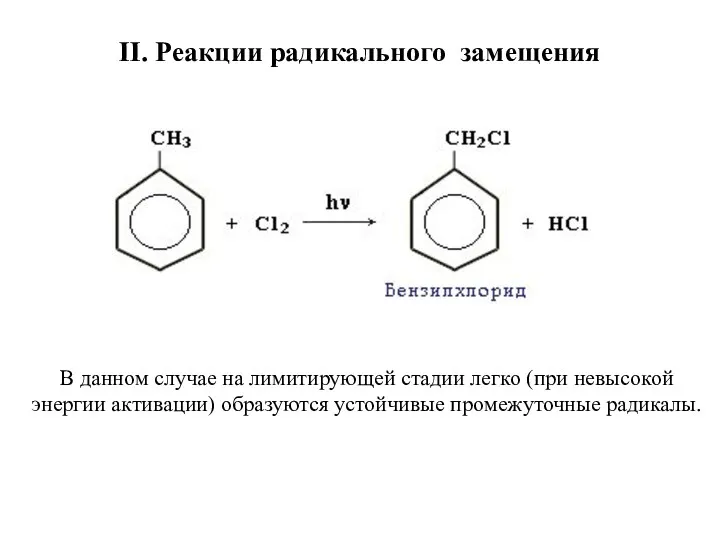
- 27. II. Реакции радикального замещения В данном случае на лимитирующей стадии легко (при невысокой энергии активации) образуются
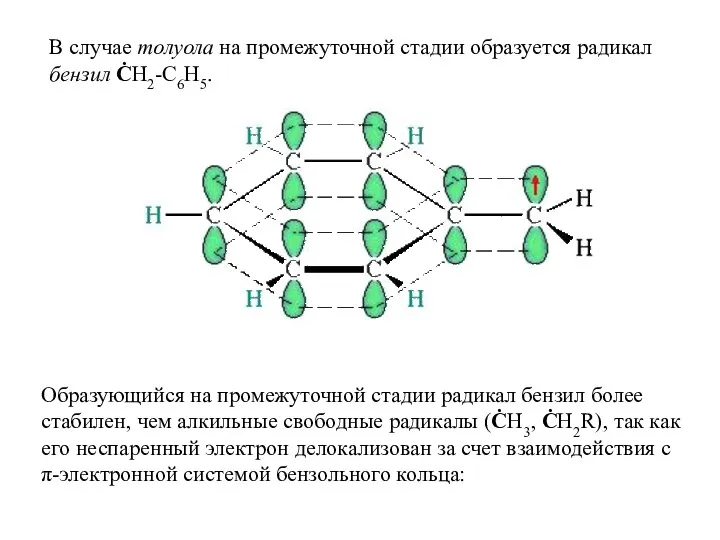
- 28. В случае толуола на промежуточной стадии образуется радикал бензил ĊH2-C6H5. Образующийся на промежуточной стадии радикал бензил
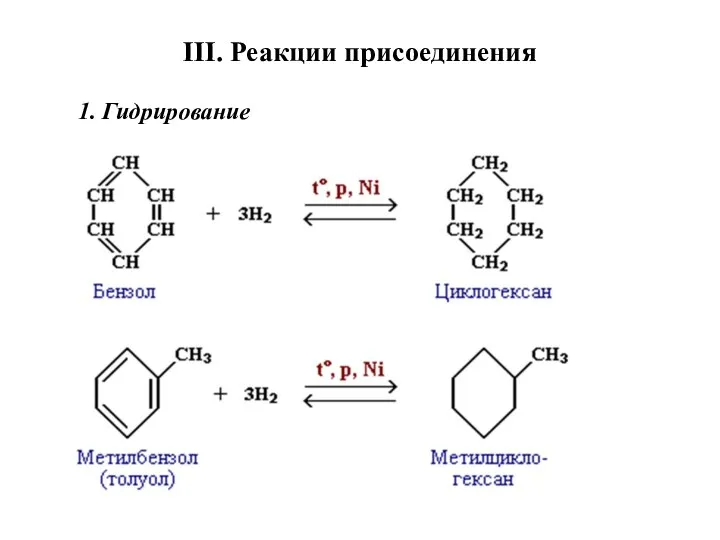
- 29. III. Реакции присоединения 1. Гидрирование
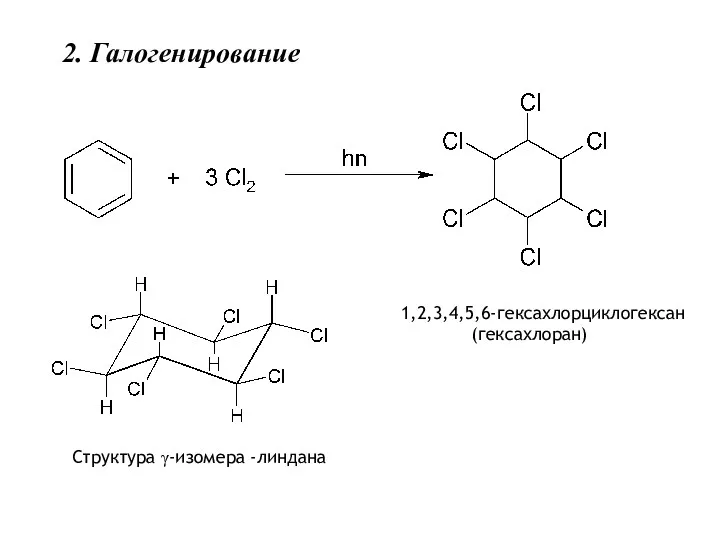
- 30. 2. Галогенирование Структура γ-изомера -линдана 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран)
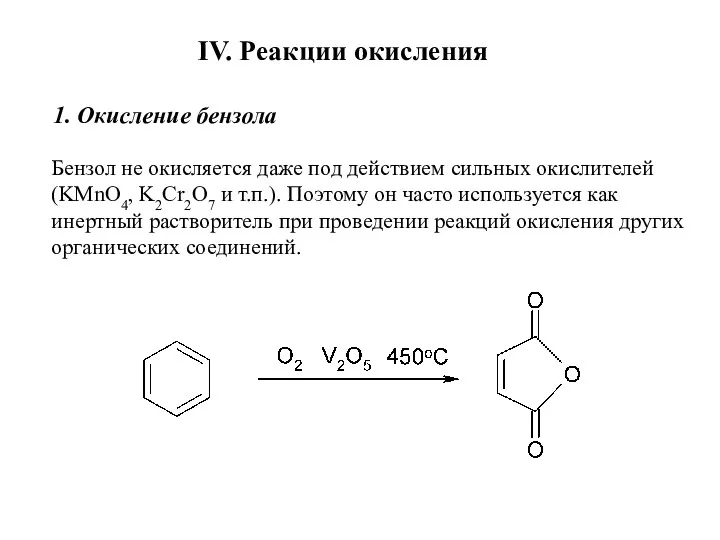
- 31. IV. Реакции окисления 1. Окисление бензола Бензол не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7
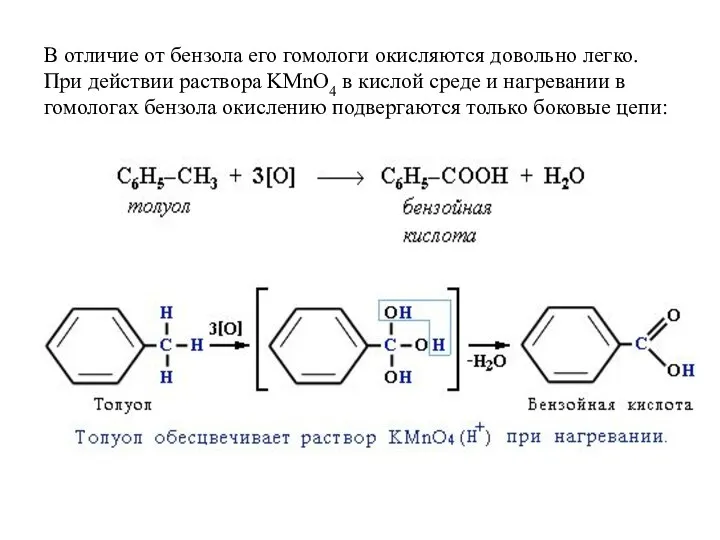
- 32. В отличие от бензола его гомологи окисляются довольно легко. При действии раствора KMnO4 в кислой среде
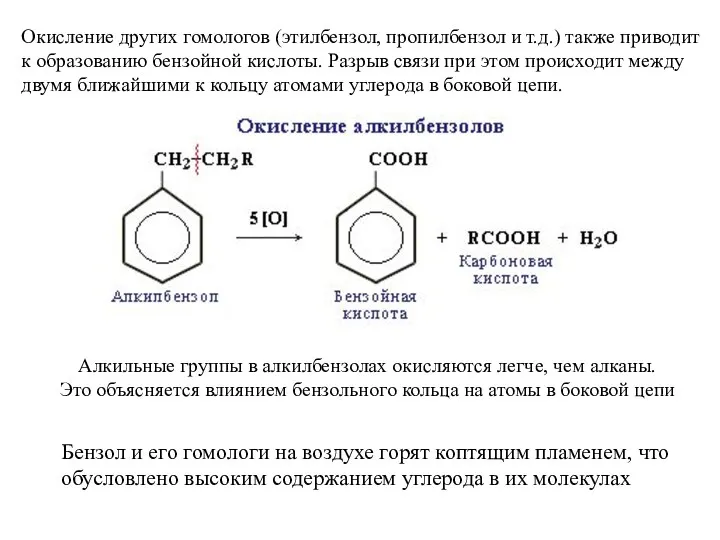
- 33. Окисление других гомологов (этилбензол, пропилбензол и т.д.) также приводит к образованию бензойной кислоты. Разрыв связи при
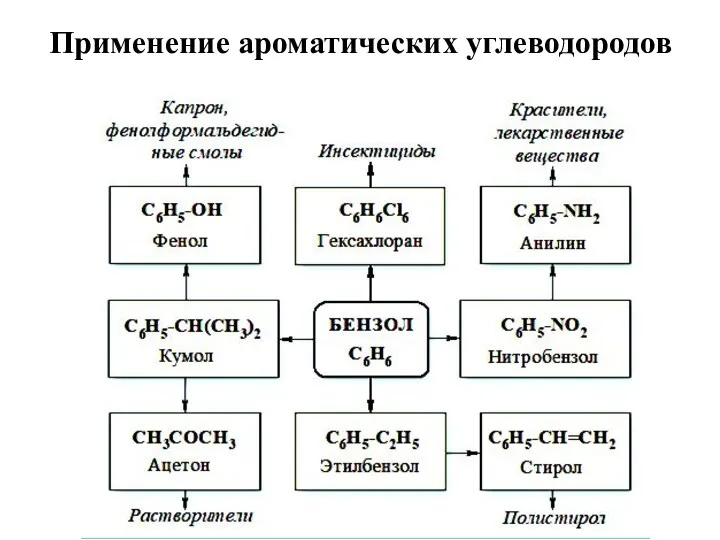
- 34. Применение ароматических углеводородов
- 36. Скачать презентацию


 Теобромин
Теобромин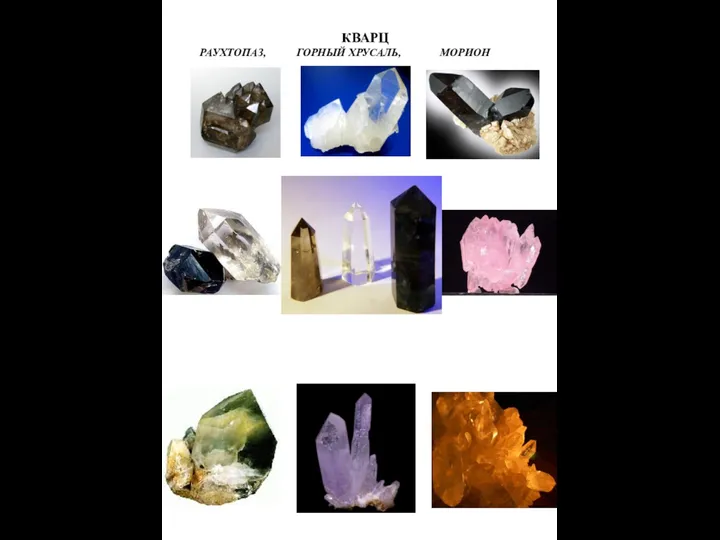 Кварц
Кварц Титриметрический метод анализа
Титриметрический метод анализа Будова електронних оболонок атомів
Будова електронних оболонок атомів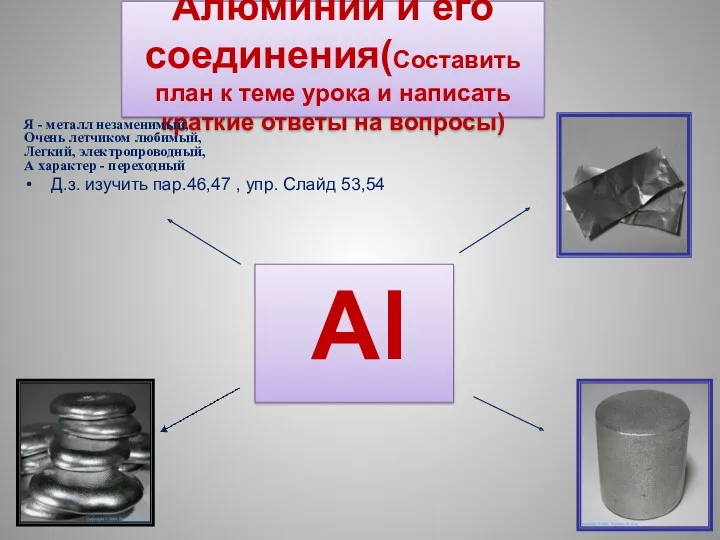 Алюминий и его соединения
Алюминий и его соединения Алкадиены
Алкадиены Химический элемент гелий
Химический элемент гелий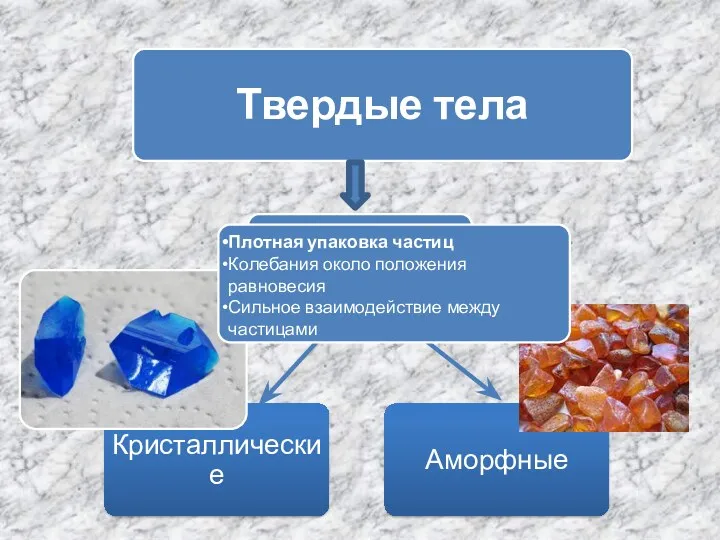 Твердые тела - кристаллические и аморфные
Твердые тела - кристаллические и аморфные Основания. Химические свойства оснований. Сильные и слабые основания
Основания. Химические свойства оснований. Сильные и слабые основания Нефть и нефтепродукты. Происхождение. Состав. Свойства. Переработка
Нефть и нефтепродукты. Происхождение. Состав. Свойства. Переработка Углеводы. Общая характеристика углеводов
Углеводы. Общая характеристика углеводов Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение
Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение Кристаллические решетки
Кристаллические решетки Атом құрылысы Сu. Биологиялық маңызы
Атом құрылысы Сu. Биологиялық маңызы Коррозия металлов
Коррозия металлов Распределение элементов на Земле и в космосе
Распределение элементов на Земле и в космосе Гидроксид магния. Mg(OH)2
Гидроксид магния. Mg(OH)2 Аспирин: польза или вред?
Аспирин: польза или вред? Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ
Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ Электролиз – ОВ процесс
Электролиз – ОВ процесс Минералы и их свойства
Минералы и их свойства Химические уравнения Закон сохранения массы веществ
Химические уравнения Закон сохранения массы веществ Химический состав клетки
Химический состав клетки Электронная конфигурация К. Классификация химических элементов. 8 класс
Электронная конфигурация К. Классификация химических элементов. 8 класс Металлы; их классификация, строения и свойства
Металлы; их классификация, строения и свойства Введение в токсикологическую химию. Объекты химико-токсикологического исследования
Введение в токсикологическую химию. Объекты химико-токсикологического исследования Фармацевтический анализ лекарственных средств группы алкилуреидов сульфокислот
Фармацевтический анализ лекарственных средств группы алкилуреидов сульфокислот Понятия про синтетические лекарственные средства
Понятия про синтетические лекарственные средства