Содержание
- 2. Сущность титриметрического анализа Основан на измерении объема реагента точно известной концентрации, затраченного на реакцию с определяемым
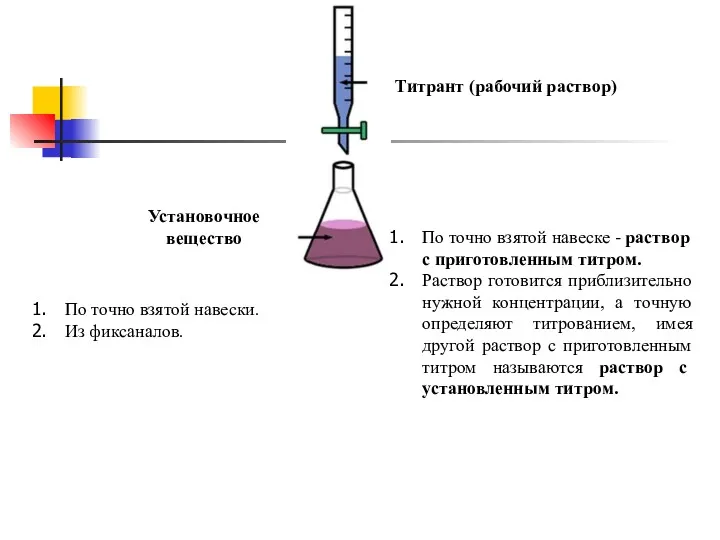
- 3. Основные понятия Титрование – процесс постепенного прибавления по каплям раствора-титранта к анализируемому раствору. Титрант (рабочий раствор)
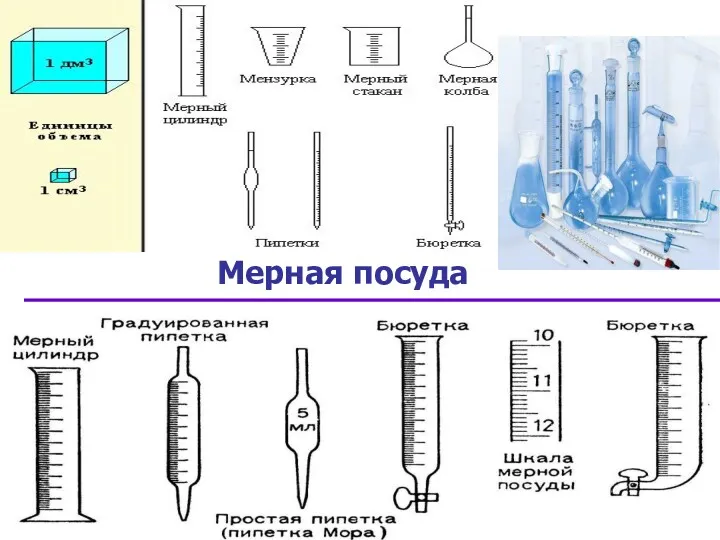
- 4. Мерная посуда
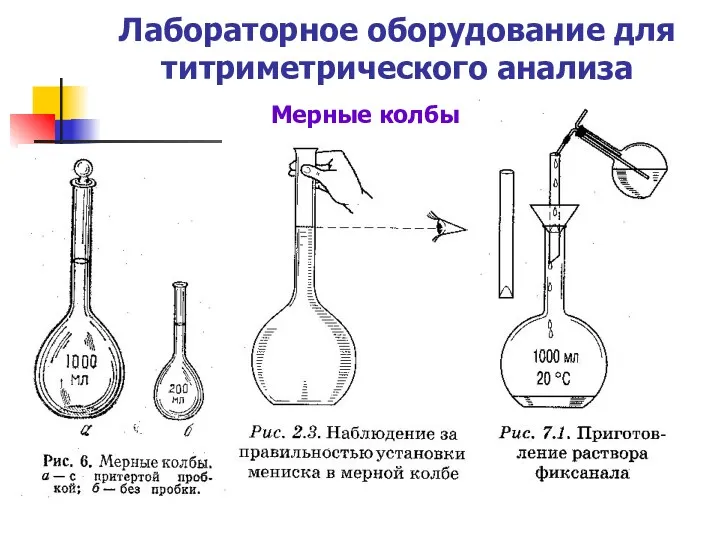
- 5. Лабораторное оборудование для титриметрического анализа Мерные колбы
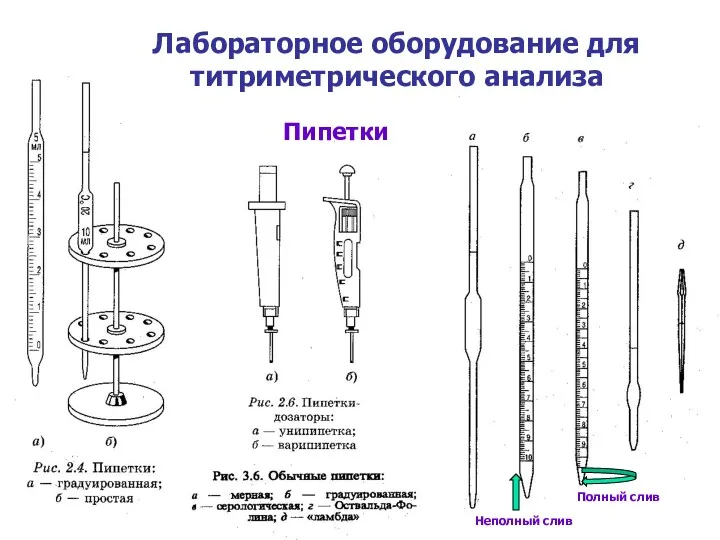
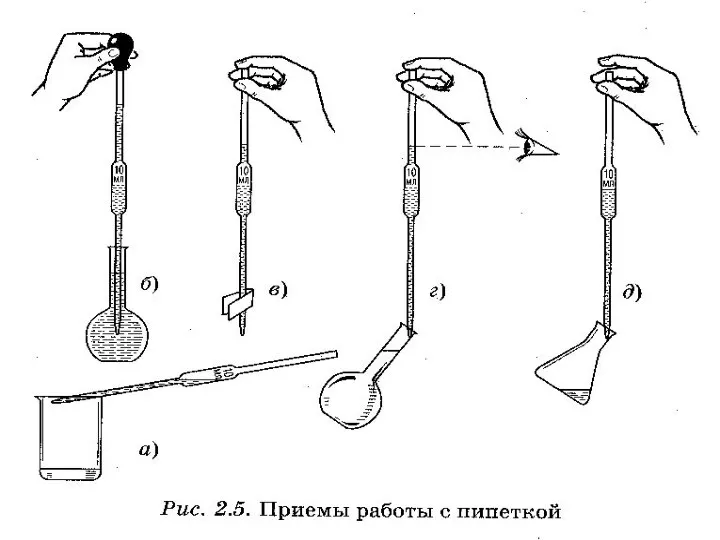
- 7. Лабораторное оборудование для титриметрического анализа Пипетки Пипетки Неполный слив Полный слив
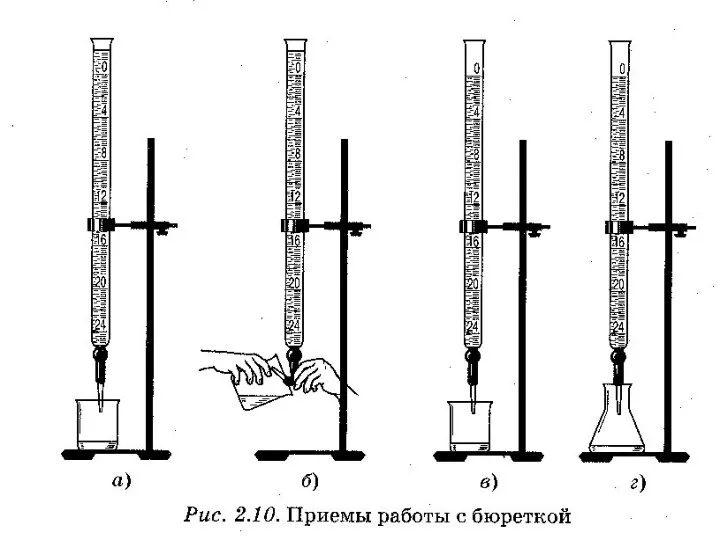
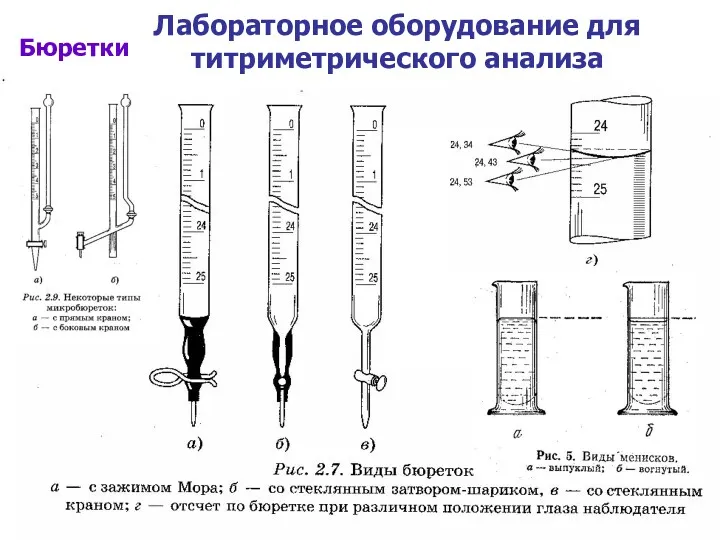
- 8. Лабораторное оборудование для титриметрического анализа Бюретки
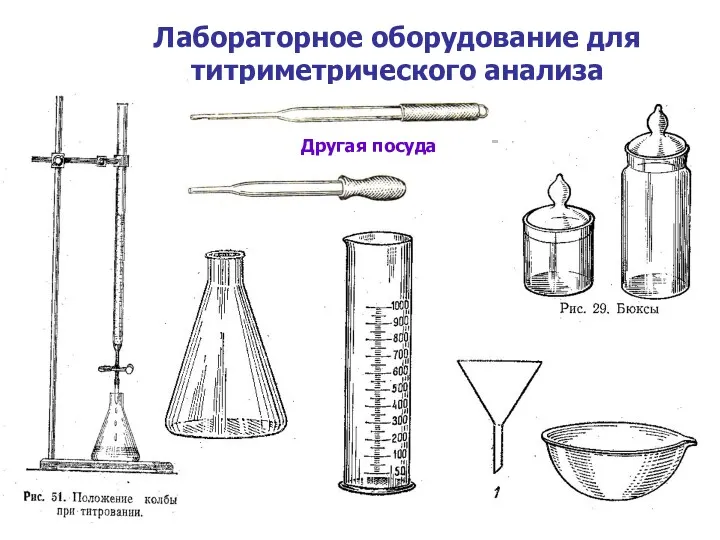
- 10. Лабораторное оборудование для титриметрического анализа Другая посуда
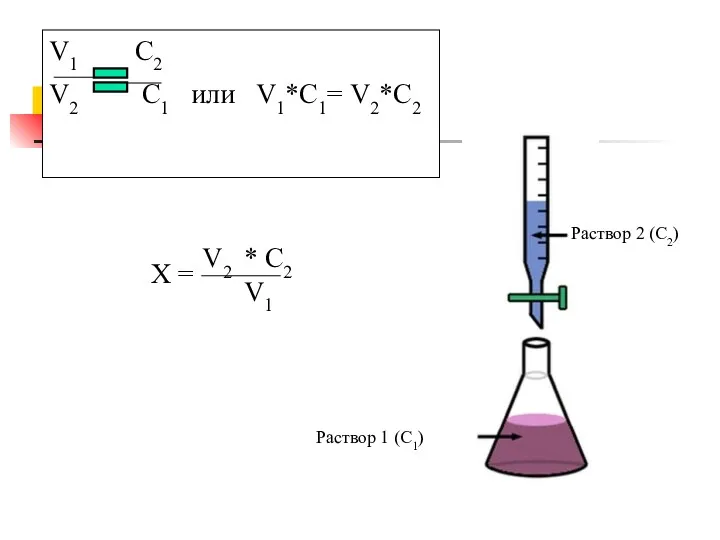
- 11. V1 С2 V2 С1 или V1*С1= V2*С2 Х = V2 * С2 V1 Раствор 1 (С1)
- 12. Титрант (рабочий раствор) По точно взятой навеске - раствор с приготовленным титром. Раствор готовится приблизительно нужной
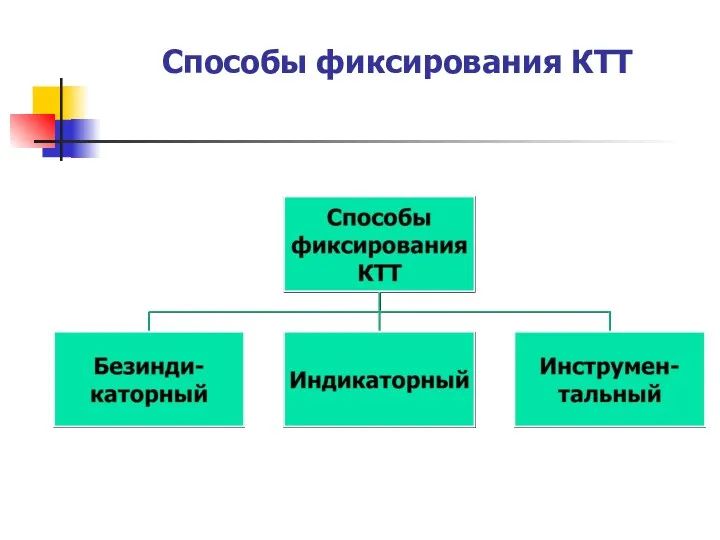
- 13. Способы фиксирования КТТ
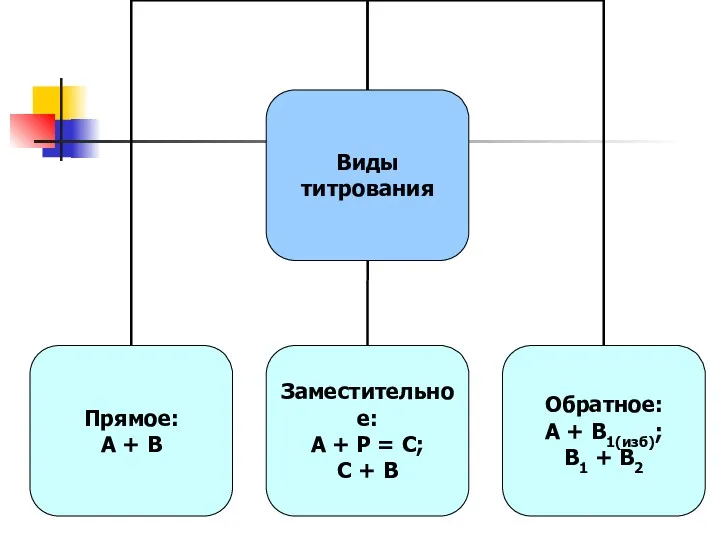
- 15. прямое, когда при титровании происходит реакция между определяемым веществом и титрантом; обратное, когда к определяемому раствору
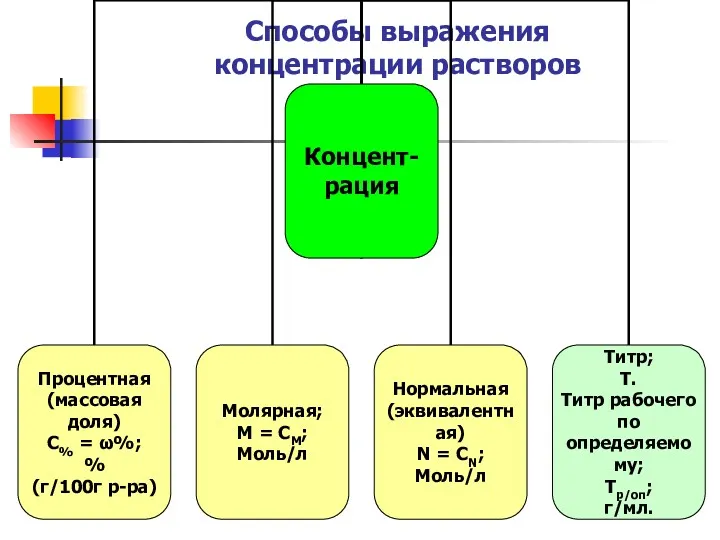
- 16. Способы выражения концентрации растворов
- 17. Стандартные и стандартизированные растворы Стандартные, первичные стандарты (с приготовленным титром). Готовятся по точной навеске. Точную концентрацию
- 18. Стандартные растворы Это титрованные растворы, приготовленные по точной навеске. К ним относятся растворы установочных веществ. Установочные
- 19. Стандартизированные растворы Это растворы, приготовленные по приблизительной навеске, титр их устанавливают стандартизацией. Свойства этих веществ: Неустойчивые
- 20. Требования к химическим реакциям в титриметрическом анализе Реакция должна протекать: по строго определенному стехиометрическому уравнению, побочные
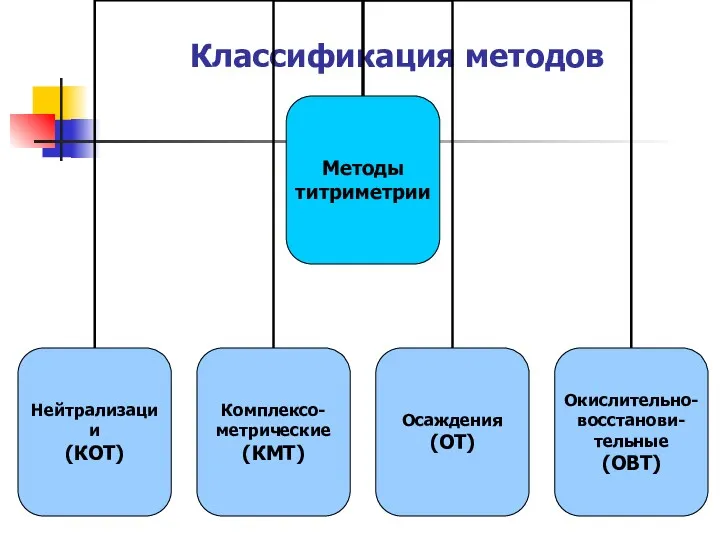
- 21. Классификация методов
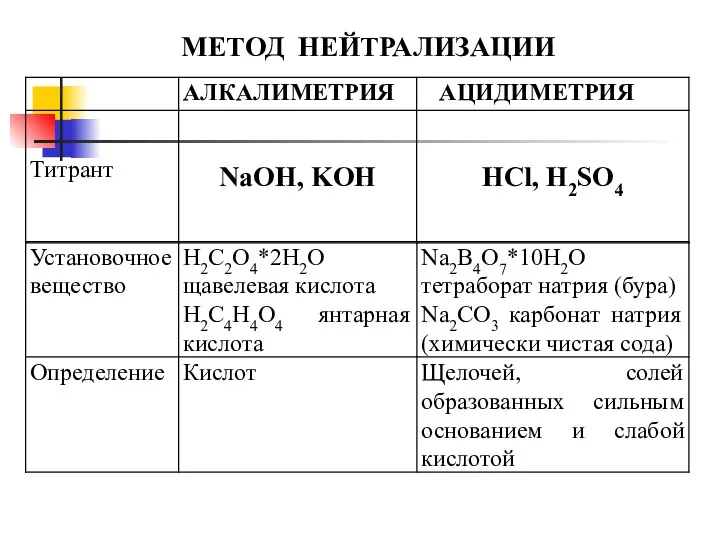
- 22. В основе метода лежит реакция нейтрализации Н+ + ОН- Н2О МЕТОД НЕЙТРАЛИЗАЦИИ Классификация методов анализа Алкалиметрия
- 23. МЕТОД НЕЙТРАЛИЗАЦИИ
- 24. МЕТОД НЕЙТРАЛИЗАЦИИ Кислотно-основные индикаторы (рН - индикаторы)
- 25. МЕТОД НЕЙТРАЛИЗАЦИИ Кислотно-основные индикаторы (рН - индикаторы) Значение рН, при котором происходит резкое изменение значения рН
- 26. В основе методов КОТ лежит реакция нейтрализации. Что это за реакция? В основе методов КМТ лежат
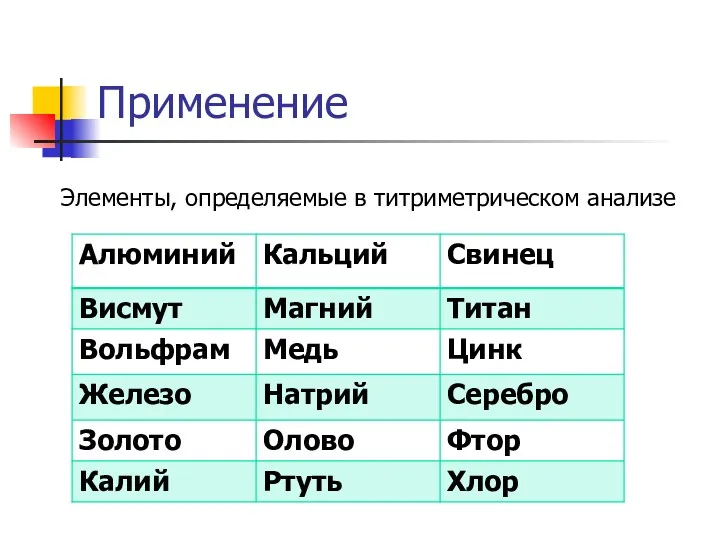
- 27. Применение Элементы, определяемые в титриметрическом анализе
- 28. Погрешности титриметрического анализа Погрешности взвешивания; Погрешности измерения объема; Погрешности определения титра раствора; Погрешности титрования анализируемого раствора.
- 30. Скачать презентацию












 Формирование ключевых компетенций на уроках химии
Формирование ключевых компетенций на уроках химии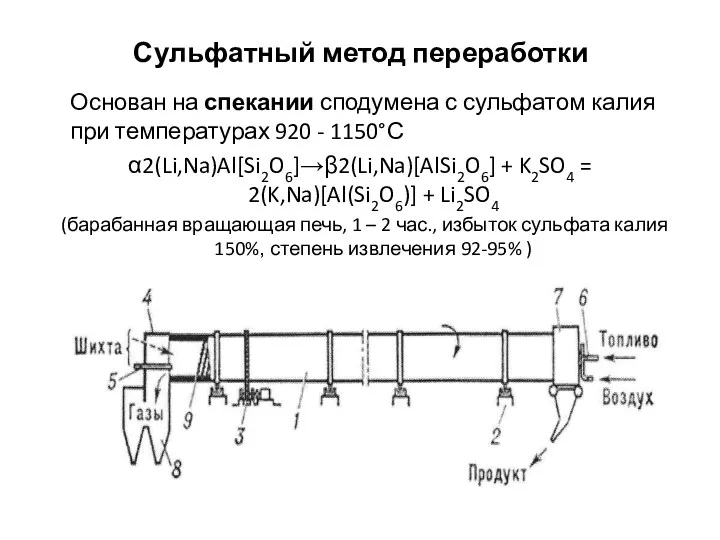 Сульфатный метод переработки
Сульфатный метод переработки Альтернативная бытовая химия
Альтернативная бытовая химия Теория строения органических веществ. Предельные углеводороды. 9 класс
Теория строения органических веществ. Предельные углеводороды. 9 класс Химическая промышленность и химические технологии
Химическая промышленность и химические технологии Кислород
Кислород Гидроксипроизводные углеводородов. Спирты. Фенолы
Гидроксипроизводные углеводородов. Спирты. Фенолы Функциональные производные с кратной связью C=“Э”. Часть 1. Карбонильные соединения и имины
Функциональные производные с кратной связью C=“Э”. Часть 1. Карбонильные соединения и имины Попутные нефтяные газы
Попутные нефтяные газы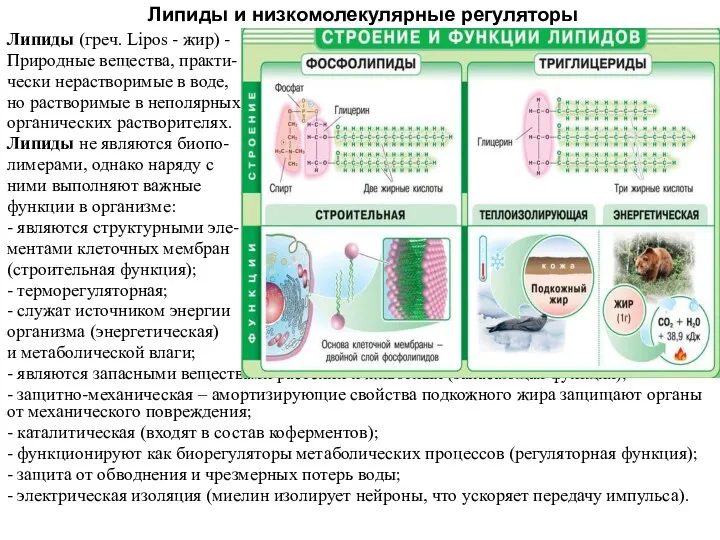 Липиды и низкомолекулярные регуляторы
Липиды и низкомолекулярные регуляторы Серная кислота и её свойства
Серная кислота и её свойства Чистые вещества и смеси. Способы разделения смесей
Чистые вещества и смеси. Способы разделения смесей Химический состав живого. Лекция 2
Химический состав живого. Лекция 2 Аммиак (9 класс)
Аммиак (9 класс)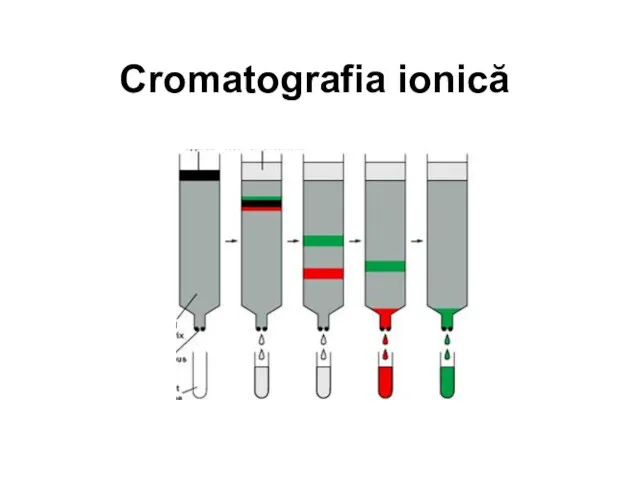 Cromatografia ionică
Cromatografia ionică Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Марганец
Марганец Галогены. Фтор, хлор, бром, йод, астат
Галогены. Фтор, хлор, бром, йод, астат Законы химии
Законы химии Химиялық өнеркәсіп шикізаты . Шикізат көздері Химиялық өндірістегі энергия және энергия көздері
Химиялық өнеркәсіп шикізаты . Шикізат көздері Химиялық өндірістегі энергия және энергия көздері Применение закона действующих масс к окислительно-восстановительным равновесиям. (Лекция 6)
Применение закона действующих масс к окислительно-восстановительным равновесиям. (Лекция 6) Химический элемент. Электронное строение атома
Химический элемент. Электронное строение атома Задачи
Задачи МОЛЯРНЫЙ ОБЪЕМ Химия 8 класс
МОЛЯРНЫЙ ОБЪЕМ Химия 8 класс Химические свойства кислот
Химические свойства кислот Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома
Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома Кристалл. Основные законы кристаллографии
Кристалл. Основные законы кристаллографии Бензол. Физические и химические свойства
Бензол. Физические и химические свойства