Содержание
- 2. Клетки большинства живых организмов имеют сходный химический состав, но он существенно отличается от химического состава окружающей
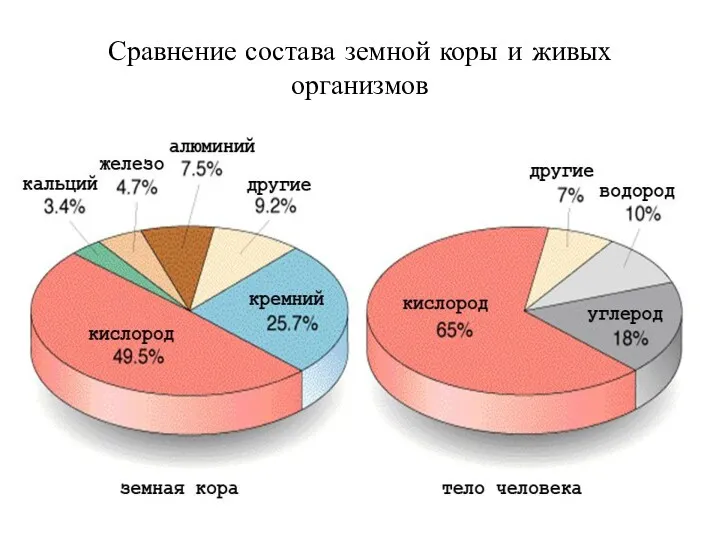
- 3. Сравнение состава земной коры и живых организмов
- 4. Еще около 1,8 % составляют в сумме такие элементы. как фосфор (Р), сера (S), натрий (Na),
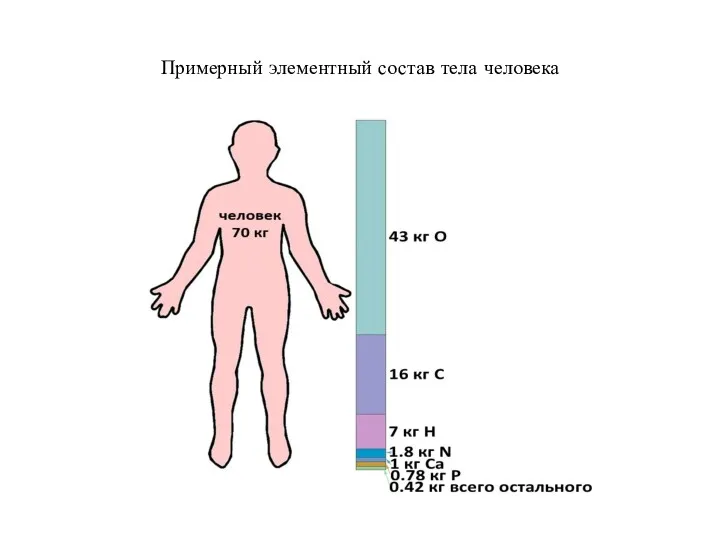
- 5. На долю всех макроэлементов приходится примерно 99,9 % массы тела человека Кроме того, два из них,
- 6. Примерный элементный состав тела человека
- 7. Микроэлементы Эти элементы составляют менее 0,01 % от сухой массы организмов. К этой группе элементов относят
- 8. При недостаточном содержании или отсутствии этих элементов могут возникнуть тяжелые нарушения обмена веществ. Это связано с
- 9. Например: Железо является составной частью гема — органической молекулы небелковой природы, которая входит в состав цитохромов
- 10. Ультрамикроэлементы В состав этой группы входят элементы, содержание которых в организме крайне мало — менее 10-6
- 11. Современная классификация МЭ По жизненной необходимости: Необходимые (эссенциальные): Fe, I, Cu, Zn, Co, Cr, Mo Se,
- 12. P.I. Agget (1985 год) условно разделяет МЭ на три группы: Катионные элементы (Zn, Fe, Mn, Cu),
- 13. Среднее содержание минеральных элементов в организме млекопитающих, в % к массе тела Макроэлементы: 1 – 9%
- 14. НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА Хотя основу живых организмов составляют органические соединения, в ней также встречаются соединения, которые присутствуют
- 15. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ Вода — полярная молекула: так как кислород более электроотрицателен, чем водород, и стягивает
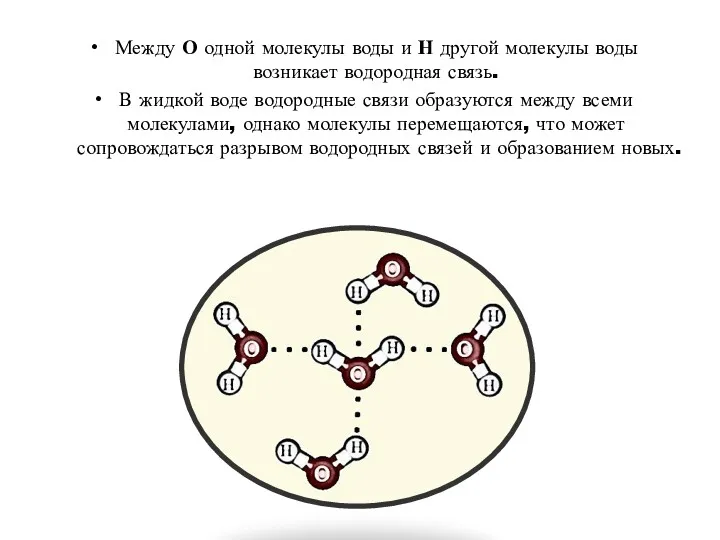
- 16. Между О одной молекулы воды и Н другой молекулы воды возникает водородная связь. В жидкой воде
- 17. Когда вода кипит, все водородные связи между молекулами воды должны быть разорваны, чтобы молекулы по отдельности
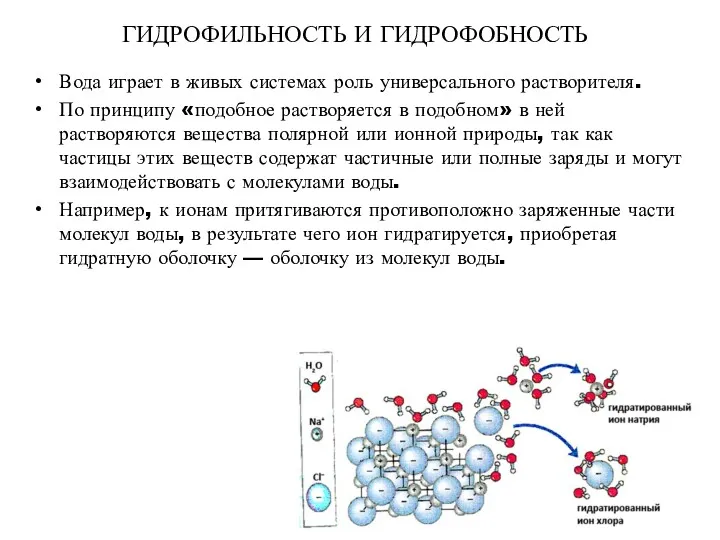
- 18. ГИДРОФИЛЬНОСТЬ И ГИДРОФОБНОСТЬ Вода играет в живых системах роль универсального растворителя. По принципу «подобное растворяется в
- 19. Полярные молекулы, такие как этиловый спирт, тоже образуют водородные связи и гидратируются. Если полярные или ионные
- 20. Вещества, молекулы которых неполярны, плохо растворяются в воде и не смачиваются ею. Их молекулы не способны
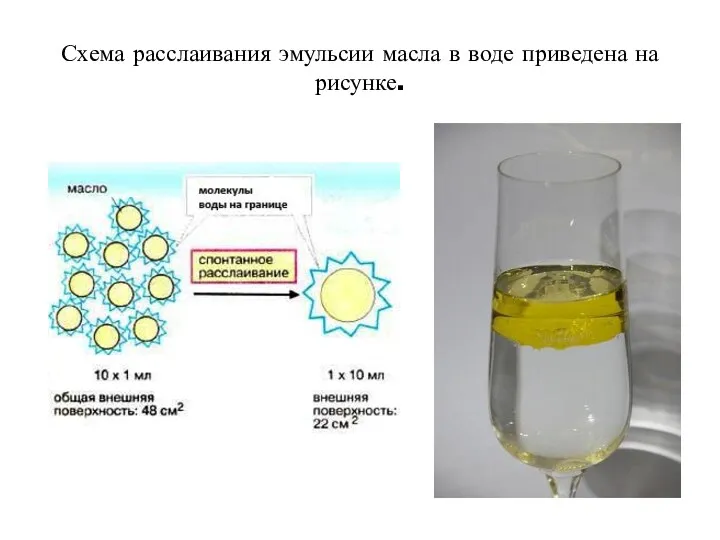
- 21. Схема расслаивания эмульсии масла в воде приведена на рисунке.
- 22. ИОНЫ Неорганические вещества в живых клетках помимо воды представлены в основном в виде растворенных солей. Их
- 23. КИСЛОТНОСТЬ И БУФЕРЫ Кислотность — это концентрация ионов водорода (Н). Чем больше ионов водорода, тем больше
- 24. Показателем кислотности является рН. рН чистой воды равен 7, кислых сред — меньше 7, щелочных —
- 25. рН различных жидкостей в теле человека показан на рисунке.
- 26. Буфер — это раствор, способный поддерживать постоянство рН-среды. При выделении в процессах обмена веществ избытка кислоты
- 27. Другие неорганические вещества образуют комплексы с белками, например входят в состав ферментов, играя важную роль в
- 29. Скачать презентацию





















 Химическая связь. Лекция 2-3
Химическая связь. Лекция 2-3 Аллотропные модификации кремния
Аллотропные модификации кремния Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Благородные металлы
Благородные металлы Металл серебро
Металл серебро Продолжение лекции Химическая связь
Продолжение лекции Химическая связь ЕГЭ по химии. Решение задач 27, 28, 29
ЕГЭ по химии. Решение задач 27, 28, 29 Хроматографические методы анализа
Хроматографические методы анализа Основные понятия и законы химии
Основные понятия и законы химии Карбоновые кислоты. 10 класс
Карбоновые кислоты. 10 класс Олигомеризация олефинов
Олигомеризация олефинов Особенности дисперсных систем
Особенности дисперсных систем NaCl или поваренная соль (плюсы и минусы)
NaCl или поваренная соль (плюсы и минусы) Процессы и операции формообразования. Металлургия цветных металлов
Процессы и операции формообразования. Металлургия цветных металлов Классификация веществ
Классификация веществ The application nanotechnology in chemistry
The application nanotechnology in chemistry Class micro and macro elements
Class micro and macro elements Кислотно-основное титрование. Алкалиметрия
Кислотно-основное титрование. Алкалиметрия Металдар арасындағы беттік керіліс
Металдар арасындағы беттік керіліс Жиры и масла
Жиры и масла Неметали. Фізичні та хімічні властивості. Явище адсорбції. Сполуки неметалічних елементів з Гідрогеном
Неметали. Фізичні та хімічні властивості. Явище адсорбції. Сполуки неметалічних елементів з Гідрогеном Алкани
Алкани Методические подходы к решению химических задач. Задание 34
Методические подходы к решению химических задач. Задание 34 Азотная кислота и ее свойства
Азотная кислота и ее свойства Электролиз. Области использования электролиза
Электролиз. Области использования электролиза Количество вещества. 8 класс
Количество вещества. 8 класс Гидролиз. Классификация солей
Гидролиз. Классификация солей Органические высокомолекулярные реагенты
Органические высокомолекулярные реагенты