Содержание
- 2. Цели урока: Повторить классификацию неорганических веществ Обобщить и систематизировать знания учащихся о классах неорганических веществ Показать
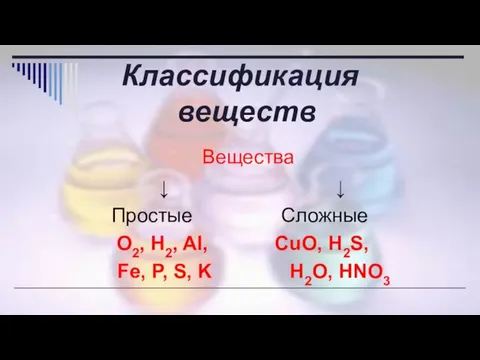
- 3. Классификация веществ Вещества ↓ ↓ Простые Сложные O2, H2, Al, CuO, H2S, Fe, P, S, K
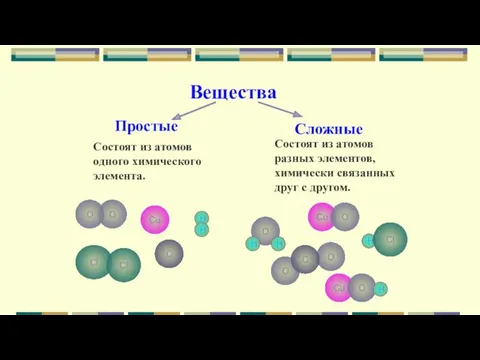
- 4. Вещества Простые Сложные Состоят из атомов одного химического элемента. Состоят из атомов разных элементов, химически связанных
- 5. Простые вещества Металлы Неметаллы Благородные газы Na Cu Fe S Cl2 O2 He Ne Rn
- 6. На классы вещества разбиты Состав их сложен. Надо знать: «Оксиды», «Соли», «Гидроксиды». Посмотрим, как их различать…
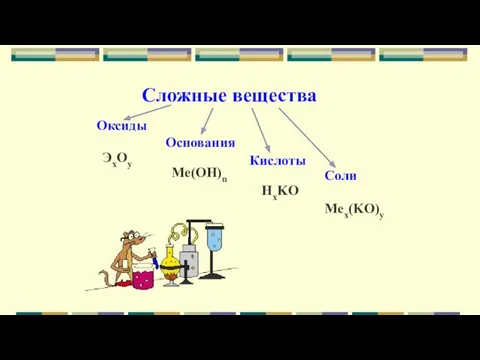
- 7. Сложные вещества Оксиды Основания Кислоты Соли ЭxOy Me(OH)n HxKO Mex(KO)y
- 8. В оксидах разберись однажды В самом составе вещества: Есть кислород в оксиде каждом, А элементов только
- 9. Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород со
- 11. Несолеобразующие оксиды – это оксиды, которые не взаимодействуют ни с основаниями, ни с кислотами и поэтому
- 12. Самый известный оксид – вода, занимающий большую часть поверхности Земли. Оксид кремния(IV), входящий в состав огромного
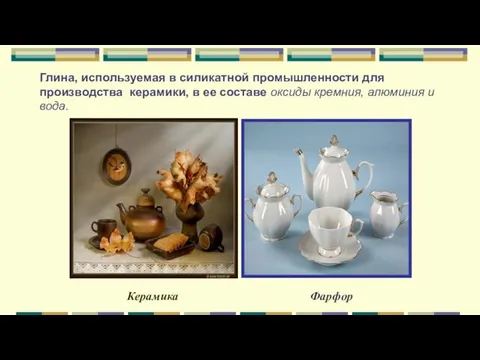
- 13. Глина, используемая в силикатной промышленности для производства керамики, в ее составе оксиды кремния, алюминия и вода.
- 14. Определим класс «оснований» Классическим обоснованием Ведем научный репортаж: «Металлы связаны с «ОН»! ---ОН Ме
- 15. Основания – это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп (-OH). Основания
- 16. Амфотерные гидроксиды Zn(OH)2 H2ZnO2 Al(OH)3 H3AlO3 HAlO2 Cr(OH)3 HCrO2 Метаалюминиевая кислота Метахромистая кислота
- 17. Соответствие оснований и оксидов Na2O – NaOH Li2O – LiOH K2O – KOH MgO – Mg(OH)2
- 18. В любой аптечке можно найти нашатырный спирт – гидроксид аммония. Гидроксид кальция – гашеную известь используют
- 19. Давайте вдумаемся вместе, Каков состав любых кислот. В их формулах на первом месте- Одновалентный водород! Cl
- 20. Кислоты – это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных
- 21. Кислоты (НхR) HCl – соляная HNO3 – азотная HNO2 – азотистая H2SO4 – серная H2SO3 –
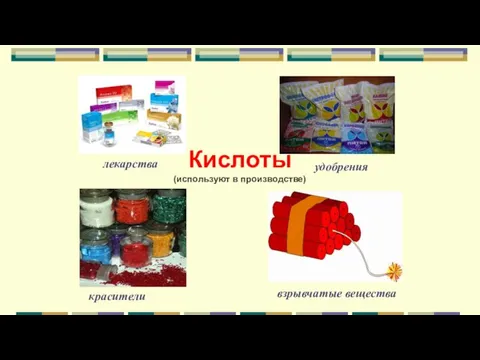
- 22. Кислоты (используют в производстве) лекарства красители удобрения взрывчатые вещества
- 23. Состав солей уже известен Пример используем любой- Металл стоит на первом месте, Остаток от кислот –
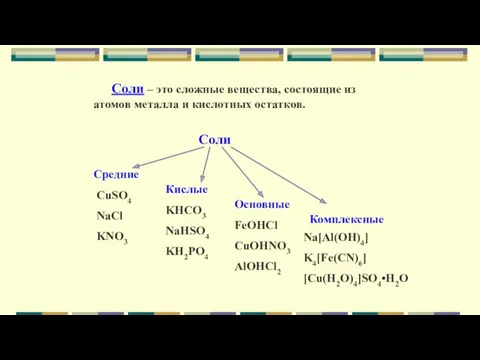
- 24. Соли – это сложные вещества, состоящие из атомов металла и кислотных остатков. Соли Средние Кислые Основные
- 25. Соли пищевая сода поваренная соль гипс мрамор марганцовка
- 26. Названия веществ Na2CO3(карбонат натрия) -кальцинированная сода Na2CO3 *10H2O(декагидрат карбоната натрия)- кристаллическая сода; NaHCO3 (гидрокарбонат натрия)- пищевая
- 27. Названия веществ Na3[AlF6] или 3NaF*AlF3 (гексафторалюминат натрия)-криолит; NaCl (хлорид натрия)- поваренная соль, каменная соль, пищевая соль;
- 28. Названия веществ CaO (оксид кальция)- негашёная известь; Ca(OН)2 (гидроксид кальция)- гашёная известь, белильная известь; Ca(OН)2- известковая
- 29. Названия веществ Ca(H2PO4)2 (дигидрофосфат кальция) – двойной суперфосфат; CaSO4 . 2Н2О (дигидрат сульфата кальция)- гипс; FeCl2
- 30. Названия веществ FeSO4.7H2O (гептагидрат сульфата железа (II))- железный купорос; ZnSO4.7H2O (гептагидрат сульфата цинка)-цинковый купорос; ZnS (сульфид
- 31. Названия веществ N2O (Оксид азота(I))- веселящий газ; NO2 (Оксид азота(IV))- NH4Cl (хлорид аммония)- нашатырь; NH4NO3(нитрат аммония)-аммиачная
- 32. Названия веществ CO(оксид углерода (II))-угарный газ; СО2 (оксид углерода (IV))- углекислый газ, угольный ангидрид; SO2 (оксид
- 33. Названия веществ HF(фтороводород) –плавиковая кислота (раствор HF в воде); Al2O3(оксид алюминия)- корунд, боксид, глинозём; SiO2 (оксид
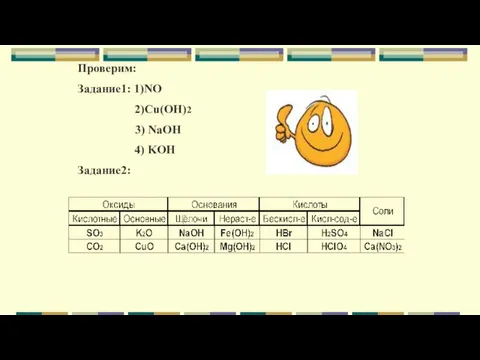
- 34. Fe(OH)2, H2SO4, NaCl, K2O, SO3, Mg(OH)2, CuO, Ca(NO3)2, NaOH, HBr, CO2, HClO4, Ca(OH)2, HCl. Задание 2.
- 35. Проверим: Задание1: 1)NO 2)Cu(OH)2 3) NaOH 4) KOH Задание2:
- 36. Тест 1) Из предложенного перечня выберите основной оксид а) Na2O б) SO3 в) P2O5 2) В
- 37. Ответы теста 1) А 2) Б 3) В 4) Б 5) В 6) А Критерии оценки
- 39. Скачать презентацию



















![Названия веществ Na3[AlF6] или 3NaF*AlF3 (гексафторалюминат натрия)-криолит; NaCl (хлорид натрия)-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/114576/slide-26.jpg)









 Состояние атмосферного воздуха в Ярославской области
Состояние атмосферного воздуха в Ярославской области Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Органіка. Органічні речовини
Органіка. Органічні речовини Спирты. Состав, строение спиртов
Спирты. Состав, строение спиртов Теплота сгорания топлива
Теплота сгорания топлива Синтетические органические вещества
Синтетические органические вещества Валентность химических элементов (8 класс)
Валентность химических элементов (8 класс) Соли (12 класс)
Соли (12 класс) Физические свойства минералов
Физические свойства минералов Иccледовательская работа по химии красное, желтое ,зеленое, какое полезнее?
Иccледовательская работа по химии красное, желтое ,зеленое, какое полезнее? Chemical kinetics
Chemical kinetics Как трудно быть особенной…
Как трудно быть особенной… Благородные металлы
Благородные металлы Метод кислотно-основного титрования. (Лекции 21-22)
Метод кислотно-основного титрования. (Лекции 21-22) Химические понятия
Химические понятия Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Изучение свойств тиосульфата натрия
Изучение свойств тиосульфата натрия Алюминий. Строение и свойство атомов
Алюминий. Строение и свойство атомов Аминокислоты
Аминокислоты Поверхностные явления. Адсорбция. Изотерма Ленгмюра
Поверхностные явления. Адсорбция. Изотерма Ленгмюра Растворы. Электролитическая диссоциация
Растворы. Электролитическая диссоциация Сағыз пайдалы ма, әлде зиян ба?
Сағыз пайдалы ма, әлде зиян ба? Неметаллы. Особенности строения атомов неметаллов
Неметаллы. Особенности строения атомов неметаллов Cұйықтықтардағы электр тоғы
Cұйықтықтардағы электр тоғы Кристаллические решетки
Кристаллические решетки Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон
Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон Минерал турмалин
Минерал турмалин Svante Arrhenius and the theory of electrolytic and non-electrolytic dissociation
Svante Arrhenius and the theory of electrolytic and non-electrolytic dissociation