Содержание
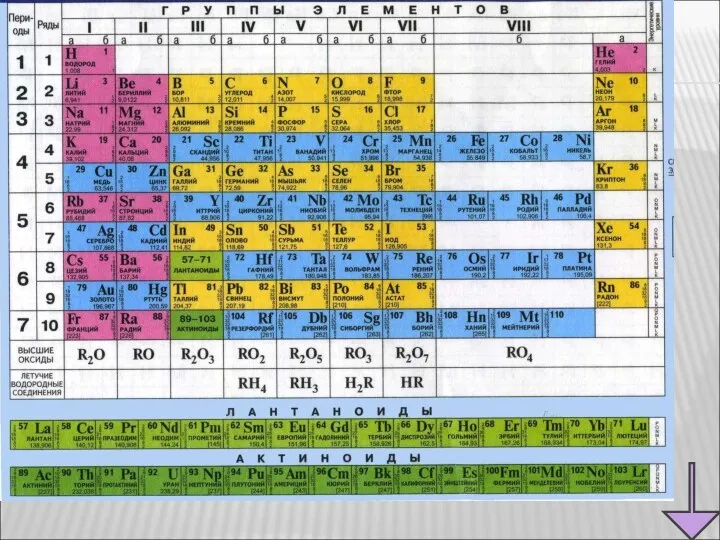
- 2. I. Исторические сведения II. Марганец – химический элемент: 11.Положение марганца в периодической системе химических элементов Д.И.Менделеева
- 3. Один из основных минералов марганца — пиролюзит — был известен в древности как чёрная магнезия и
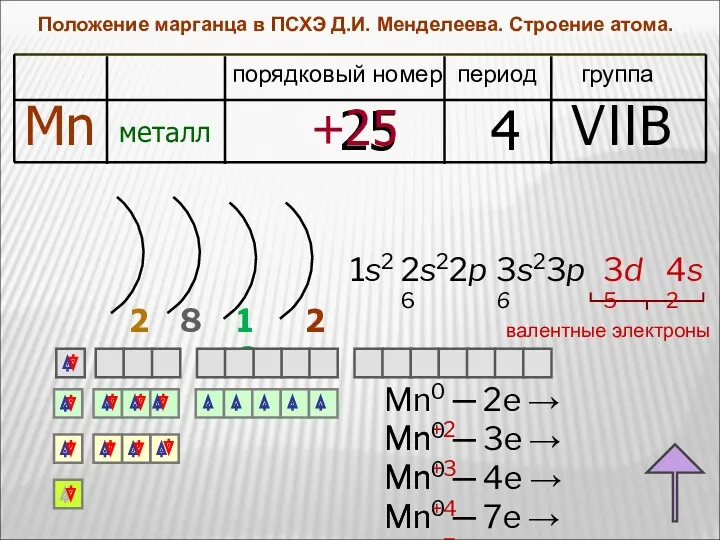
- 6. Положение марганца в ПСХЭ Д.И. Менделеева. Строение атома. период группа порядковый номер Mn металл 25 4
- 7. Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся
- 8. пиролюзит MnО2xH2O, самый распространённый минерал (содержит 63,2 % марганца); манганит (бурая манганцевая руда) MnO(OH) (62,5 %
- 9. пиролюзит манганит браунит гаусманит родохрозит псиломелан пурпурит
- 10. Марганец твёрдый, хрупкий металл светло-серого цвета tплавления = 1247°С tкипения = 2080°С плотность = 7,2 г/см3
- 11. 1. Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита: 4MnO2 → 2Mn2O3 + О2 Mn2O3+
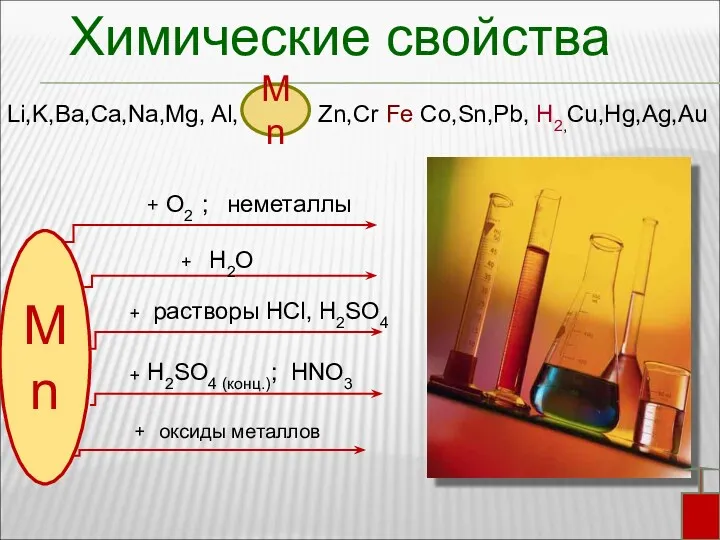
- 12. Химические свойства Li,K,Ba,Ca,Na,Mg, Al, Zn,Cr Fe Co,Sn,Pb, H2,Cu,Hg,Ag,Au Mn Mn + + + H2SO4 (конц.); HNO3
- 13. Взаимодействие марганца с неметаллами Марганец при взаимодействии с неметаллами, дает продукты со степенью окисления +2. Составьте
- 14. При нагревании марганец взаимодействует с водой Составьте уравнение реакции марганца с водой. Рассмотрите данную реакцию как
- 15. Li,K,Ba,Ca,Na,Mg, Al, Zn,Cr Fe Co,Sn,Pb, H2,Cu,Hg,Ag,Au Mn В электрохимическом ряду напряжений металлов марганец находится между алюминием
- 16. С концентрированной серной кислотой марганец реагирует при нагревании: С концентрированной азотной кислотой марганец реагирует при обычных
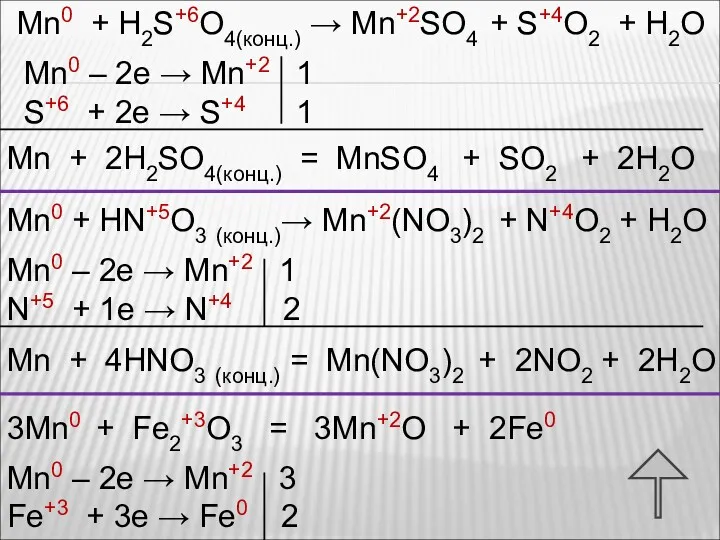
- 17. Mn0 + H2S+6O4(конц.) → Mn+2SO4 + S+4O2 + H2O Mn0 – 2e → Mn+2 1 S+6
- 18. Взаимодействие марганца с оксидами металлов Марганец восстанавливает металлы из их оксидов: 5Mn + Nb2O5 = 5MnO
- 19. Mарганец — микроэлемент, постоянно присутствующий в живых организмах и необходимый для их нормальной жизнедеятельности. Некоторые растения
- 20. Применение марганца 1 черная металлургия легирование сталей производство ферритных материалов Покрытия из марганца на металлических поверхностях
- 21. 1 Более 90% производимого марганца идет в черную металлургию. Марганец используют как добавку к сталям для
- 22. Марганец используют для легирования сталей, т. е. улучшения их механических и коррозионных свойств. 2
- 23. Марганец применяется также в медных, алюминиевых и магниевых сплавах. Ферромарганец является сплавом железа и марганца 3
- 24. Покрытия из марганца на металлических поверхностях обеспечивают их антикоррозионную защиту. Для нанесения тонких покрытий из марганца
- 25. Соединения марганца (карбонат, оксиды и другие) используют при производстве ферритных материалов, они служат катализаторами многих химических
- 26. Соединения марганца Соединения марганца (II) Соединения марганца (IV) Соединения марганца (VII) оксид гидроксид соли оксид соли
- 27. Соединения марганца (II) MnO Оксид марганца (II) – кристаллы зеленовато- серого цвета. В воде не растворим.
- 28. Химические свойства Оксид марганца – основный оксид Перечислите свойства характерные для основных оксидов Составьте уравнения реакций
- 29. Mn(OH)2 Гидроксид марганца (II) Гидроксид марганца(II) — студнеобразный светло-розовый осадок. Нерастворим в воде. Получение. Гидроксид марганца
- 30. Химические свойства Гидроксид марганца (II) обладает основными свойствами. Перечислите свойства характерные для оснований Составьте уравнения реакций
- 31. Гидроксид марганца (II) легко окисляется на воздухе до бурого оксогидроксида марганца, который далее разлагается на оксид
- 32. Гидроксид марганца (II) обладает восстановительными свойствами. В присутствии сильных окислителей он может окисляться до перманганата: Mn(OH)2
- 33. Сульфат марганца (II) — белый, при прокаливании плавится и разлагается. Кристаллогидрат MnSO4 · 5H2O — красно-розовый,
- 34. Реагирует со щелочами, гидратом аммиака. MnSO4 + 2(NH3·H2O) = Mn(OH)2↓ + (NH4)2SO4 Слабый восстановитель, реагирует с
- 35. Mn+2SO4 +H2O + KMn+7O4 →Mn+4O2 + Na2SO4 + H2SO4 Mn+2 – 2e → Mn+4 3 Mn+7
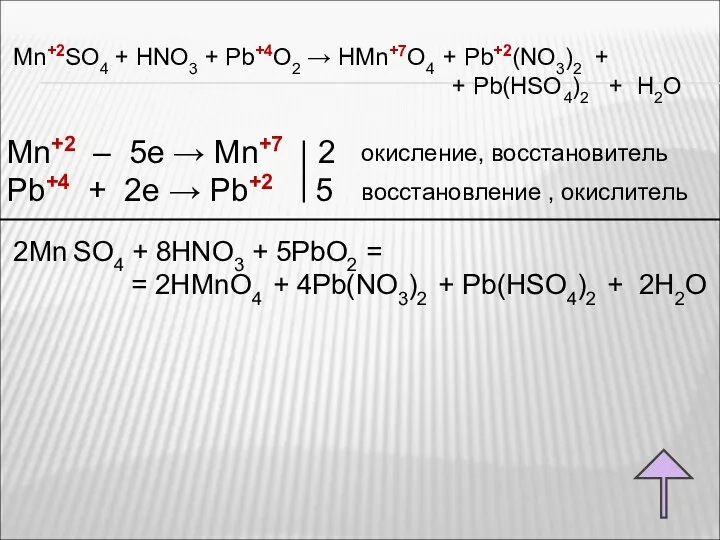
- 36. Mn+2SO4 + HNO3 + Pb+4O2 → HMn+7O4 + Pb+2(NO3)2 + + Pb(HSO4)2 + H2O Mn+2 –
- 37. Оксид марганца(IV) (диоксид марганца) MnO2 — порошок тёмно-коричневого цвета, нерастворимый в воде. Наиболее устойчивое соединение марганца,
- 38. В лабораторных условиях получают термическим разложением перманганата калия 2KMnO4 → MnO2 + K2MnO4 + O2↑ Также
- 39. Химические свойства диоксида марганца Диоксид марганца проявляет амфотерные свойства и поэтому сплавляется с щелочами, образуя манганиты,
- 40. При нагревании с кислотами проявляет окислительные свойства, например, окисляет концентрированную соляную кислоту до хлора: 4HCl +
- 42. Существенно ускорять химические реакции могут некоторые вещества ‑ катализаторы. Пероксид водорода медленно разлагается на кислород и
- 43. Наиболее характерными соединениями Mn(VI) являются манганаты – соли марганцоватой кислоты Н2MnО4. Кислота и ее соли неустойчивы.
- 44. Манганат калия — соль темно-зеленого цвета. Плавится под избыточным давлением кислорода. В растворе устойчив только в
- 45. Химические свойства манганата калия Поскольку атом марганца (VI) в манганатах находится в промежуточной степени окисления, то
- 46. K2Mn+6O4 + KI–1 + H2O → Mn+4O2 + I20 + KOH Mn+6 + 2e → Mn+4
- 47. K2Mn+6O4 + HСl → KMn+7O4 + Mn+4O2 + KCl + H2O Mn+6 – 1e → Mn+7
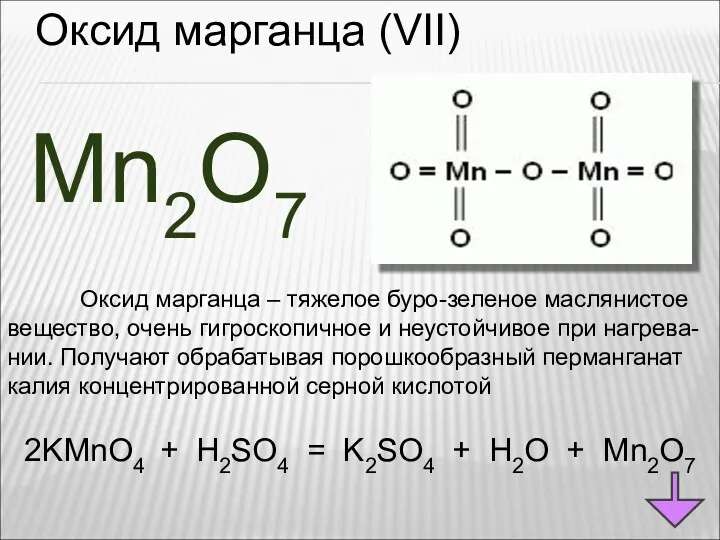
- 48. Оксид марганца (VII) Mn2O7 Оксид марганца – тяжелое буро-зеленое маслянистое вещество, очень гигроскопичное и неустойчивое при
- 49. 2Mn2O7 = 4MnO2 + 3O2 + Q Оксид марганца () настолько неустойчив, что взрывается при простом
- 50. При попадании кристаллов перманганата калия в серную кислоту образуется марганцевый ангидрид (оксид марганца (VII) - очень
- 51. Марганцовая кислота HMnO4 Марганцо́вая кислота́ — сильная кислота. В чистом виде не выделена, существует в виде
- 52. Химические свойства HMnO4 Марганцовая кислота в растворе медленно разлагается, при этом выделяется кислород и выпадает осадок
- 53. Марганцовая кислота, как и её соли (перманганаты), является очень сильным окислителем HMnO4 + HCl → MnCl2
- 54. Соли. KMnO4 Пермангана́т ка́лия (лат. Kalii permanganas) — марганцовокислый калий, калиевая соль марганцевой кислоты. Представляет собой
- 55. В жидкостях, как и в газах, частицы вещества (молекулы и ионы) находятся в постоянном движении. Это
- 56. Получение KMnO4 Химическое или электрохимическое окисление соединений марганца, диспропорционирование манганата калия 2MnO2 + 3Cl2 + 8KOH
- 57. Является сильным окислителем. В зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной
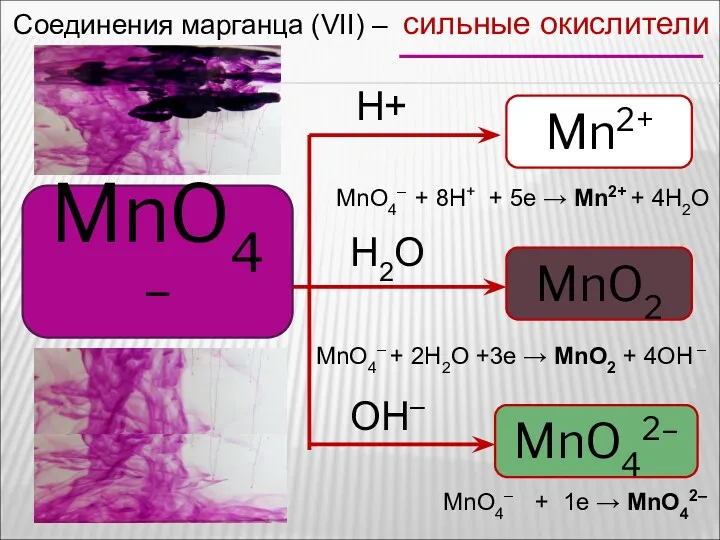
- 58. Соединения марганца (VII) – сильные окислители MnO4– Mn2+ MnO2 MnO42– H+ H2O OH– MnO4– + 8H+
- 59. В кислой среде перманганат восстанавливается до солей Mn2+ KMnO4 + H2S + H2SO4 → MnSO4 +
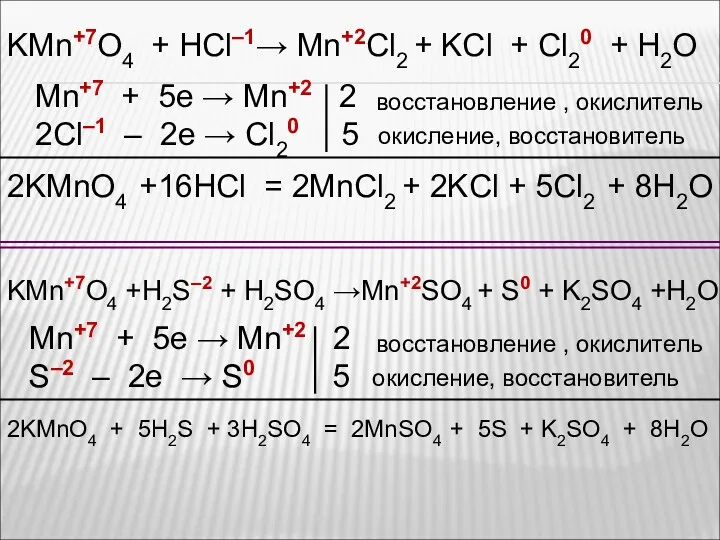
- 61. KMn+7O4 + HCl–1→ Mn+2Cl2 + KCl + Cl20 + H2O Mn+7 + 5e → Mn+2 2
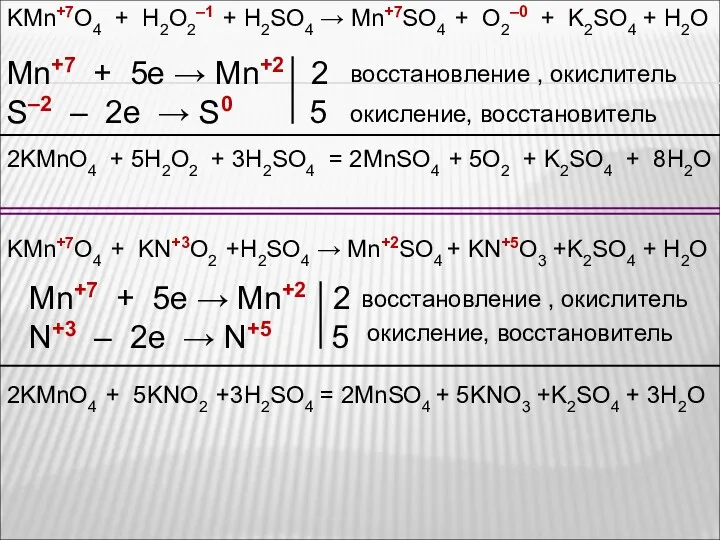
- 62. KMn+7O4 + H2O2–1 + H2SO4 → Mn+7SO4 + O2–0 + K2SO4 + H2O Mn+7 + 5e
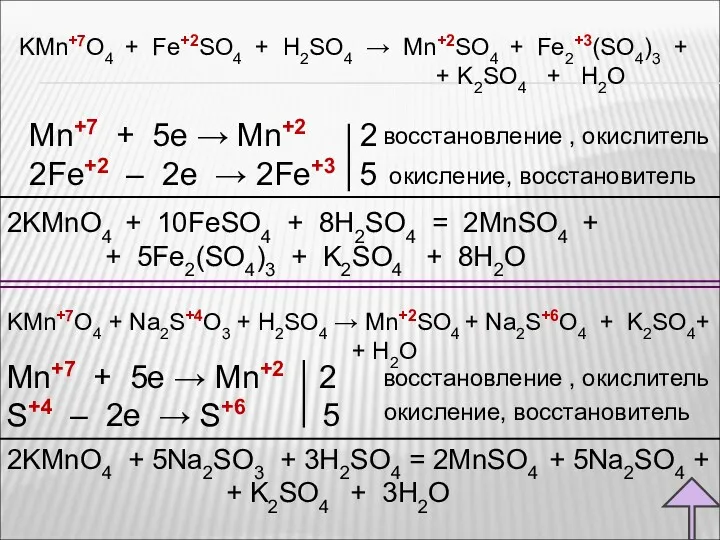
- 63. 2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + + 5Fe2(SO4)3 + K2SO4 + 8H2O Mn+7 +
- 64. В нейтральной среде восстановление идет до MnO2 KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4
- 65. KMn+7O4 + Na2S+4O3 + H2O → Mn +4O2 + Na2S+6O4 + KOH Mn+7 + 3e →
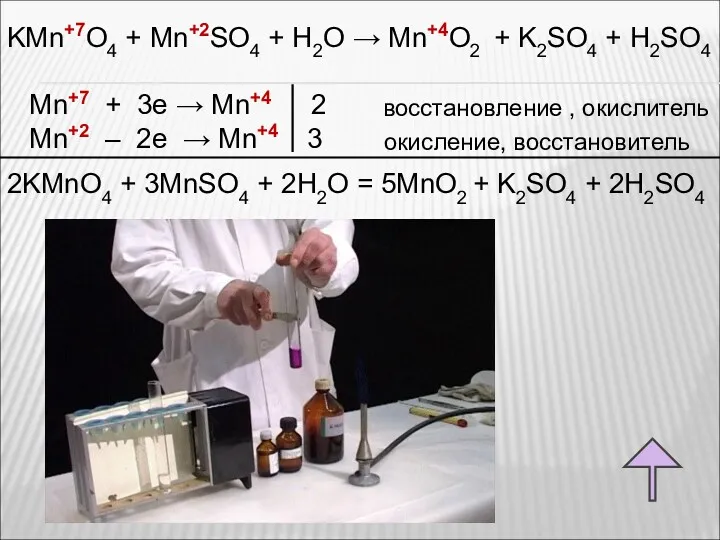
- 66. KMn+7O4 + Mn+2SO4 + H2O → Mn+4O2 + K2SO4 + H2SO4 Mn+7 + 3e → Mn+4
- 67. В щелочной среде образуются соли маргонцоватой кислоты KMn+7O4+Na2S+4O3 +KOH →K2Mn+6O4 +Na2S+6O4 + H2O Mn+7 + 1e
- 68. KMn+7O4–2 + KOH → K2Mn+7O4 + O20 + H2O Mn+7 + 1e → Mn+6 4 2O–2
- 69. К растертому в тонкий порошок перманганату калия добавляют глицерин. Через некоторое время над смесью появляется дымок,
- 70. Спирты легко окисляются раствором перманганата калия. В пробирку с этиловым спиртом прильем немного подкисленного раствора перманганата
- 71. При пропускании ацетилена через подкисленный раствор перманганата калия наблюдается быстрое обесцвечивание раствора. Происходит окисление ацетилена по
- 72. При пропускании этилена через раствор перманганата калия. Раствор быстро обесцвечивается. При этом этилен окисляется в двухатомный
- 73. При нагревании перманганат калия разлагается 2KMnO4 K2MnO4 + MnO2 + O2 t° опыт
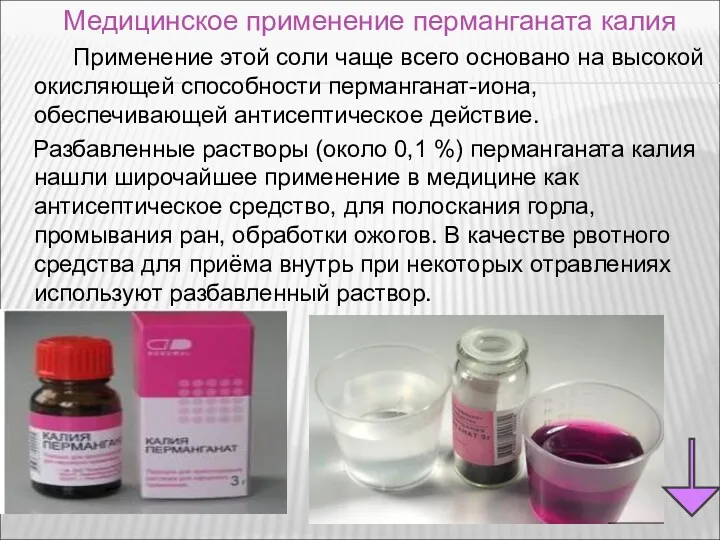
- 75. Применение этой соли чаще всего основано на высокой окисляющей способности перманганат-иона, обеспечивающей антисептическое действие. Разбавленные растворы
- 76. Фармакологическое действие Антисептическое средство. При соприкосновении с органическими веществами выделяет атомарный кислород. Образующийся при восстановлении препарата
- 77. Другие сферы применения перманганата калия 1) Применяется для определения перманганатной окисляемости при оценке качества воды 2)
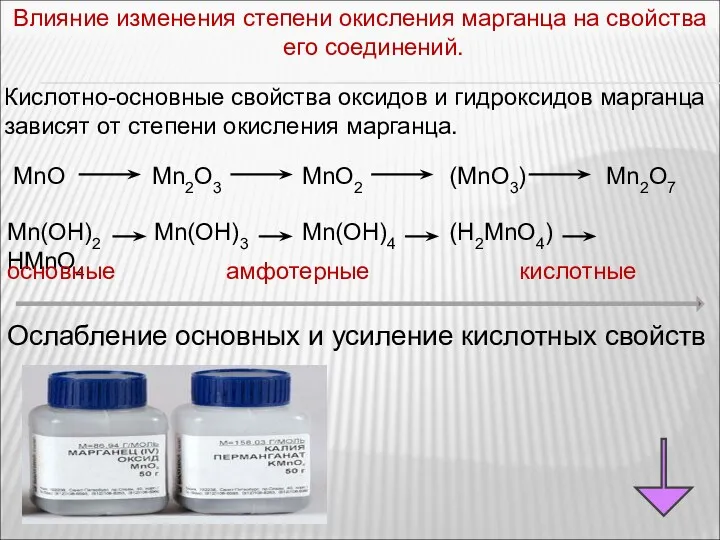
- 78. Влияние изменения степени окисления марганца на свойства его соединений. Кислотно-основные свойства оксидов и гидроксидов марганца зависят
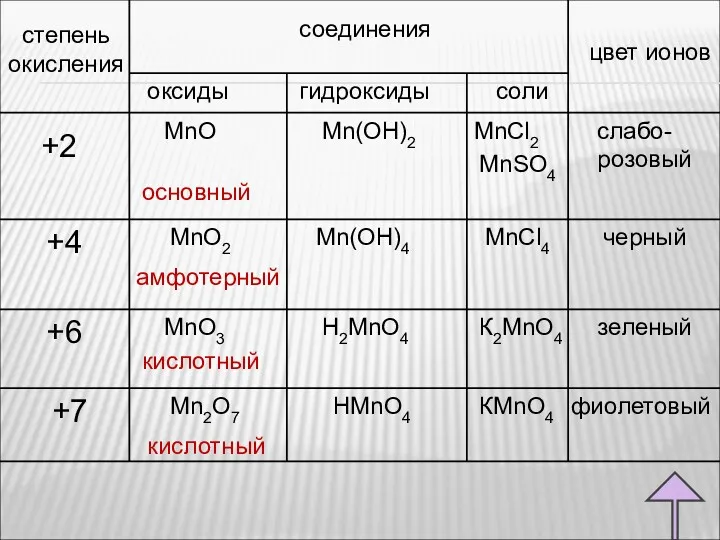
- 79. степень окисления соединения цвет ионов оксиды гидроксиды соли +6 +4 +2 +7 Mn2O7 MnO2 Mn(OH)2 MnO
- 81. Скачать презентацию































































 Пластмаси та полімери
Пластмаси та полімери Властивості вуглеводів. Лабораторна робота 3
Властивості вуглеводів. Лабораторна робота 3 Химическая термодинамика. Экзаменационные вопросы
Химическая термодинамика. Экзаменационные вопросы Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений IVA группа С, Si, Ge, Sn, Pb (подгруппа титана)
IVA группа С, Si, Ge, Sn, Pb (подгруппа титана) Продукция UNIL
Продукция UNIL Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів
Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів Изотопная геохимия. U-Pb метод
Изотопная геохимия. U-Pb метод Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Альбитит-грейзеновые месторождения
Альбитит-грейзеновые месторождения Кислород. Общая характеристика и нахождение в природе. 8 класс
Кислород. Общая характеристика и нахождение в природе. 8 класс 20231228_himicheskiy_sostav_kletki_wecompress.com_
20231228_himicheskiy_sostav_kletki_wecompress.com_ Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар
Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар Спирты. Состав, строение спиртов
Спирты. Состав, строение спиртов Поширення солей у природі
Поширення солей у природі Цветные металлы и сплавы
Цветные металлы и сплавы Нефть и способы ее переработки. (10 класс)
Нефть и способы ее переработки. (10 класс) Хозяйственный механизм НГХК
Хозяйственный механизм НГХК Подкласс Иносиликаты (цепочечные/ленточные силикаты)
Подкласс Иносиликаты (цепочечные/ленточные силикаты) Обмен нуклеопротеинов
Обмен нуклеопротеинов Фосфор и его соединения
Фосфор и его соединения Кислоты
Кислоты Алкадиены. Непредельные углеводороды
Алкадиены. Непредельные углеводороды Водородная и донорно-акцепторная связи. (Лекция 15)
Водородная и донорно-акцепторная связи. (Лекция 15) Соединения железа
Соединения железа Химия элементов. Комплексные соединения: типы и классификация. Методы получения и разрушения
Химия элементов. Комплексные соединения: типы и классификация. Методы получения и разрушения Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки
Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки Гидролиз солей
Гидролиз солей