Содержание
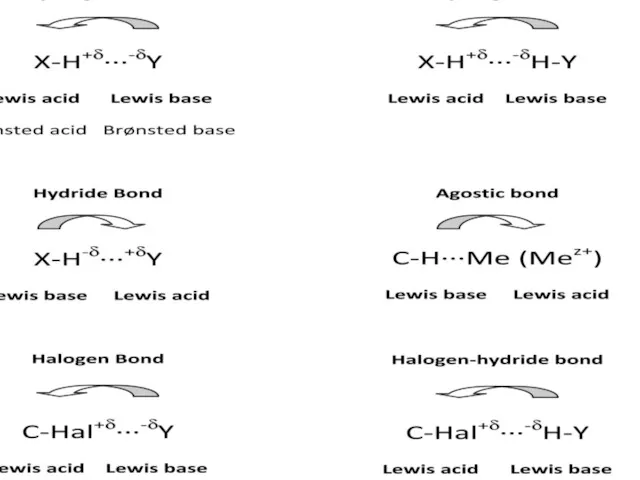
- 2. Водородная связь Водородная связь играет важную роль во многих химических, физических и биохимических процессах Молекулы жизни
- 3. Первую научную трактовку водородной связи дали в 1920 году В. Латимер и В. Родебуш, работавшие в
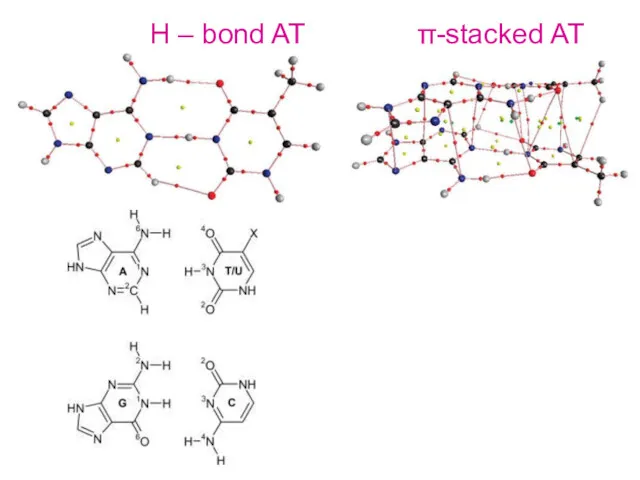
- 6. Н – bond AT π-stacked AT
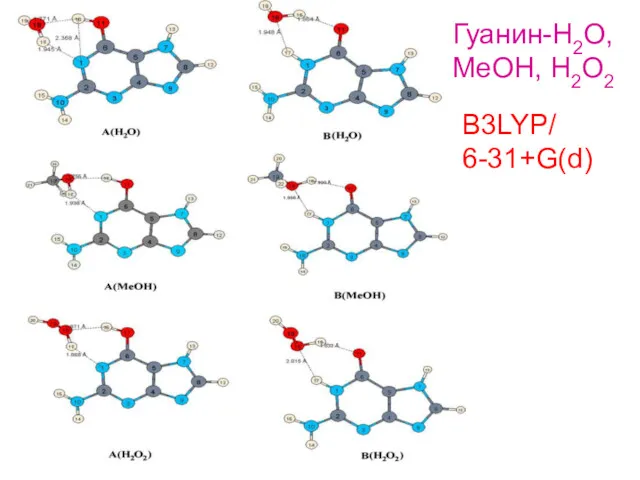
- 7. B3LYP/ 6-31+G(d) Гуанин-H2O, MeOH, H2O2
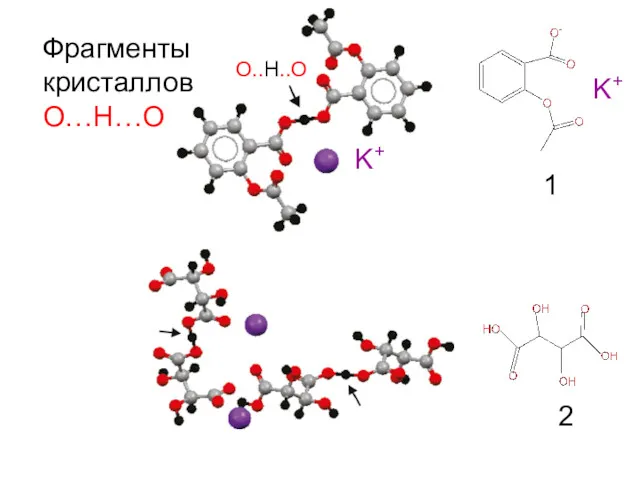
- 8. Фрагменты кристаллов О…Н…О K+ O..H..O 1 2 K+
- 9. Внутримолекулярную водородную связь отличают от межмолекулярной связи по признакам ассоциации. Межмолекулярная Н-связь «исчезает» при низкой концентрации
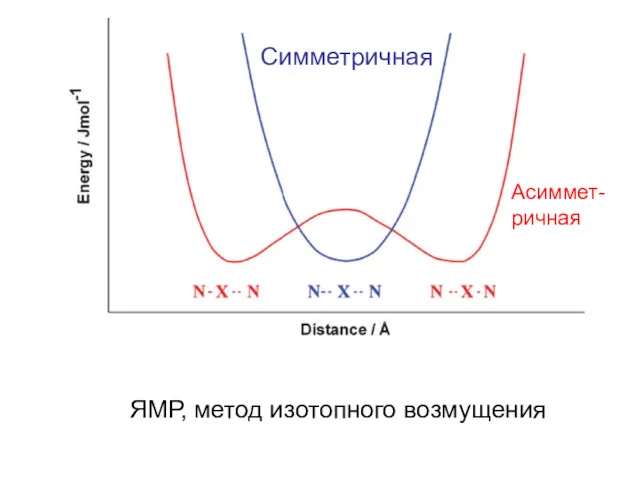
- 10. Cимметричная Асиммет- ричная ЯМР, метод изотопного возмущения
- 11. CCSD(T)/6-311(3df,3pd)// CCSD/6-311(3df,3pd) Симметричные Н-связи [H….F….H]- H….O….H Нейтронная дифракция (кристалл) Атом водорода посредине или близко к центру
- 12. Природа водородной связи Morokuma and Kitaura (одноэлектронное приближение Hartree-Fock) E = EEX + ЕPOL + ЕCT
- 13. Две молекулы описывают гамильтонианами НА и НВ а межмолекулярное взаимодействие слабое; V − оператор межмолекулярного взаимодействия
- 14. Энергия прямого электростатического взаимодействия невозмущенных молекул: Еo = (4) Энергия взаимной поляризации молекул: Еpol = -
- 15. Дисперсионная энергия Еdisp отвечает взаимодействию двух взаимно поляризованных электронных распределений. Она определяется квантово-механическими флуктуациями электронной плотности
- 16. Понятие «перенос заряда» следует понимать в том же смысле, что и понятие «валентная структура», в методе
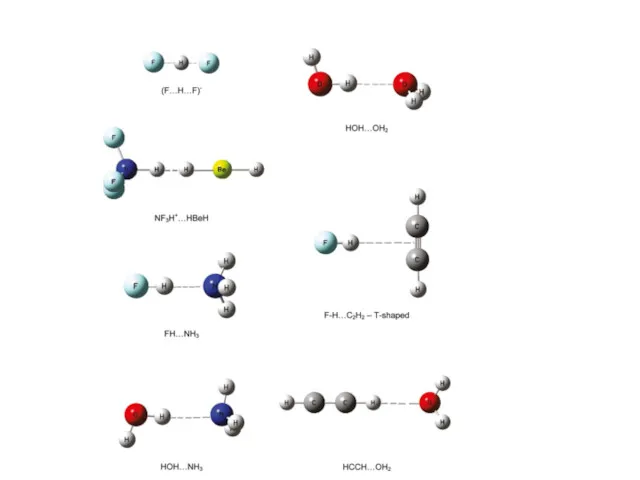
- 17. Комплекс ΔE (ккал/моль) RH…B(Å) MP2/6-311++G(d,p) HOH…OH2 -4.5 1.95 HOH…NH3 -5.9 1.97 FH…OH2 -7.7 1.73 [F…H…F]- -61.0
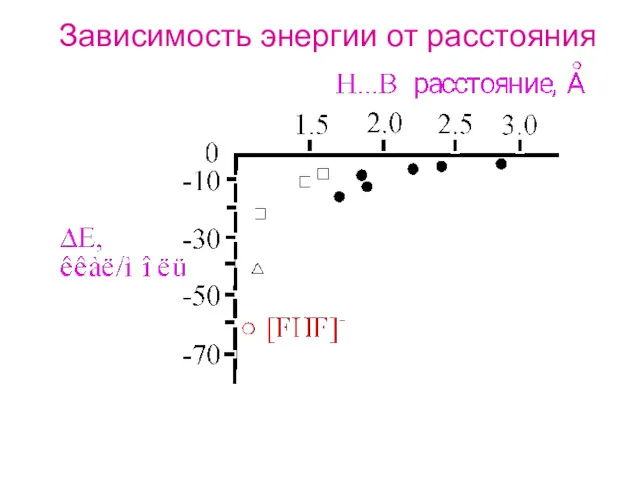
- 18. Зависимость энергии от расстояния
- 19. rn - rS = Δrns - c log n rn – rS - расстояние между атомами
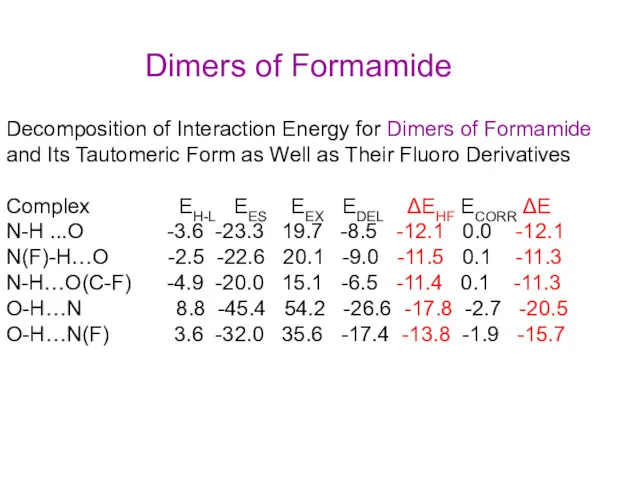
- 20. Decomposition of Interaction Energy for Dimers of Formamide and Its Tautomeric Form as Well as Their
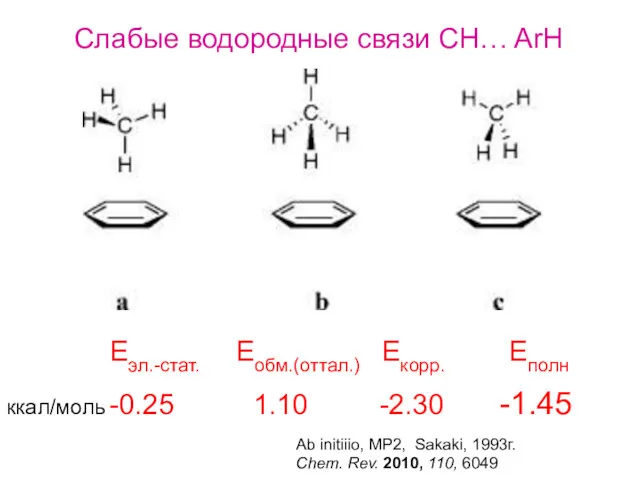
- 21. Слабые водородные связи CH… ArH -0.25 1.10 -2.30 -1.45 Eэл.-стат. Eобм.(оттал.) Екорр. Еполн Ab initiiio, MP2,
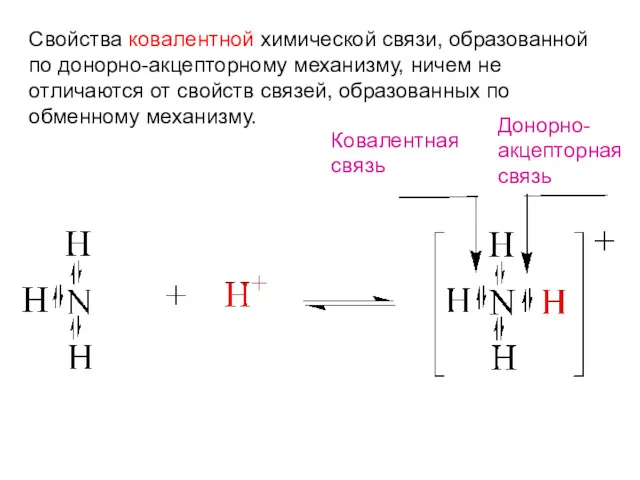
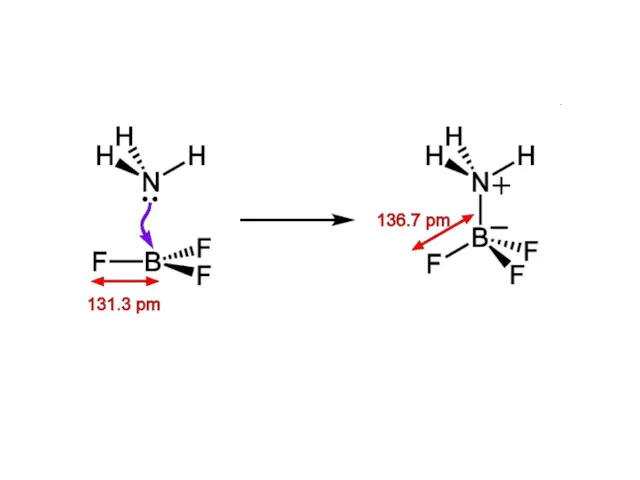
- 22. Донорно-акцепторная связь Донорно-акцепторная связь (координационная связь) — химическая связь между двумя атомами или группой атомов, осуществляемая
- 23. Свойства ковалентной химической связи, образованной по донорно-акцепторному механизму, ничем не отличаются от свойств связей, образованных по
- 25. Согласно теории Малликена, основное (N) и возбужденное (Е) состояния молекулярных кoмплексов состава DА описываются волновыми ф-циями
- 26. Для ряда молекулярных комплексов характерно появление в электронных спектрах новой полосы поглощения, отсутствовавшей в спектрах индивидуальных
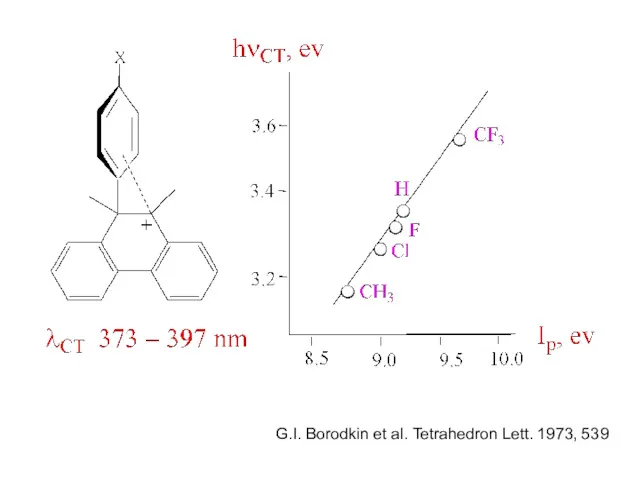
- 27. G.I. Borodkin et al. Tetrahedron Lett. 1973, 539
- 28. n-Доноры: RNH2, ROH, R2O, RSH, R2S и др. π-Доноры: ArH σ-Доноры: H-CHal3 (пара электронов от σ-связи)
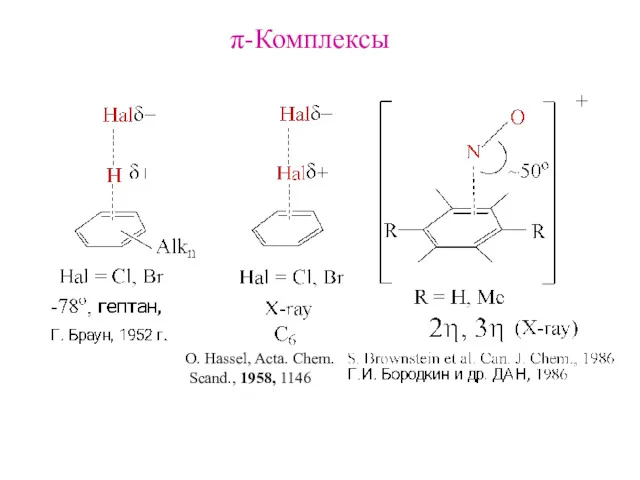
- 29. π-Комплексы O. Hassel, Acta. Chem. Scand., 1958, 1146
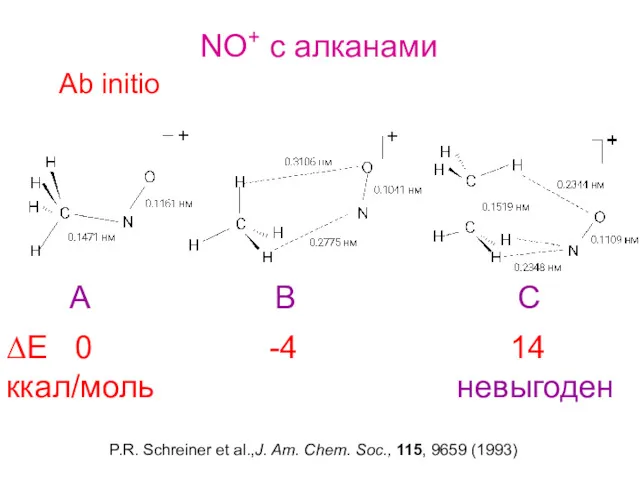
- 30. NO+ c алканами Ab initio ΔE 0 -4 14 ккал/моль невыгоден P.R. Schreiner et al.,J. Am.
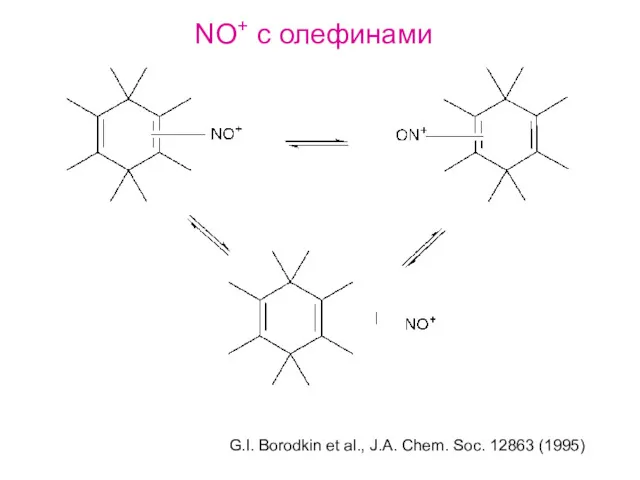
- 31. NO+ с олефинами G.I. Borodkin et al., J.A. Chem. Soc. 12863 (1995)
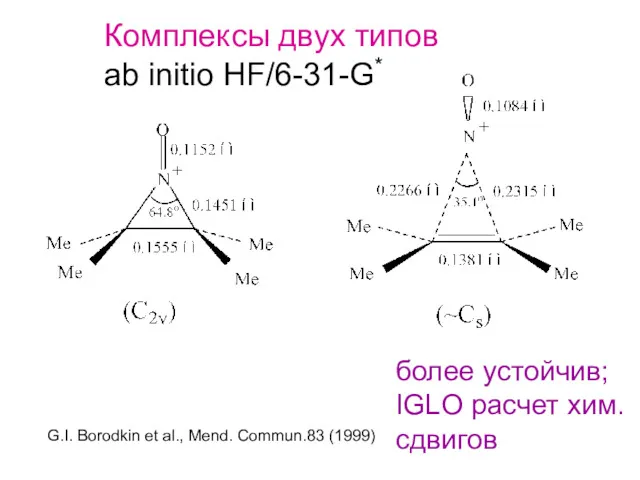
- 32. Комплексы двух типов ab initio HF/6-31-G* более устойчив; IGLO расчет хим. сдвигов G.I. Borodkin et al.,
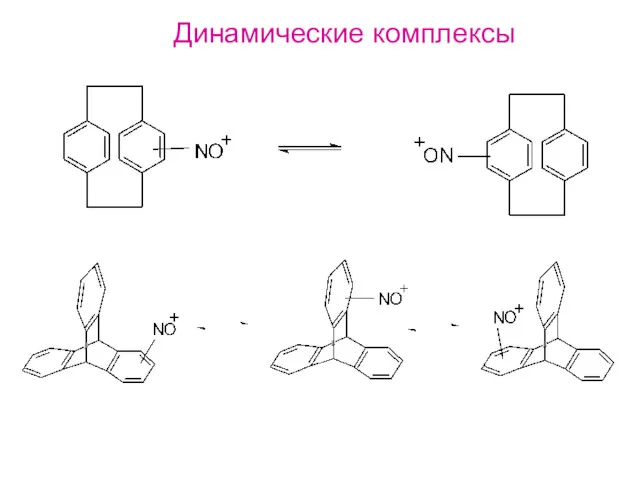
- 33. Динамические комплексы
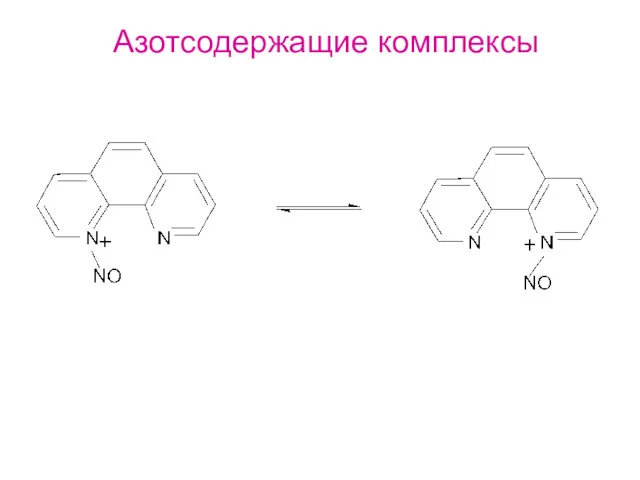
- 34. Азотсодержащие комплексы
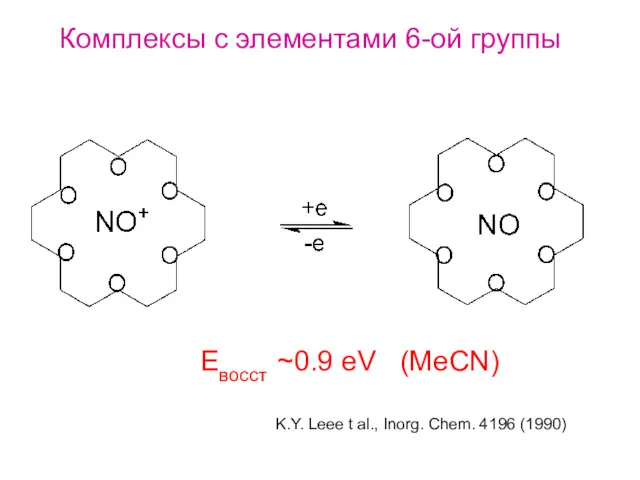
- 35. Комплексы с элементами 6-ой группы K.Y. Leee t al., Inorg. Chem. 4196 (1990) Eвосст ~0.9 eV
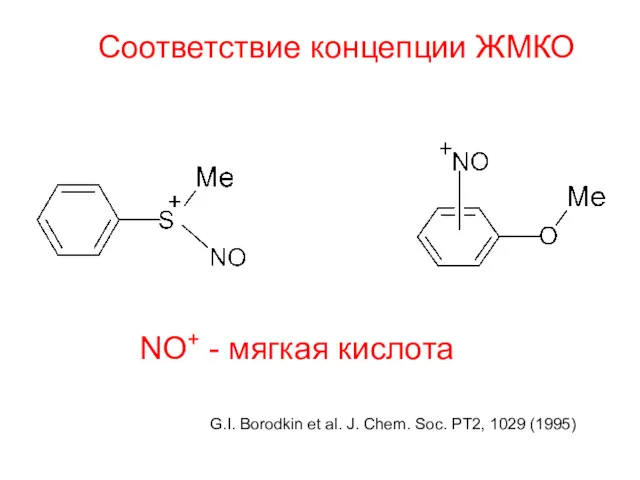
- 36. Соответствие концепции ЖМКО NO+ - мягкая кислота G.I. Borodkin et al. J. Chem. Soc. PT2, 1029
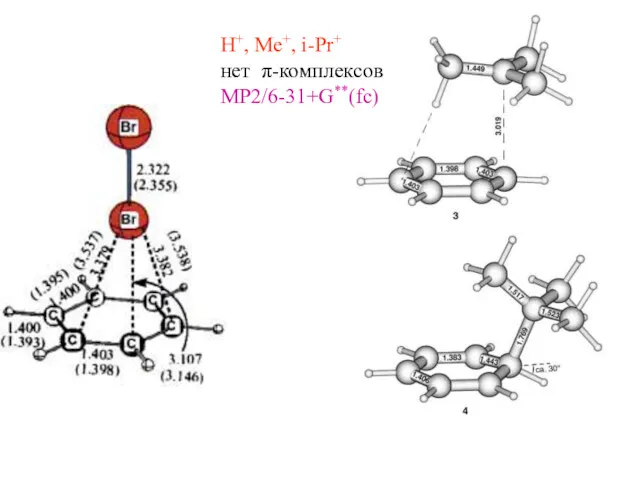
- 37. H+, Me+, i-Pr+ нет π-комплексов MP2/6-31+G**(fc)
- 38. Eэл-стат - энергия электростатического взаимодействия Еполяр - поляризационная энергия, Еобм - энергия обменного взаимод., Епз -
- 40. Скачать презентацию



![CCSD(T)/6-311(3df,3pd)// CCSD/6-311(3df,3pd) Симметричные Н-связи [H….F….H]- H….O….H Нейтронная дифракция (кристалл) Атом](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/136390/slide-10.jpg)












 Химия и пища
Химия и пища Основы органической химии. Углеводороды. Алкины
Основы органической химии. Углеводороды. Алкины Фолий қышқылы (B9 дәрумені)
Фолий қышқылы (B9 дәрумені) Драгоценные камни
Драгоценные камни Разбор сложных заданий ЕГЭ по химии
Разбор сложных заданий ЕГЭ по химии Установка производства олефинов для синтеза линейных алкилбензолов
Установка производства олефинов для синтеза линейных алкилбензолов Кремний в природе. Использование кремнезема для производства стекла. 9 класс
Кремний в природе. Использование кремнезема для производства стекла. 9 класс Серная кислота и её свойства
Серная кислота и её свойства Тайна великого открытия периодической таблицы
Тайна великого открытия периодической таблицы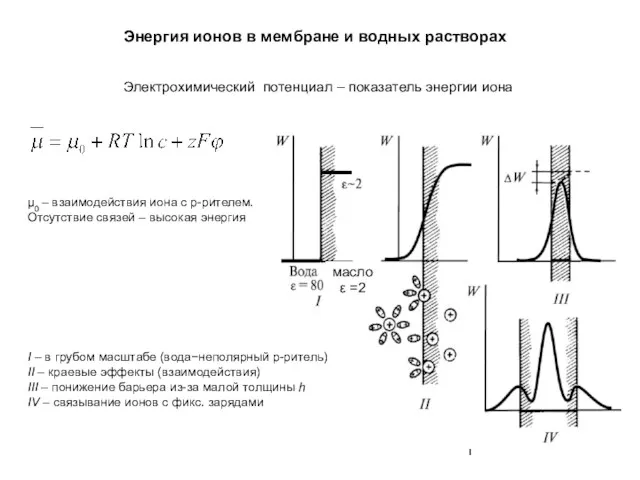 Энергия ионов в мембране и водных растворах
Энергия ионов в мембране и водных растворах 20190430_otkrytyy_urok_kislotypptx
20190430_otkrytyy_urok_kislotypptx Строение атома
Строение атома Химические свойства белков
Химические свойства белков Кислоты в свете теории электролитической диссоциации (ТЭД)
Кислоты в свете теории электролитической диссоциации (ТЭД) Индикаторы окислительно-восстановительного титрования. Их применение в анализе
Индикаторы окислительно-восстановительного титрования. Их применение в анализе Азотовмисні та елементоорганічні сполуки
Азотовмисні та елементоорганічні сполуки Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Типы химических соединений, номенклатура, свойства
Типы химических соединений, номенклатура, свойства Бейорганикалық заттар технологиясындағы жүйелерді термодинамикалық талдау
Бейорганикалық заттар технологиясындағы жүйелерді термодинамикалық талдау Свойства топлив. Марки бензинов и их характеристики
Свойства топлив. Марки бензинов и их характеристики Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Закон сохранения массы вещества
Закон сохранения массы вещества Хімічні явища, їх ознаки
Хімічні явища, їх ознаки Мына қосылыстардағы элементтердің тотығу дәрежелерін анықтаңдар
Мына қосылыстардағы элементтердің тотығу дәрежелерін анықтаңдар Оксиды. Физические и химические свойства
Оксиды. Физические и химические свойства Электролиз Урок для 11 класса
Электролиз Урок для 11 класса Алкины. Номенклатура и изомерия
Алкины. Номенклатура и изомерия Положение металлов в периодической системе химических элементов. Особенности строения их атомов
Положение металлов в периодической системе химических элементов. Особенности строения их атомов