Содержание
- 2. Алкины Алкины (ацетиленовые углеводороды) – непредельные алифатические углеводороды, молекулы которых содержат одну тройную связь. Общая формула
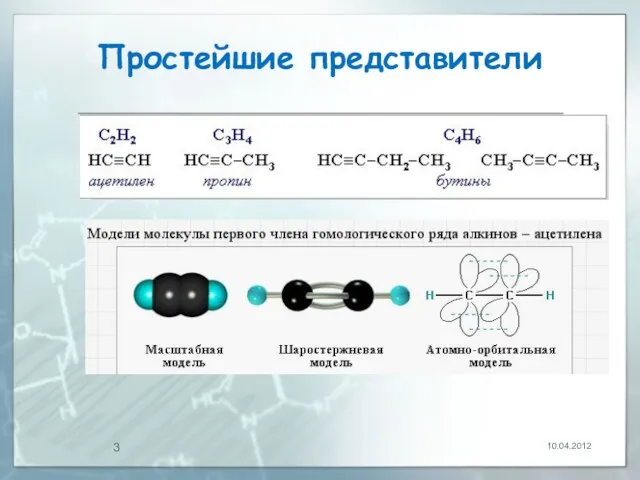
- 3. Простейшие представители 10.04.2012
- 4. Алкины Тройную связь осуществляют шесть общих электронов: В образовании тройной связи участвуют атомы углерода в sp-гибридизованном
- 5. Строение С=С связи Каждый из атомовимеет по три 2sp2-гибридных орбитали, направленных друг к другу под углом
- 6. Получение алкинов Получение и свойства ацетилена. Уравнения реакций: (видеоролик exp5.exe в папке лабораторные опыты) Опишите роль
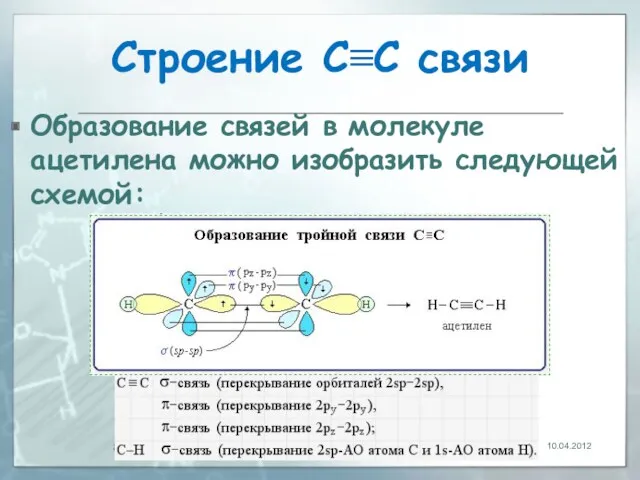
- 7. Строение С≡С связи Тройная связь является комбинацией из одной σ-и двух π-связей, образуемых двумя sp-гибридизованными атомами.
- 8. Строение С≡С связи Образование связей в молекуле ацетилена можно изобразить следующей схемой: 10.04.2012
- 9. Строение С≡С связи π-Cвязи располагаются во взаимно перпендикулярных плоскостях. σ-Cвязи, образуемые sp–гибридными орбиталями углерода, располагаются на
- 10. Номенклатура алкинов названия алкинов производят от названий соответствующих алканов (путем замены суффикса –ан на –ин: 2
- 11. Номенклатура алкинов Нумерацию углеродных атомов начинают с ближнего к тройной связи конца цепи. Цифра, обозначающая положение
- 12. Номенклатура алкинов Для простейших алкинов применяются исторически сложившиеся названия: ацетилен (этин), аллилен (пропин), кротонилен (бутин-1), валерилен
- 13. Номенклатура алкинов Если кроме тройной связи в молекуле есть двойные связи, то они будут иметь наименьшее
- 14. Назовите следующие алкины: CH2≡CH2 CH3—CH ≡ CH2 CH3—CH3—CH ≡ CH2 CH3—CH ≡ CH—CH3 CH2 ≡ CH—CH=CH2
- 15. Структурная изомерия алкинов 10.04.2012 1. Изомерия положения тройной связи (начиная с С4Н6):
- 16. Структурная изомерия алкинов 10.04.2012 2. Изомерия углеродного скелета (начиная с С5Н8):
- 17. Структурная изомерия алкинов 10.04.2012 3. Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:
- 18. Пространственная изомерия алкинов Пространственная изомерия относительно тройной связи в алкинах не проявляется, заместители могут располагаться только
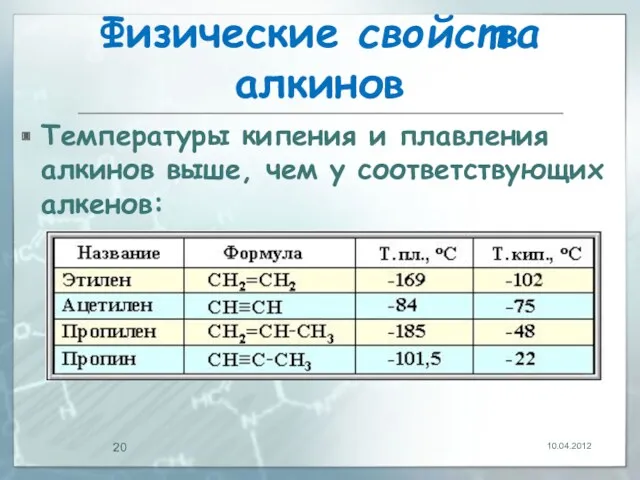
- 19. Физические свойства алкинов Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы. При
- 20. Физические свойства алкинов Температуры кипения и плавления алкинов выше, чем у соответствующих алкенов: 10.04.2012
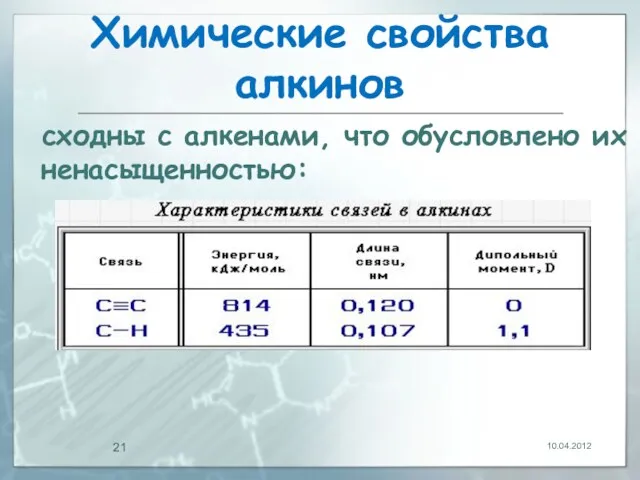
- 21. Химические свойства алкинов сходны с алкенами, что обусловлено их ненасыщенностью: 10.04.2012
- 22. Гидрирование (присоединение водорода) В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием алкенов (разрывается
- 23. Галогенирование (присоединение галогенов) Электрофильное присоединение галогенов к алкинам протекает медленнее, чем для алкенов (первая p-связь разрывается
- 24. Галогенирование (присоединение галогенов) Алкины обесцвечивают бромную воду (качественная реакция): 10.04.2012
- 25. Гидрогалогенирование (присоединение галогеноводородов) Присоединение галогеноводородов также идет по электрофильному механизму. Продукты присоединения к несимметричным алкинам определяются
- 26. Гидрогалогенирование (присоединение галогеноводородов) Гидрохлорирование ацетилена используется в одном из промышленных способов получения винилхлорида: Винилхлорид является исходным
- 27. Гидрогалогенирование (присоединение галогеноводородов) Реакция ускоряется в присутствии катализаторов (соли ртути или меди) и идет по нуклеофильному
- 28. Гидратация (реакция Кучерова) Присоединение воды происходит в присутствии катализатора соли ртути (II) и идет через образование
- 29. Гидратация (присоединение воды) или в кетон (в случае других алкинов) по нуклеофильному механизму : 10.04.2012
- 30. Полимеризация алкинов 1. Димеризация под действием водно-аммиачного раствора меди (CuCl): 10.04.2012
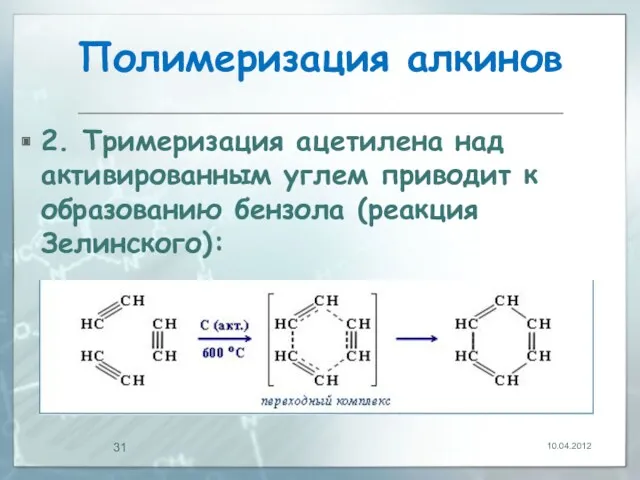
- 31. Полимеризация алкинов 2. Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского): 10.04.2012
- 32. Полимеризация алкинов 3. Реакция полимеризации с образованием циклических или линейных молекул: 10.04.2012
- 33. Полимеризация алкинов 4. окислительная поликонденсация ацетилена в присутствии CuCl (высокомолекулярное вещество – карбин образуется не в
- 34. Образование солей Алкины-1 вследствие полярности связи С(sp)-Н проявляют слабые кислотные свойства: атомы водорода могут замещаться атомами
- 35. Образование солей Если тройная связь находится не на конце цепи, то кислотные свойства отсутствуют (нет подвижного
- 36. Окисление алкинов Ацетилен и его гомологи окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых
- 37. Окисление алкинов Алкины обесцвечивают раствор KMnO4, что используется для их качественного определения: 10.04.2012
- 38. Окисление алкинов При сгорании (полном окислении) ацетилена выделяется большое количества тепла: Температура ацетиленово-кислородного пламени достигает 2800-
- 39. Получение алкинов I. Термический крекинг (пиролиз) метана : 10.04.2012
- 40. Получение алкенов II. Отщепление (элиминирование) двух атомов или групп атомов от соседних атомов углерода с образованием
- 41. Получение алкинов II. Гидролиз карбида кальция : Карбид кальция образуется при нагревании смеси оксида кальция СаО
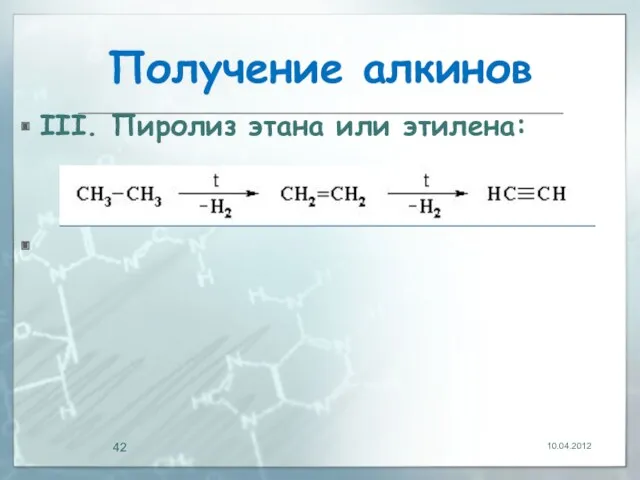
- 42. Получение алкинов III. Пиролиз этана или этилена: 10.04.2012
- 43. Применение алкинов Алкины применяются в качестве исходных продуктов в производстве полимерных материалов (пластмасс, каучуков, пленок) и
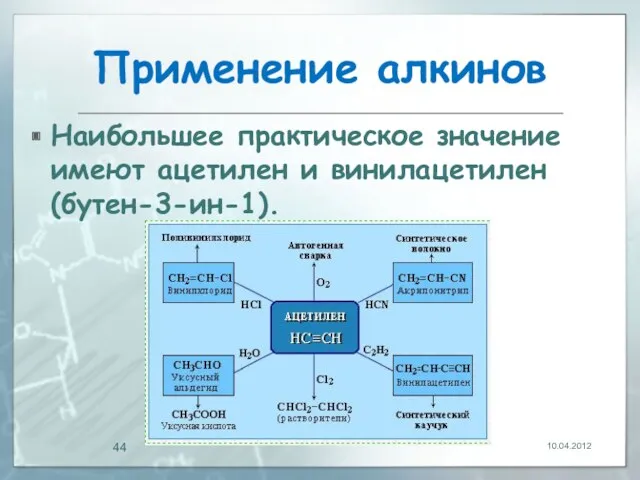
- 44. Применение алкинов Наибольшее практическое значение имеют ацетилен и винилацетилен (бутен-3-ин-1). 10.04.2012
- 45. Применение алкинов Винилацетилен является важным промежуточным продуктом в производстве масло- и бензостойкого синтетического хлоропренового каучука: 10.04.2012
- 46. 1.Контрольная работа 10.04.2012 Назовите и нарисуйте приведенные соединения. Какие из них относятся к алкинам: а) б)
- 47. 2. Контрольная работа 10.04.2012 Дайте названия следующих алкинов, полученных из алканов: - бутан - гептан -
- 48. 3.Контрольная работа 10.04.2012 Тройная связь является сочетанием: Ответ 1 : трех σ-связей Ответ 2 : одной
- 49. 4. Контрольная работа 10.04.2012 Какова гибридизация атомов углерода в следующей молекуле: Ответ 1 : 1 –
- 50. 5. Контрольная работа 10.04.2012 Изомерами 3-метилпентина-1 являются: Ответ 1 : а, в, д Ответ 2 :
- 51. 6. Контрольная работа 10.04.2012 Взрывчатое вещество образуется в реакции: Ответ 1 : Ответ 2 : Ответ
- 52. 7. Контрольная работа 10.04.2012 Из технического карбида кальция массой 1 кг получен ацетилен объемом 260 л
- 53. 8. Контрольная работа 10.04.2012 Укажите продукт Z в схеме превращений: Ответ 1 : а Ответ 2
- 54. Сравните получение алканов, алкенов, алкинов, проанализировав видеоролики из папки «Лабораторные опыты». 10.04.2012
- 55. Получение алканов Получение и свойства метана (видеоролик exp3.exe в папке лабораторные опыты) 10.04.2012
- 56. Получение алканов Получение и свойства метана. Уравнения реакций: Опишите роль каждого реактива в опытах 10.04.2012
- 57. Свойства алканов Взаимодействия алканов с бромом. Уравнения реакций: (видеоролик exp2.exe в папке лабораторные опыты) Опишите роль
- 58. Получение алкенов Получение и свойства этилена. Уравнения реакций: (видеоролик exp4.exe в папке лабораторные опыты) Опишите роль
- 60. Скачать презентацию


















































 Кремний и его соединения. Нахождение в природе
Кремний и его соединения. Нахождение в природе Plastic varieties and applications in construction
Plastic varieties and applications in construction Теория растворов электролитов и неэлектролитов
Теория растворов электролитов и неэлектролитов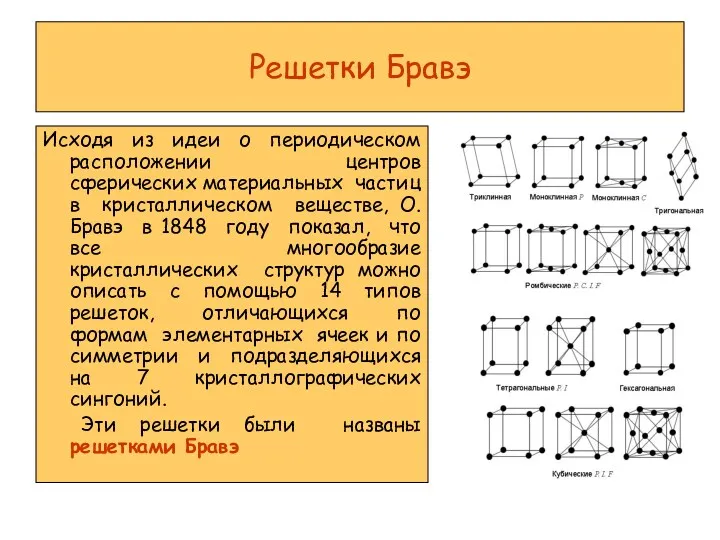 Решетки Бравэ
Решетки Бравэ Пищевые добавки
Пищевые добавки Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева
Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева Крахмал. Строение вещества. Физические и химические свойства
Крахмал. Строение вещества. Физические и химические свойства Мир первозданной красоты. Природные уникумы Урала
Мир первозданной красоты. Природные уникумы Урала Алюминий и его соединения
Алюминий и его соединения Экспериментально исследовательский проект Соль волшебница
Экспериментально исследовательский проект Соль волшебница Топаз. Хімічна формула топаза
Топаз. Хімічна формула топаза Техника безопасности и правила работы в лаборатории. 10 класс
Техника безопасности и правила работы в лаборатории. 10 класс Периодический закон и периодическая система элементов Д.И. Менделеева. Лекция 3
Периодический закон и периодическая система элементов Д.И. Менделеева. Лекция 3 Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник
Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник Углеводороды
Углеводороды Реакции ионного обмена
Реакции ионного обмена Оксиды азота
Оксиды азота Органикалық қосылыстардың гомологтық қатарлары
Органикалық қосылыстардың гомологтық қатарлары Медь и её соединения
Медь и её соединения Редкоземельные металлы
Редкоземельные металлы Кислоты. Индикаторы
Кислоты. Индикаторы Процесс в химическом реакторе
Процесс в химическом реакторе Массовая и объемная доля компонентов смеси
Массовая и объемная доля компонентов смеси Подгруппа углерода
Подгруппа углерода Свойства химических элементов и закономерность их изменения
Свойства химических элементов и закономерность их изменения Биогенді элементтер
Биогенді элементтер Функциональные производные с кратной связью C=“Э”. Часть 1. Карбонильные соединения и имины
Функциональные производные с кратной связью C=“Э”. Часть 1. Карбонильные соединения и имины Природный каучук
Природный каучук