Содержание
- 2. Я металл серебристый и легкий И зовусь самолетный металл. И покрыт я оксидною пленкой Чтоб меня
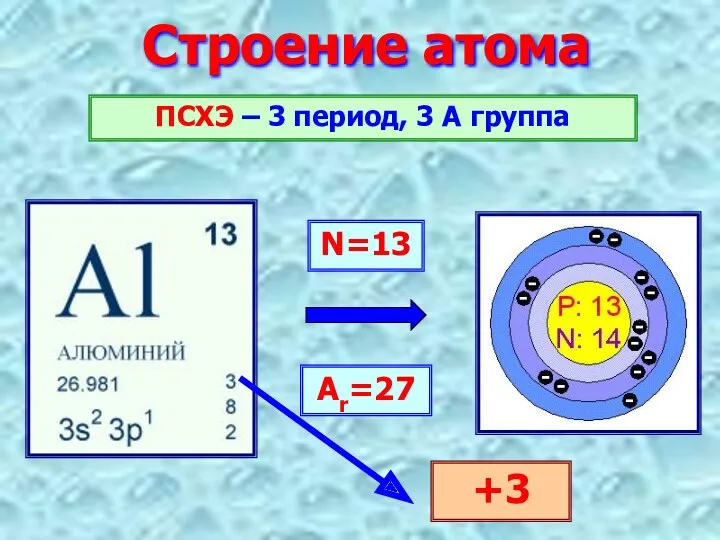
- 3. Строение атома N=13 Ar=27 ПСХЭ – 3 период, 3 А группа +3
- 4. Нахождение в природе Бокситы – Al2O3 • H2O Нефелины – KNa3[AlSiO4]4 Глиноземы - Al2O3 Берилл Гранат
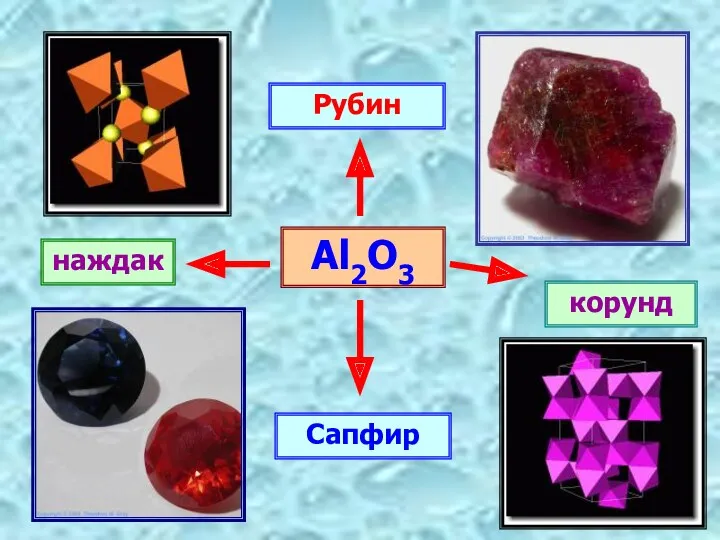
- 5. Рубин Сапфир Al2O3 наждак корунд
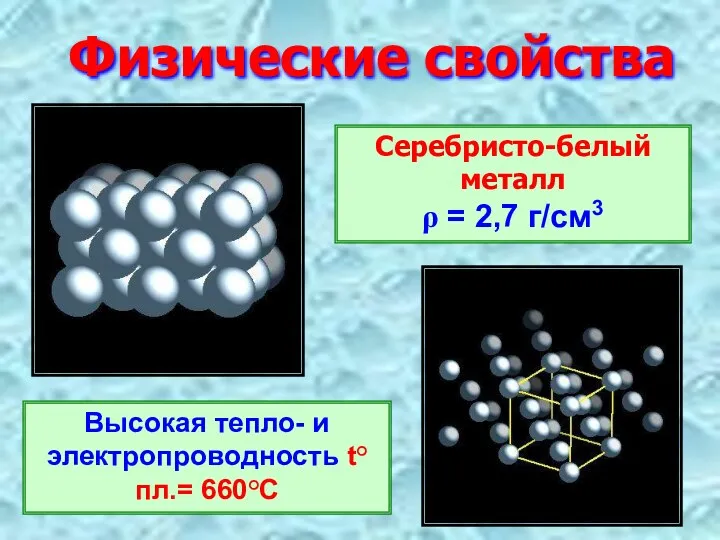
- 6. Физические свойства Серебристо-белый металл ρ = 2,7 г/см3 Высокая тепло- и электропроводность t°пл.= 660°C
- 7. Получение 2Al2O3 → 4Al + 3O2↑ Электролиз расплава Na3[AlF6] Катализатор
- 8. Химические свойства Al – покрыт прочной оксидной пленкой 4Al0 + 3O2 → 2Al+32O3 Al – восстановитель,
- 9. 2Al0 + 3S –t°→ Al2+3S3 2Al0 + N2 –t°→ 2Al+3N 4Al0 + 3С –t°→ Al4+3С3 Сульфид
- 10. 2Al0 + 3I20 → 2Al+3I3 Вода - катализатор
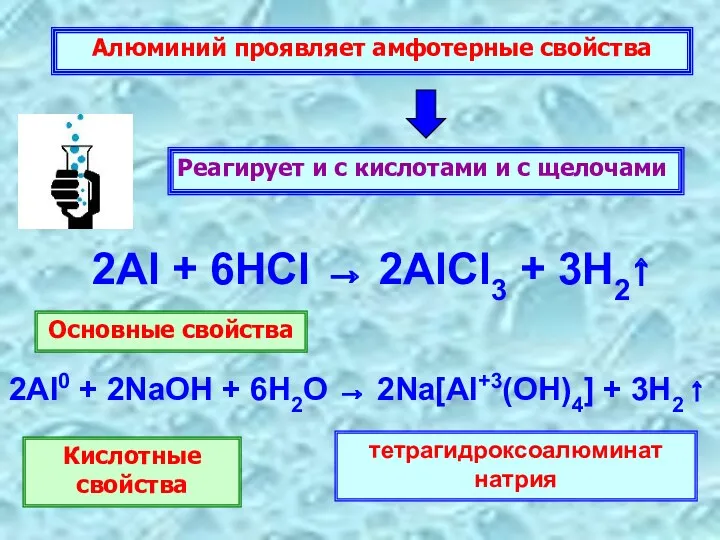
- 11. Алюминий проявляет амфотерные свойства Реагирует и с кислотами и с щелочами 2Al + 6HCl → 2AlCl3
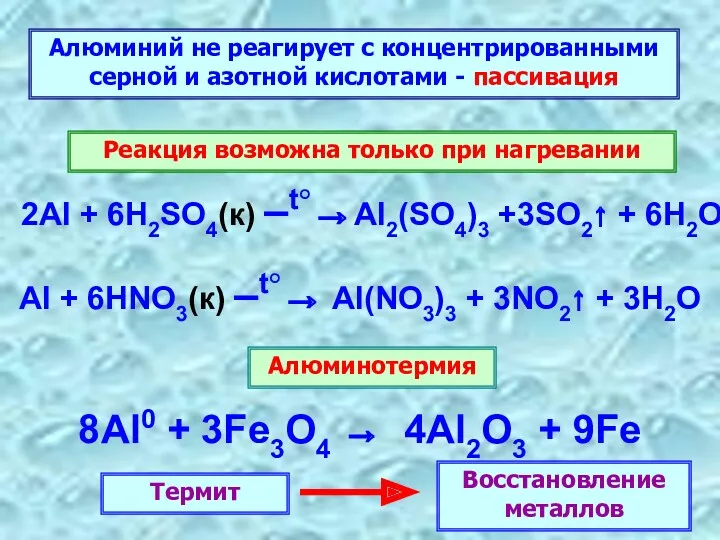
- 12. Алюминий не реагирует с концентрированными серной и азотной кислотами - пассивация 2Al + 6H2SO4(к) –t°→Al2(SO4)3 +3SO2↑
- 13. Реакция протекает с выделением тепла
- 14. Оксид алюминия Al2O3 O=Al–O–Al=O Глинозем Корунд Рубин Сапфир 4Al + 3O2 → 2Al2O3 2Al(OH)3 –t°→ Al2O3
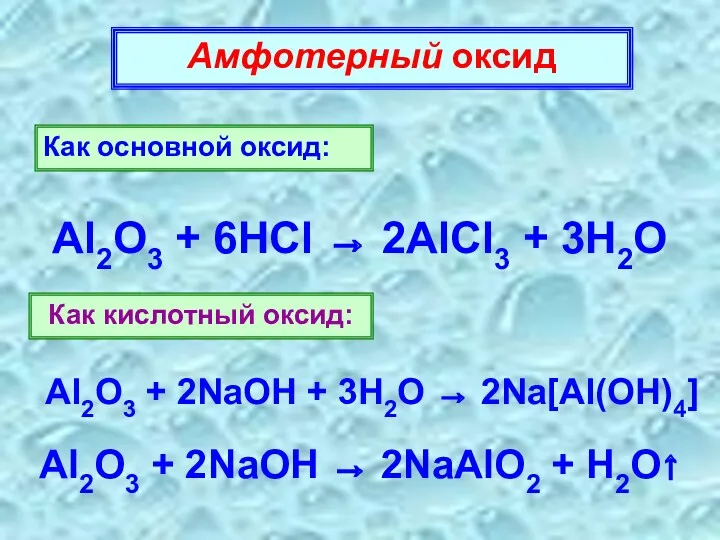
- 15. Амфотерный оксид Как основной оксид: Al2O3 + 6HCl → 2AlCl3 + 3H2O Как кислотный оксид: Al2O3
- 16. Гидроксид алюминия Al(OH)3 AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
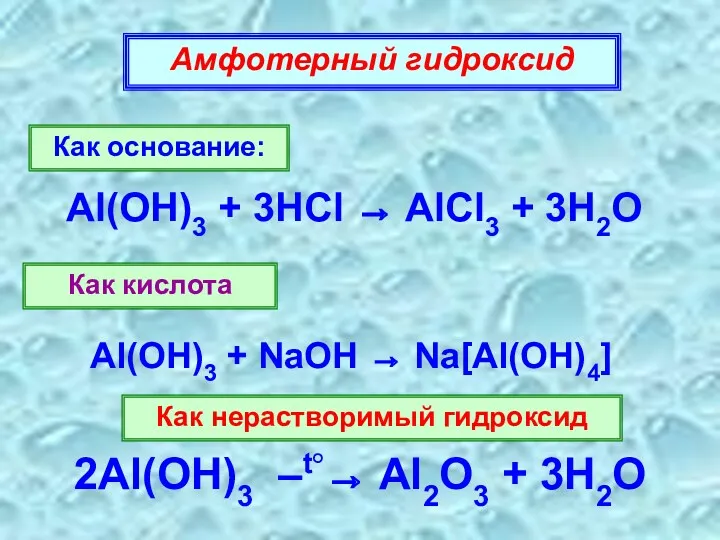
- 17. Амфотерный гидроксид Как основание: Al(OH)3 + 3HCl → AlCl3 + 3H2O Как кислота Al(OH)3 + NaOH
- 18. Применение
- 20. Скачать презентацию


![Получение 2Al2O3 → 4Al + 3O2↑ Электролиз расплава Na3[AlF6] Катализатор](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/401340/slide-6.jpg)







 Ертінділер. Ерітінді концентрациясын білдіру тәсілдері
Ертінділер. Ерітінді концентрациясын білдіру тәсілдері Жиры
Жиры Количество вещества. Единица измерения вещества моль
Количество вещества. Единица измерения вещества моль Кислоты, содержащие серу (S)
Кислоты, содержащие серу (S) Степень окисления. Определение степени окисления в соединениях
Степень окисления. Определение степени окисления в соединениях ОВР в органической химии
ОВР в органической химии Классификация и свойства оксидов
Классификация и свойства оксидов Лекция Атомное строение твердых тел. 1-01
Лекция Атомное строение твердых тел. 1-01 Классификация химических реакций
Классификация химических реакций Презентация по химии _Классификация веществ_ 11 класс
Презентация по химии _Классификация веществ_ 11 класс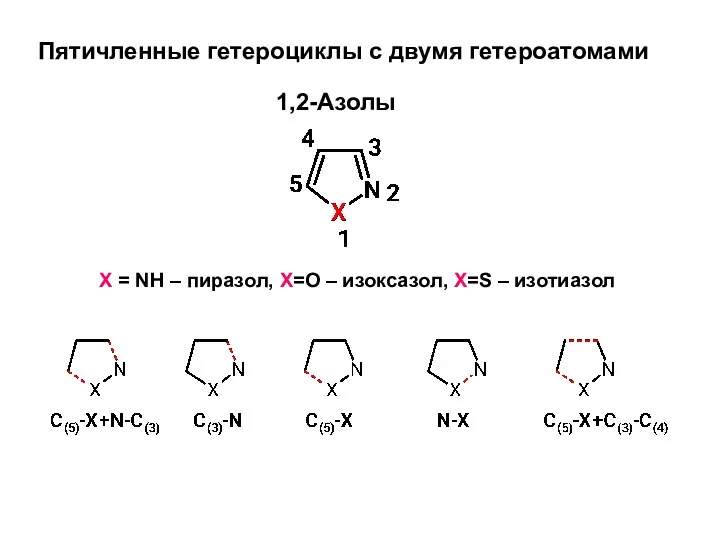 Пятичленные гетероциклы с двумя гетероатомами
Пятичленные гетероциклы с двумя гетероатомами Physiology lab
Physiology lab Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов
Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов Периодическая система химических элементов. Знаки химических элементов
Периодическая система химических элементов. Знаки химических элементов Природный газ
Природный газ Застосування арт-терапевтичних технік на уроках хімії
Застосування арт-терапевтичних технік на уроках хімії Нефть и ее роль в мировой экономике
Нефть и ее роль в мировой экономике Циклические углеводороды. Циклоалканы
Циклические углеводороды. Циклоалканы Основы химмотологии моторных топлив. Тема 3
Основы химмотологии моторных топлив. Тема 3 Швидкість хімічної реакції
Швидкість хімічної реакції Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Новые катализаторы
Новые катализаторы Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Металлы. Общая характеристика
Металлы. Общая характеристика Кремний и его соединения для 11 класса
Кремний и его соединения для 11 класса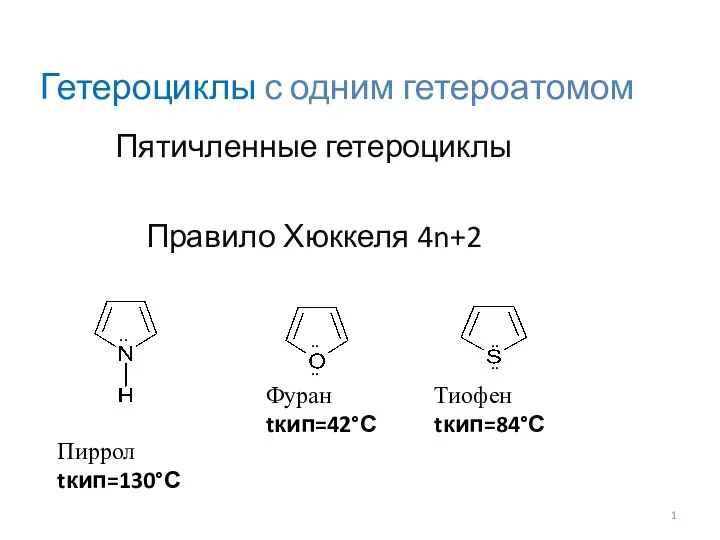 Гетероциклы с одним гетероатомом
Гетероциклы с одним гетероатомом Химический элемент, минерал, горная порода. (Лекция 6)
Химический элемент, минерал, горная порода. (Лекция 6) Химиялық тепе-теңдік
Химиялық тепе-теңдік