Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов презентация
Содержание
- 2. Расположение металлов в Периодической системе Д.И. Менделеева Условная граница между элементами-металлами и элементами-неметаллами проходит по диагонали:
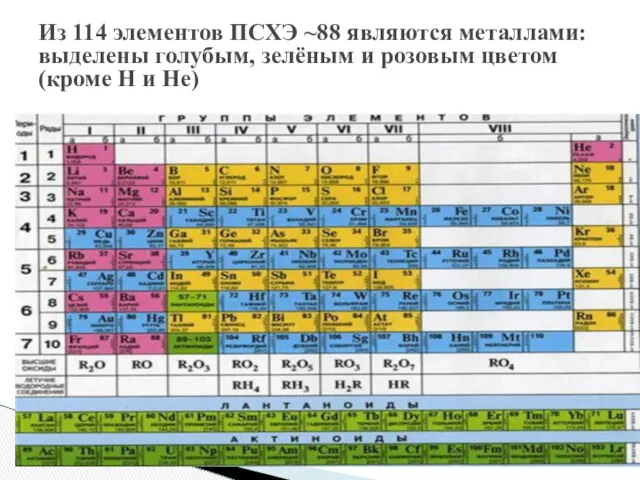
- 3. Из 114 элементов ПСХЭ ~88 являются металлами: выделены голубым, зелёным и розовым цветом (кроме H и
- 4. Щелочные металлы – это элементы главной подгруппы I группы Периодической системы химических элементов Д.И. Менделеева: литий,
- 5. e = 19 39 0 Калий
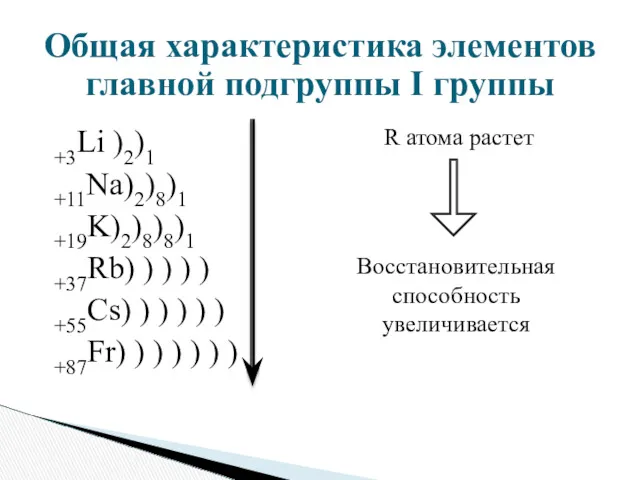
- 6. Общая характеристика элементов главной подгруппы I группы +3Li )2)1 +11Na)2)8)1 +19K)2)8)8)1 +37Rb) ) ) ) )
- 7. Общая характеристика элементов главной подгруппы II группы У в е л и ч и в а
- 8. 1. Небольшое число ē на последнем энергетическом уровне (1 - 3ē). 2. Относительно большой атомный радиус.
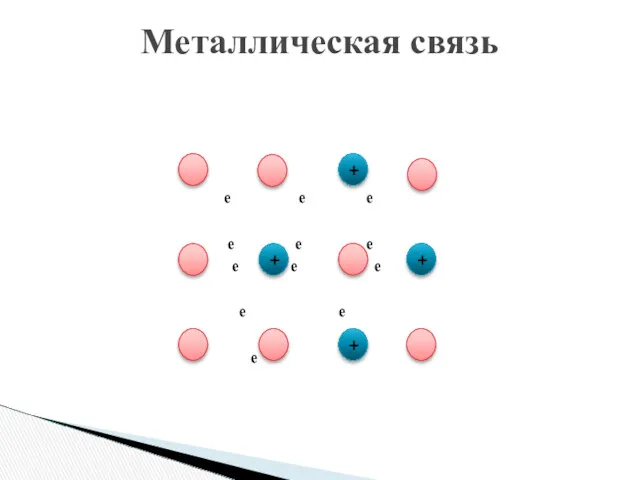
- 9. Металлическая связь e e e e e e e e e е е е + +
- 10. Металлическая связь – это связь в металлах и сплавах между атом- ионом посредством обобществления внешних электронов(«электронного
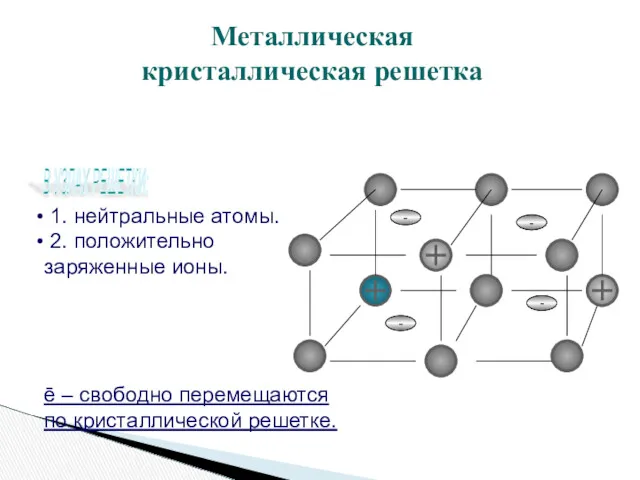
- 11. - - 1. нейтральные атомы. 2. положительно заряженные ионы. ē – свободно перемещаются по кристаллической решетке.
- 12. Твердость (кроме ртути) Пластичность Электропроводность Теплопроводность Плотность Металлический блеск Физические свойства металлов
- 13. Для всех металлов (кроме ртути) при обычных условиях характерно твердое агрегатное состояние. Однако твердость их различна.
- 14. Плотность металлов Легкие металлы (плотность меньше 5 г/см3). К ним относятся щелочные, щелочноземельные металлы и алюминий.
- 15. В самородном виде (Au, Ag, Pt) В виде соединений: оксидов сульфидов карбонатов сульфатов Нахождение металлов в
- 16. Индивидуальные вещества, образующие земную кору, называются минералами. Al2O3- корунд SiO2- кварц HgS-киноварь и т.д.
- 17. Аметист (SiO2)-сине-фиолетовая разновидность кварца Корунд - Al2O3
- 18. Из минералов сложены горные породы: Мрамор - CaSO4 Гранит – смесь кварца, полевого шпата и слюды
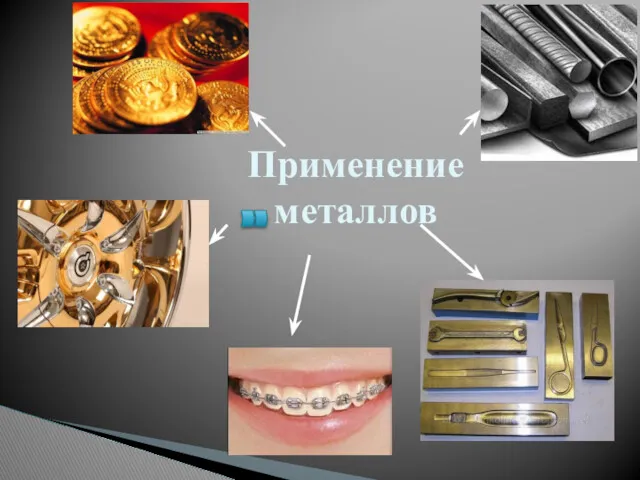
- 19. Применение металлов
- 20. Применение меди
- 21. Применение железа
- 23. Скачать презентацию















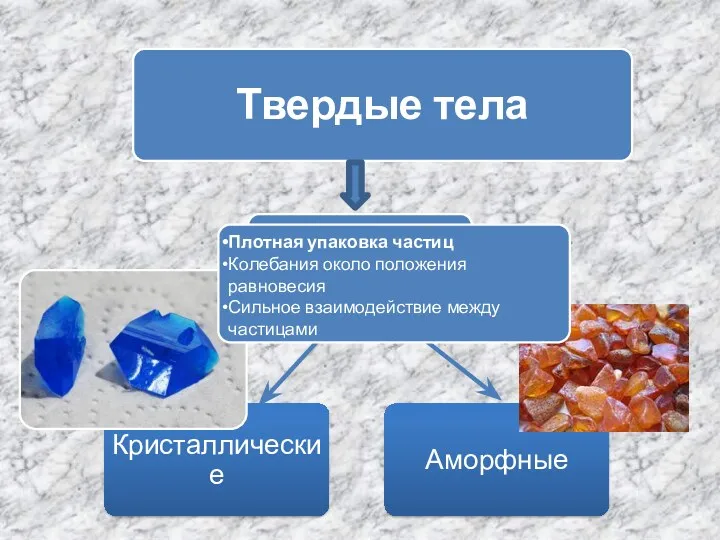 Твердые тела - кристаллические и аморфные
Твердые тела - кристаллические и аморфные Галогенопроизводные. Растворимость, общие закономерности
Галогенопроизводные. Растворимость, общие закономерности Відносна молекулярна маса
Відносна молекулярна маса Переработка угля
Переработка угля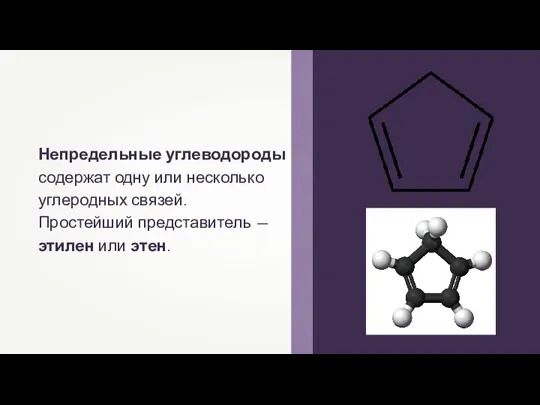 Физические и химические свойства алкенов
Физические и химические свойства алкенов Химические профессии на стройках Олимпиады
Химические профессии на стройках Олимпиады Щелочные металлы
Щелочные металлы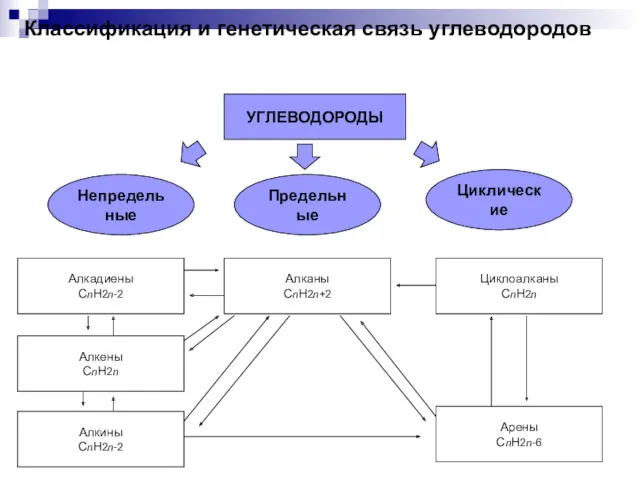 Классификация и генетическая связь углеводородов
Классификация и генетическая связь углеводородов Электрохимические накопители энергии
Электрохимические накопители энергии Таблицы. Определение характера оксидов
Таблицы. Определение характера оксидов Строение атома
Строение атома Магматические породы и постмагматические процессы
Магматические породы и постмагматические процессы Распространение водорода в природе. Получение в лаболатории
Распространение водорода в природе. Получение в лаболатории Кислородсодержащие соединения серы
Кислородсодержащие соединения серы Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии
Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии Узагальнення й систематизація знань з теми Початкові хімічні поняття
Узагальнення й систематизація знань з теми Початкові хімічні поняття Химиялық элемент алюминий
Химиялық элемент алюминий Полимеры, бумага
Полимеры, бумага Химическая кинетика. Тема 2.2
Химическая кинетика. Тема 2.2 Алкадиены
Алкадиены Метод электронного баланса для уравнивания окислительно-восстановительных реакций
Метод электронного баланса для уравнивания окислительно-восстановительных реакций Молекулярно-массовые характеристики высокомолекулярных соединений
Молекулярно-массовые характеристики высокомолекулярных соединений Правила ДСС
Правила ДСС Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Электронный помощник по химии 8 класс
Электронный помощник по химии 8 класс Дисперсные системы. (Лекция 6)
Дисперсные системы. (Лекция 6) Химия. D-элементтер
Химия. D-элементтер Аминокилоты. Свойства
Аминокилоты. Свойства