Содержание
- 2. Дисперсными называют гетерогенные системы , в которых одно вещество в виде очень мелких частиц равномерно распределено
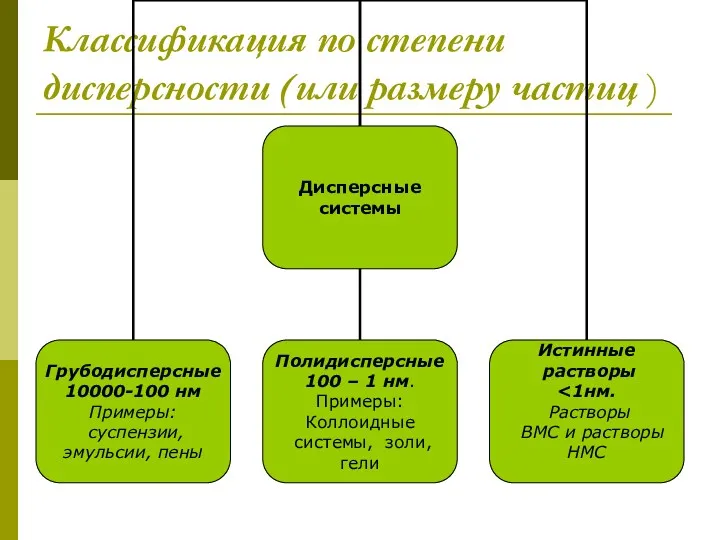
- 3. Классификация по степени дисперсности (или размеру частиц )
- 4. Суспензии – это грубодисперсные системы, в которых дисперсная фаза состоит из твердых частиц, взвешенных в жидкой
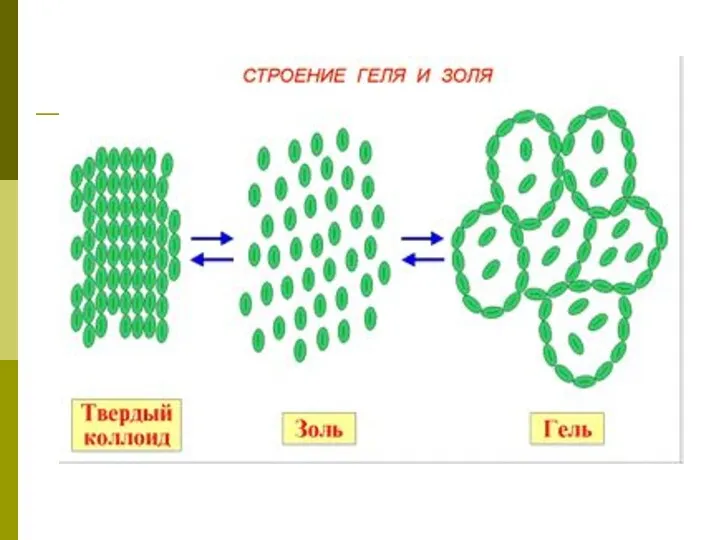
- 5. Коллоидные системы- это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм
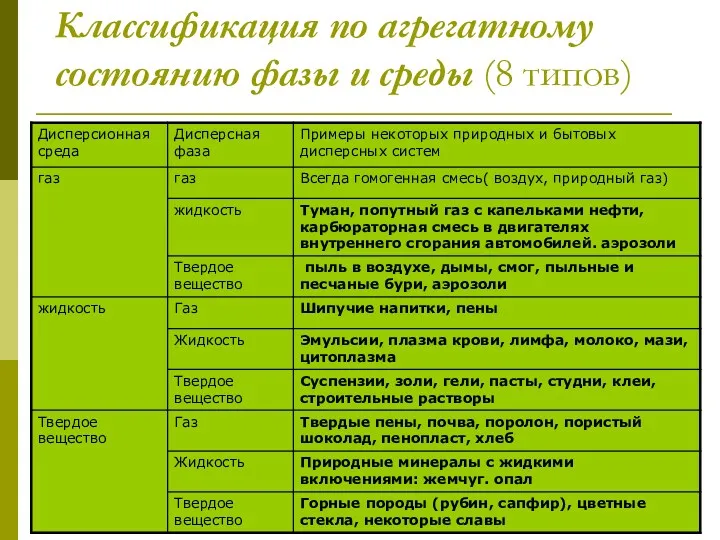
- 7. Классификация по агрегатному состоянию фазы и среды (8 типов)
- 8. Дисперсионные методы получения коллоидных систем механические – дробление, растирание, размол и т. д.; электрический – получение
- 9. Конденсационные методы физические: резкое охлаждение (образование тумана); замена лучшего растворителя на худший (раствор мыла в спирте
- 10. Химические способы проведение таких химических реакций, как окисление: 2H2S + O2 → 2H2O + 2S (золь
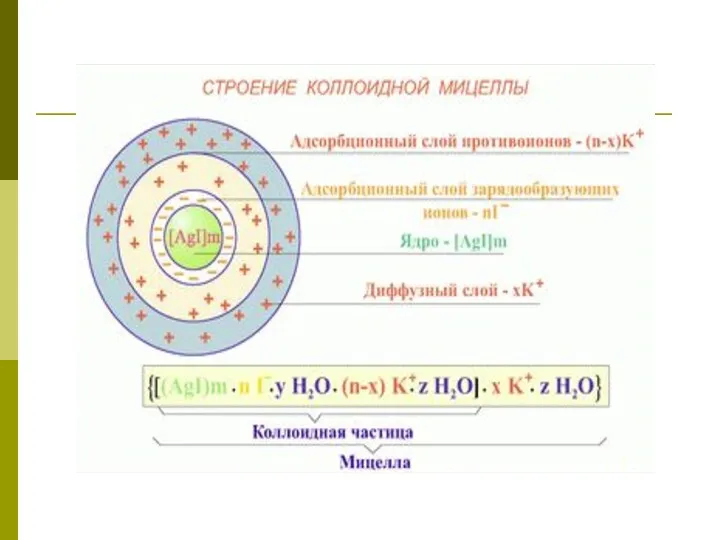
- 11. Теория Думанского и Пескова Коллоидный раствор состоит из мицелл (твердая или дисперсная фаза) и Интермицеллярной жидкости,
- 13. Схема мицеллы {mCuS nCu 2+ (n - х)SO42- }2х+ хSO42- ПОИ ПИ ДС __________ ________________ ядро
- 14. (mCuS) –это агрегат, на поверхности которого, согласно правилу Фаянса-Пескова: Из дисперсионной среды адсорбируются те ионы стабилизатора
- 15. Затем адсорбируются противоионы (ПИ), в данном случае SO42- в количестве (n – х). Ядро и ПИ
- 16. Устойчивость коллоидных растворов. Агрегативная устойчивость - сохранение размеров частиц. Седиментационная устойчивость – равномерное распределение частиц по
- 17. Правило Шульце-Гарди: коагуляцию коллоидных растворов вызывает не весь электролит, а только тот его ион, который противоположен
- 18. Коллоидные растворы в природе и технике. В природной воде содержится часть примесей в коллоидном состоянии. Поэтому
- 19. Применение Можно разделить коллоидные частицы и ионы через мембрану, проницаемую для молекул и ионов и непроницаемую
- 21. Скачать презентацию














 Классификация химических реакций
Классификация химических реакций Вуглеводи
Вуглеводи Атом. Модели строения атома
Атом. Модели строения атома AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі
AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі Сульфиды. Занятие 7
Сульфиды. Занятие 7 The main purpose of flour
The main purpose of flour Алкены. Состав, строение, свойства и химические превращения
Алкены. Состав, строение, свойства и химические превращения Тема 2. Электронный энергетический спектр как фундаментальная характеристика твердого тела. Перестройка энергетического спектра
Тема 2. Электронный энергетический спектр как фундаментальная характеристика твердого тела. Перестройка энергетического спектра Кам’яне вугілля, продукти його переробки
Кам’яне вугілля, продукти його переробки Строение атома и периодический закон
Строение атома и периодический закон Методи отримання основних класів неорганічних сполук
Методи отримання основних класів неорганічних сполук Липиды. Классификация липидов
Липиды. Классификация липидов Металл цирконий (ZR)
Металл цирконий (ZR) Электролитическая диссоциация
Электролитическая диссоциация Строение атома и атомного ядра. Периодическая система химических элементов. (Часть 2)
Строение атома и атомного ядра. Периодическая система химических элементов. (Часть 2) Способы выражения состава раствора. Задача 7
Способы выражения состава раствора. Задача 7 Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Аммиак
Аммиак Неметаллы
Неметаллы Аррениус Сванте Август
Аррениус Сванте Август Алкены. Химические свойства этилена
Алкены. Химические свойства этилена Кремний. Основные минералы кремния
Кремний. Основные минералы кремния Катализ и катализаторы. (Лекция 10)
Катализ и катализаторы. (Лекция 10) Кислотно-основное титрование
Кислотно-основное титрование Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.)
Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.) Горение взрывчатых веществ
Горение взрывчатых веществ Расчеты, связанные с понятием доля
Расчеты, связанные с понятием доля