Содержание
- 2. 10.1 Катализ и катализаторы 10.2 Кинетика фер-ментативных реак-ций. План
- 3. 10.1 Катализ – это явление изменения скорости реакции под влиянием ве-ществ, называемых катализаторами.
- 4. Катализаторы – это вещества, изменяющие скорость химической реак-ции, но не изменяющиеся в ходе процесса ни качествен-но,
- 5. Небольшие количества катализаторов способ-ны существенно изме-нить скорость взаимо-действия большого ко-личества реагирующих веществ.
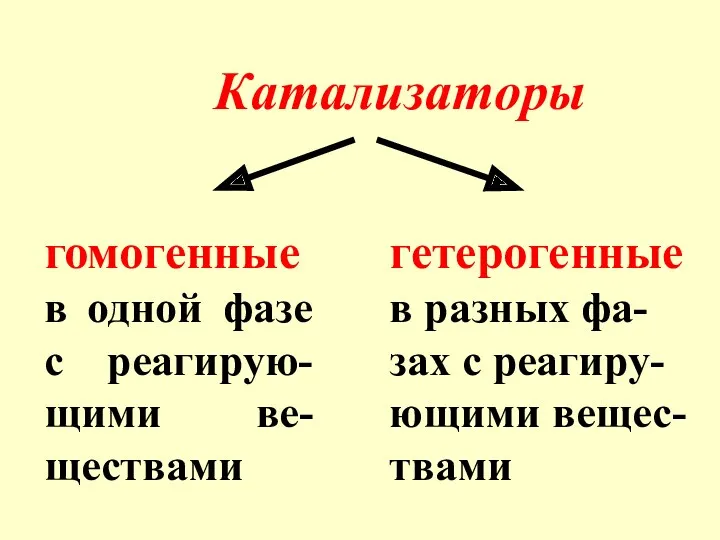
- 6. Катализаторы гомогенные в одной фазе с реагирую-щими ве-ществами гетерогенные в разных фа-зах с реагиру-ющими вещес-твами
- 7. Пример гетерогенного катализа
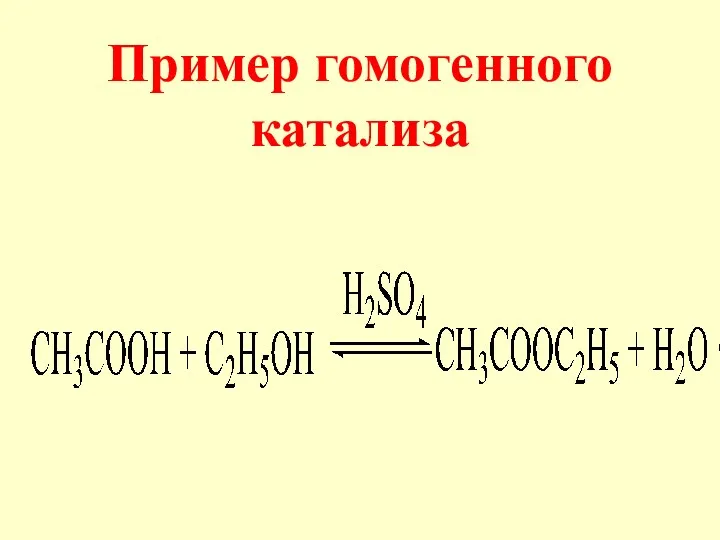
- 8. Пример гомогенного катализа
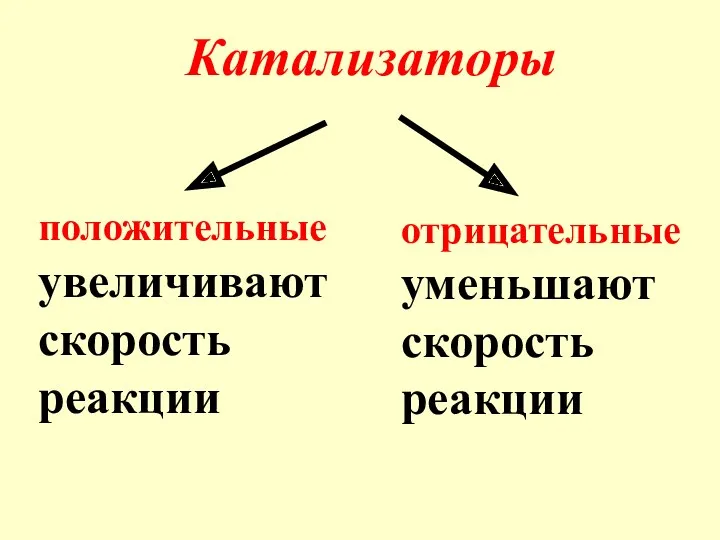
- 9. Катализаторы положительные увеличивают скорость реакции отрицательные уменьшают скорость реакции
- 10. Ингибаторы – вещества, уменьша-ющие скорость реак-ции, но расходую-щиеся при этом сами.
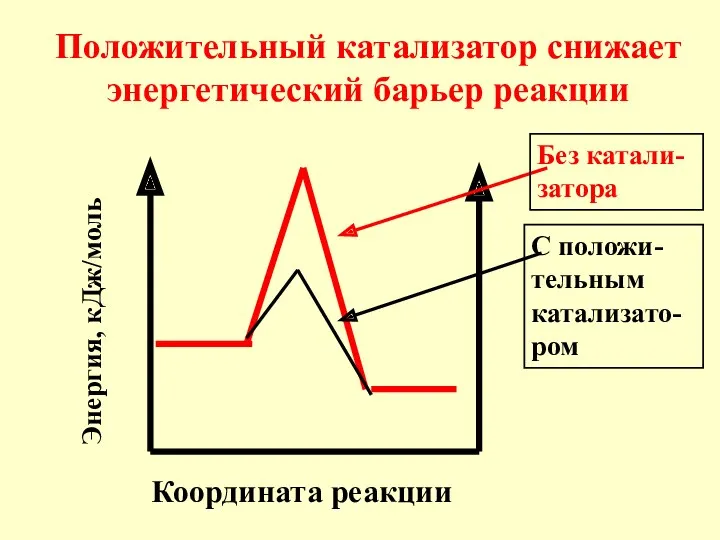
- 11. С точки зрения теории активного комплекса механизм действия катализаторов в том, что они изменяют высоту энергетического
- 12. Без катализатора: А + В ↔ А...В → АВ В присутствии катали-затора: А + В +
- 13. Координата реакции Положительный катализатор снижает энергетический барьер реакции Энергия, кДж/моль Без катали-затора С положи-тельным катализато-ром
- 14. Под воздействием поло-жительного катализатора в реакционной смеси возрастает доля актив-ных молекул при данной температуре. Скорость реакции
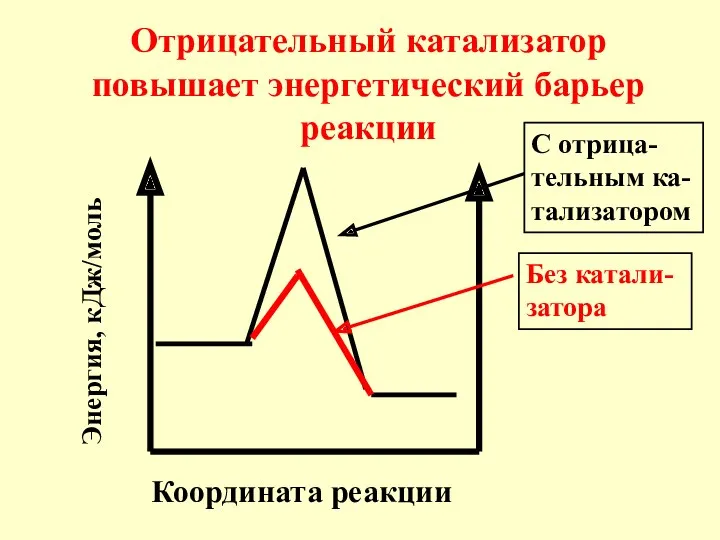
- 15. Координата реакции Отрицательный катализатор повышает энергетический барьер реакции Энергия, кДж/моль Без катали-затора С отрица-тельным ка-тализатором
- 16. Под воздействием отри-цательного катализатора в реакционной смеси снижается доля актив-ных молекул при данной температуре. Скорость реакции
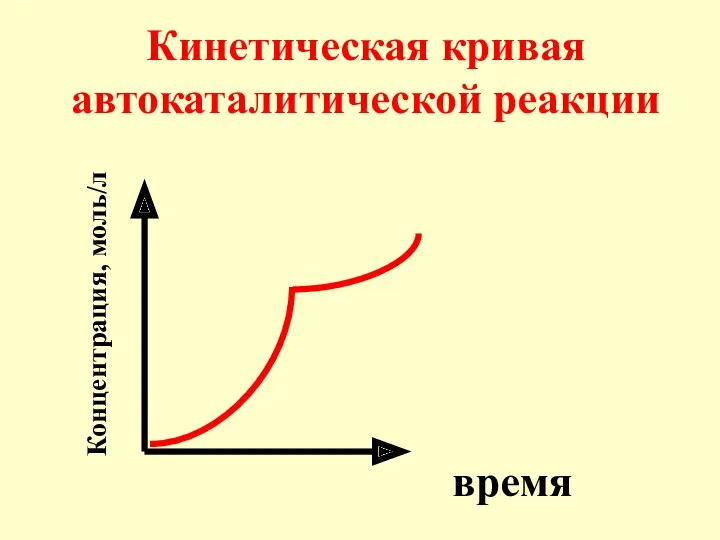
- 18. Частным случаем катализа является автокатализ: ката-лизатором служит один из продуктов реакции.
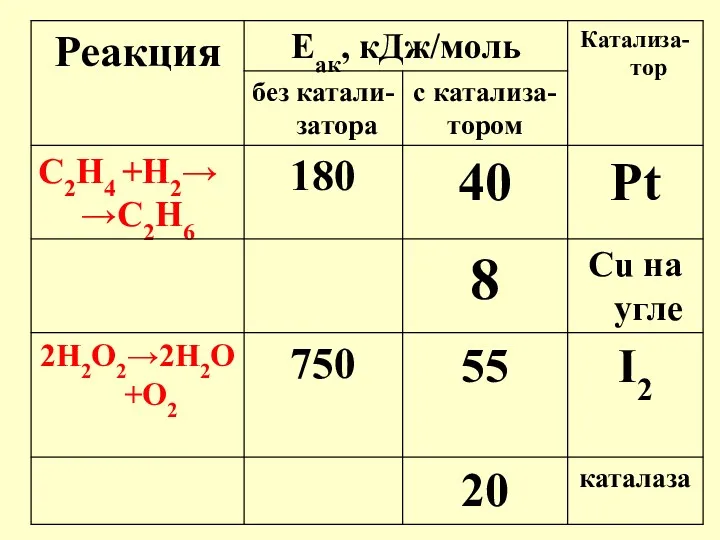
- 19. Пример автокаталити-ческой реакции: 2 KMnO4 + 5 H2C2O4 + 3 H2SO4 → 2 MnSO4 + 10
- 20. Кинетическая кривая автокаталитической реакции время Концентрация, моль/л
- 21. Разрушение озоново-го слоя Земли – пример гомогенного катализа, протекаю-щего в атмосфере под воздействием фреонов.
- 22. Фреоны – это фторо-хлороуглеводороды (СF2Cl2), применяемые как хладаген-ты. При обычных условиях они отличаются высокой устойчивостью к
- 23. В атмосфере происходит разложение фреонов под воздействием ультрафиолето-вого излучения солнца: CF2Cl2 → CF2Cl• + Cl• Cl•
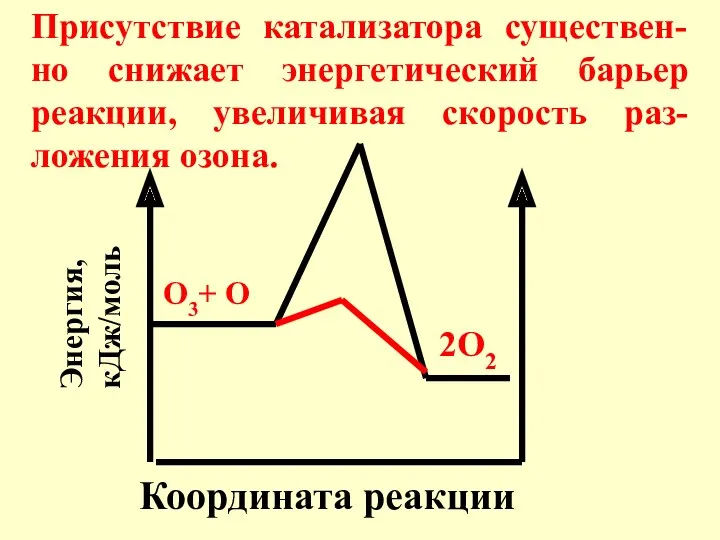
- 24. Без катализатора процесс протекает по схеме: O3 + O → 2 O2 Eак = 17,1 кДж/моль
- 25. В присутствии катализатора: O3 + Cl → ClO + O2 Eак= 2,1 кДж/моль ClO + O
- 26. Координата реакции Энергия, кДж/моль О3+ О 2О2 Присутствие катализатора существен-но снижает энергетический барьер реакции, увеличивая скорость
- 27. Вещества, усиливаю-щие действие катализа-торов, называются про-моторами, а ослабляю-щие - каталитическими ядами.
- 28. 10.2 Практически все биохимические реакции являются ферментативны-ми. Ферменты (биокатализато-ры) – это вещества белковой природы, активированные катионами
- 29. Известно около 2000 различных ферментов, ~150 из них выделены, причем некоторые используются в качестве лекарственных препа-ратов.
- 30. Трипсин и химотрипсин – лечение бронхитов и пнев-монии; пепсин – лечение гастрита; плазмин – лечение инфаркта;
- 31. Ферменты отличаются от обычных катализаторов: а) более высокой каталитической актив-ностью; б) высокой специфич-ностью, т.е. избиратель-ностью действия.
- 32. Механизм ферментативной реакции можно представить схемой: P+ KM k2 Лимитирующая стадия
- 33. Е – фермент, S – субстрат, ЕS – фермент- субстратный комплекс, Р – продукт
- 34. Характеристикой пер-вой стадии фермента-тивной реакции явля-ется КМ – константа Михаэлиса. КМ является величиной, обратной константе равновесия.
- 35. KM KM = 10‾5–10‾3 моль/л
- 36. КМ характеризует ус-тойчивость фермент-субстратного комп-лекса (ES). Чем меньше КМ, тем ус-тойчивее комплекс .
- 37. Кинетическое уравнение: υ = k2 [ES], (1) где k2 – константа скорости, называемая числом оборотов или
- 38. k2 равна числу молекул субстрата, претерпеваю-щих превращения под воздействием одной моле-кулы фермента за 1 ми-нуту при
- 39. Для уреазы, ускоряющей гидролиз мочевины: k2 = 1,85∙106 мин‾1 Для аденозинтрифосфатазы, ускоряющей гидролиз АТФ: k2 =
- 40. Существенным недостатком уравнения (1) является невоз-можность экспериментального определения [ES]. Выразив [ES] через другие величины, получаем кинетическое
- 41. υ = [E]общ [S] KM + [S] k2 Уравнение Михаэлиса-Ментен
- 42. Произведение k2[E]общ является величиной постоянной, которую обозначают υmax (мак-симальная скорость).
- 43. Соответственно: υ = υmax [S] KM + [S]
- 44. При низкой концентрации субстрата KM >> [S], поэтому υ = υmax KM [S] Кинетическое уравнение реакции
- 45. 2) При высокой концент-рации субстрата Км Кинетическое уравнение реакции 0-го порядка υ = υmax
- 46. Кинетическая кривая ферментативной реакции [S] υ Реакция нулевого порядка Реакция первого порядка
- 47. 3) Если [S] = КМ, то υ = υmax 2 что позволяет графически определять Км ,
- 48. [S] υmax 2 υmax KM Графическое определение константы Михаэлиса(KM)
- 49. На активность фермен-тов оказывают влия-ние: а) температура, б) кислотность среды, в) наличие ингибиторов
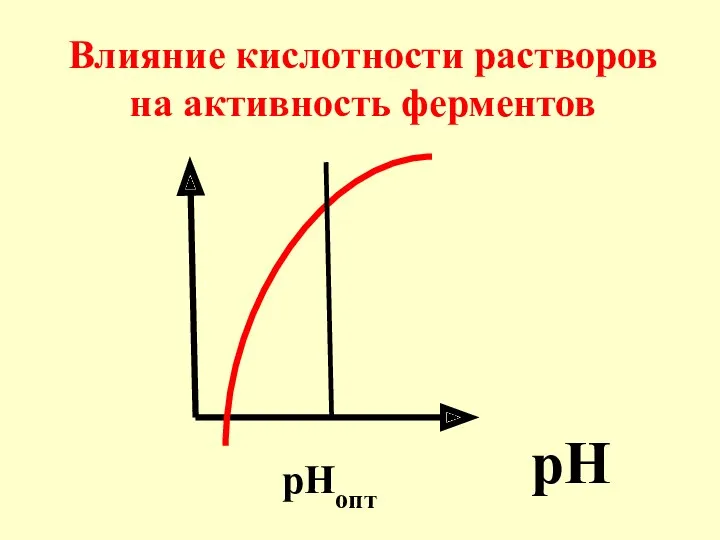
- 50. pH рНопт Влияние кислотности растворов на активность ферментов
- 51. Для большинства ферментов опти-мальные значения рН совпадают с физиологическими значениями (7,3-7,4).
- 52. Однако существуют фер-менты, для нормального функционирования кото-рых нужна сильнокислая (пепсин – 1,5-2,5) или достаточно щелочная среда
- 53. Ингибиторы ферментов – это вещества, занима-ющие часть активных центров молекул фермен-та, в результате чего скорость ферментативной
- 54. В роли ингибиторов выступают катионы тяжелых металлов, органические кислоты и другие соединения.
- 55. "Ключ к познанию ферментов лежит в изучении скоростей реакций". Дж.Холдейн
- 57. Скачать презентацию

























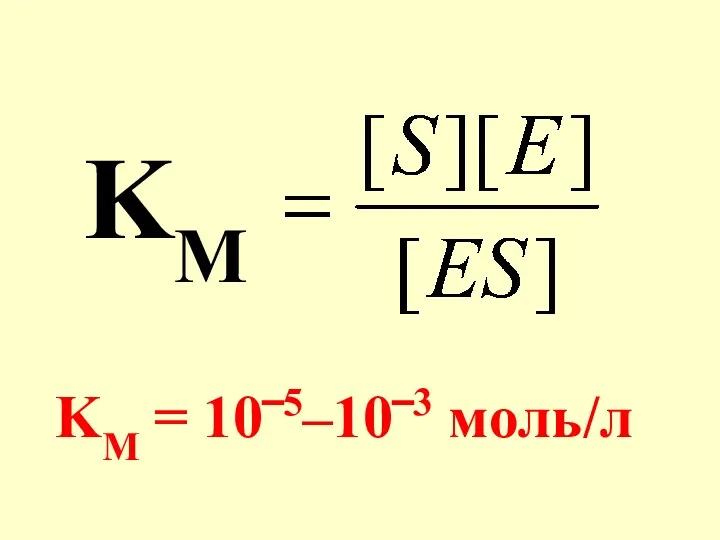

![Кинетическое уравнение: υ = k2 [ES], (1) где k2 –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/310227/slide-36.jpg)


![Существенным недостатком уравнения (1) является невоз-можность экспериментального определения [ES]. Выразив](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/310227/slide-39.jpg)
![υ = [E]общ [S] KM + [S] k2 Уравнение Михаэлиса-Ментен](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/310227/slide-40.jpg)
![Произведение k2[E]общ является величиной постоянной, которую обозначают υmax (мак-симальная скорость).](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/310227/slide-41.jpg)
![Соответственно: υ = υmax [S] KM + [S]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/310227/slide-42.jpg)
![При низкой концентрации субстрата KM >> [S], поэтому υ =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/310227/slide-43.jpg)

![Кинетическая кривая ферментативной реакции [S] υ Реакция нулевого порядка Реакция первого порядка](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/310227/slide-45.jpg)
![3) Если [S] = КМ, то υ = υmax 2 что позволяет графически определять Км ,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/310227/slide-46.jpg)
![[S] υmax 2 υmax KM Графическое определение константы Михаэлиса(KM)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/310227/slide-47.jpg)





 Инертные газы
Инертные газы Химия в быту
Химия в быту Неметаллы. Элементы неметаллы в ПСХЭ
Неметаллы. Элементы неметаллы в ПСХЭ Зависимость свойств веществ от типа химической связи и кристаллической решетки
Зависимость свойств веществ от типа химической связи и кристаллической решетки Положение металлов в Периодической системе
Положение металлов в Периодической системе Использование технологии уровневой дифференциации на уроках химии
Использование технологии уровневой дифференциации на уроках химии Способы производства железоуглеродистых сплавов
Способы производства железоуглеродистых сплавов Положение тугоплавких металлов в Периодической системе элементов
Положение тугоплавких металлов в Периодической системе элементов Cromatografie de lichide de inalta performanta cuplata cu spectrometrie de masă
Cromatografie de lichide de inalta performanta cuplata cu spectrometrie de masă Белки. Строение и свойства
Белки. Строение и свойства Симметрия в химии
Симметрия в химии 20230306_gidroliz
20230306_gidroliz Вуглеводи
Вуглеводи Полиэтилен — термопластичный полимер этилена
Полиэтилен — термопластичный полимер этилена Тему Соли. Нитрат серебра(I) AgNO3
Тему Соли. Нитрат серебра(I) AgNO3 Целлюлоза
Целлюлоза Обобщение по теме Неметаллы
Обобщение по теме Неметаллы Хром. Элемент VI группы побочной подгруппы
Хром. Элемент VI группы побочной подгруппы Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Анализ качества лекарственных и косметических лекарственных средств из группы галогенидов щелочных металлов
Анализ качества лекарственных и косметических лекарственных средств из группы галогенидов щелочных металлов Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Общая характеристика неметаллов
Общая характеристика неметаллов Химические свойства металлов
Химические свойства металлов Чистые вещества и смеси. 8 класс
Чистые вещества и смеси. 8 класс Кальций. Химиялық қасиеті
Кальций. Химиялық қасиеті Моющие средства
Моющие средства №9 зертханалық жұмыс
№9 зертханалық жұмыс Значення хімії у житті людини
Значення хімії у житті людини